过氧化物酶增殖物激活受体β/δ在银屑病角质形成细胞中的表达
2014-12-04胡小平张伟陈办成陈史宏王勇强于波
胡小平 张伟 陈办成 陈史宏 王勇强 于波
过氧化物酶增殖物激活受体β/δ在银屑病角质形成细胞中的表达
胡小平 张伟 陈办成 陈史宏 王勇强 于波
目的探讨过氧化物酶增殖物激活受体β/δ(PPARβ/δ)在银屑病患者表皮角质形成细胞(KC)中的表达和调节因素。方法免疫组化方法检测PPARβ/δ在银屑病患者皮损及非皮损表皮中的表达。分离、培养银屑病患者非皮损区和皮损区的KC,以RT-PCR和Western印迹法分别检测银屑病患者皮损区和非皮损区KC中PPARβ/δ mRNA和蛋白质的表达水平。利用PPARβ/δ外源性激动剂GW501516及Ca2+刺激银屑病非皮损区KC,观察其对PPARβ/δ表达的调节影响。结果免疫组化显示,银屑病皮损区PPARβ/δ的表达强度显著高于正常对照组(t=19.28,P<0.01)和非皮损区(t=23.26,P<0.01)。银屑病皮损区PPARβ/δ mRNA和蛋白质的表达水平均高于正常对照组(P<0.01)和非皮损区(P<0.01)。10 ng/ml GW501516最大效能促进PPARβ/δ的表达(P<0.01);1.0 mmol/L Ca2+对KC中PPARβ/δ的表达促进效应最明显(P<0.01)。结论PPARβ/δ在银屑病患者皮损区表达显著升高,GW501516和Ca2+能够促进角质形成细胞PPARβ/δ表达水平。
银屑病;角蛋白细胞;过氧化物酶体增生物激活受体β/δ
过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptors,PPAR)是一类激素核受体超家族成员。现已证实有3种不同的PPAR亚型:PPARα、PPARβ/δ、PPARγ。人皮肤角质形成细胞(KC)中,PPARβ/δ是主要的亚型。研究发现, PPARβ/δ能够刺激KC增殖并阻止凋亡[1],而寻常性银屑病的炎症增殖性斑块是其主要临床特点,提示PPARβ/δ表达异常可能和寻常性银屑病发病有一定的关系。我们通过研究银屑病皮损KC中PPARβ/δ mRNA和蛋白水平的表达变化和影响因素,分析PPARβ/δ在银屑病发病中的意义。
对象与方法
一、对象
2012年1-11月,在我院皮肤科门诊就诊的经病理确诊的进行期寻常性银屑病患者20例(20~ 56岁),其中男11例,女9例。每例患者均取皮损及皮损旁3 cm内非皮损组织各一块。15例(19~58岁)正常人皮肤来自我院皮肤科和整形外科,其中男8例,女7例。所有标本分为2部分,一部分4%甲醛固定、石蜡包埋行免疫组化染色,另一部分保存在0.5%分散酶中4℃过夜。所有对象均排除糖尿病、高血脂、冠心病等内科疾病。本实验经过医院伦理委员会批准,患者均签署知情同意书。
二、方法
1.引物设计和合成:用DNAStar软件设计引物,PPARβ/δ上游引物为5′-GAGCAGCCA CAGGA GGAAGCC-3′;下游引物为5′-CCGTCACAGCCCAT CTGCAGT-3′,扩增片段长度200 bp。内对照GAPDH上游引物:5′-TGAAGGTCGGAGTCAACGG-3;下游引物:5′-TGGAAGATGGTGATGGGAT-3,扩增片段长度为223 bp。所有引物均由上海生工生物工程技术服务有限公司合成。
2.试剂和材料:无血清KC培养基(KSFM), 0.5%分离酶(美国Gibco公司),胎牛血清、0.25%胰酶/EDTA(美国Peprotech公司);GW501516试剂(上海浩天然生物技术有限公司)。即用型免疫组化超敏SP试剂盒(兔)和DAB显色试剂盒,TaqDNA聚合酶和标准参照物均购于深圳晶美生物工程有限公司。RT-PCR逆转录试剂盒,Trizol和PPARβ/δ抗体购于美国Promega和Gibco BRL公司。
3.免疫组化染色:检测PPARβ/δ在正常表皮、银屑病皮损和非皮损中的表达。SP法按照说明书进行。一抗为山羊抗人PPARβ/δ单克隆抗体(1∶100稀释),4℃过夜。二抗为生物素化兔抗羊IgG,37℃孵育30 min,PBS冲洗2 min×3。滴加辣根过氧化物酶标记链霉亲和素,37℃孵育15 min,PBS冲洗5 min×4。DAB(20倍稀释)显色6 min,苏木素复染细胞核,双蒸水冲洗,常规脱水、透明,封片。PBS代替一抗作为空白对照。胞核中出现棕黄色颗粒判为阳性细胞。应用多功能真彩色病理图像分析系统对表皮中PPARβ/δ的表达进行半定量检测。
4.表皮KC的分离和培养:手术后保存在0.5%分散酶中的正常人、银屑病非皮损区和皮损区皮肤标本在4℃过夜后,无菌操作台中分离表皮和真皮。将分离的表皮采用胰酶消化法,37℃,5%CO2培养、传代,所有的实验均利用2~3代对数生长期的KC。不同浓度PPARβ/δ外源性激动剂GW501516 (0、1、5、10、25、50、100 ng/ml)和不同浓度的CaCl2(0、0.5、1.0、2.0、3.0 mmol/L)分别与银屑病非皮损区KC共同培养(n=12,方法同上)。
5.RT-PCR:25 μl PCR扩增反应体系中包括10 mmol各对上下游引物、200 mmo1/L dNTP混合液、2.5 mmol/L MgCl2,pH 8.3 l0 mmol/LTris-HCI, 50 mmol/L KCl,2U Taq酶、1 μl cDNA,DEPC水补足25 μl。反应程序为:96℃3 min,1个循环;96℃1 min 10 s,57℃1 min 10 s,72℃1 min 20 s。35个循环;72℃7 min。以GAPDH为内参照。空白对照为无逆转录酶的逆转录样本,以排外可能来源于污染的基因组DNA的扩增。退火温度为55℃。反应产物在琼脂糖凝胶中电泳后观察并拍照。
6.Western印迹:把培养瓶置于冰上,加入冰冷300 μl裂解液,于冰上裂解30 min,4℃下13 500×g离心10 min后取上清20ul用于蛋白质定量制备蛋白样品;根据标准曲线计算出蛋白浓度;将定量好的蛋白质按40 μg量上样SDS-PAGE电泳。4℃层析柜中进行转膜,250 mA 2 h。将一抗用封闭液稀释至适当浓度,放入PVDF膜,室温下孵育1~2 h后,移至肥皂盒中于室温下用PBST在摇床上洗3次,每次10 min。同上方法准备二抗稀释液(1∶3 000)并与膜接触。ECL反应及曝光、显影。
7.图像分析和数据处理:采用Image ProPlus 6.0图像分析软件测定各条带A值,基因转录和蛋白质表达水平的半定量采用目标基因条带A值与对应的GAPDH基因条带A值的比值计算,数据的表达为±s。统计学分析采用SPSS13.0统计软件包进行。均数的比较采用t检验。P<0.05被认为差异有统计学意义。
结果
一、PPARβ/δ的免疫组化染色结果
银屑病皮损区阳性细胞主要位于基底层上部细胞;正常对照组及非皮损区阳性细胞散在表达于全层角质形成细胞,主要为细胞核着色,呈棕黄色。银屑病皮损区PPARβ/δ(0.636±0.031)的表达强度显著高于正常对照组(0.364±0.052)和非皮损区(0.363±0.041),t值分别为19.28、23.26,均P<0.01;正常对照组和非皮损区表达强度差异无统计学意义(t=0.073,P>0.05)。见图1。
二、正常人和银屑病皮损PPARβ/δ mRNA和蛋白的表达

图1 PPARβ/δ的免疫组化染色结果(SP×400) 1a:正常表皮棕色颗粒散在表达于角质形成细胞核;1b:银屑病非皮损区棕色颗粒散在表达于角质形成细胞核;1c:银屑病皮损区棕色颗粒主要表达在棘层和颗粒层角质形成细胞核
PPARβ/δmRNA的表达:所有样本均有表达,银屑病皮损区表皮KC中,PPARβ/δmRNA表达量最高。在皮损区为0.342±0.032,非皮损区为0.205± 0.024,正常人表皮为0.195±0.026。皮损区与非皮损区(t=15.16,P<0.01),皮损区与正常人表皮之间(t=14.4,P<0.01)表达差异均有统计学意义;非皮损与正常人皮肤之间表达,差异无统计学意义(t= 1.125,P>0.05)。见图2。

图2 2a:PPARβ/δmRNA逆转录PCR产物电泳图 1:正常人表皮;2:非皮损;3,4:皮损;5:空白对照。GAPDH/223 bp为内参照。2b:正常人和银屑病皮损PPARβ/δ蛋白的表达 1:正常人表皮;2:非皮损;3,4:皮损。GAPDH/36 000为内参照
PPARβ/δ蛋白的表达:PPARβ/δ蛋白和mRNA表达量相符。
三、不同浓度GW501516(0,1,5,10,25,50, 100 ng/ml)和Ca2+(0,0.5,1.0,2.0,3.0 mmol/L)分别与12例银屑病非皮损区KC共同培养后,PPARβ/δmRNA和蛋白质的表达量
PPARβ/δmRNA的表达:GW501516在10 ng/ml浓度时最大效能促进PPARβ/δmRNA的表达,趋势类似抛物线,浓度在100 ng/ml时表达量回到基线水平(P>0.05)。Ca2+浓度在1.0 mmol/L时,PPARβ/ δmRNA表达最明显,浓度在3.0 mmol/L时表达量回到基线水平(P>0.05)。
PPARβ/δ蛋白表达:PPARβ/δ蛋白和mRNA表达量相符。见表1,2。
表1 不同浓度GW501516对银屑病非皮损区角质形成细胞PPARβ/δmRNA和蛋白的表达(±s)
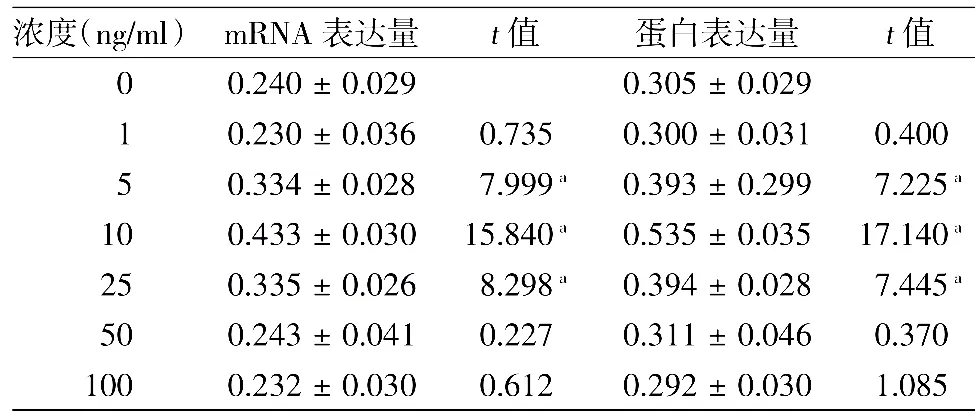
表1 不同浓度GW501516对银屑病非皮损区角质形成细胞PPARβ/δmRNA和蛋白的表达(±s)
注:n=12。a:与基线相比,差异有统计学意义P<0.01
浓度(ng/ml) mRNA表达量 t值 蛋白表达量 t值0 0.240±0.029 0.305±0.029 1 0.230±0.036 0.735 0.300±0.031 0.400 5 0.334±0.028 7.999a 0.393±0.299 7.225a 10 0.433±0.030 15.840a 0.535±0.035 17.140a 25 0.335±0.026 8.298a 0.394±0.028 7.445a 50 0.243±0.041 0.227 0.311±0.046 0.370 100 0.232±0.030 0.612 0.292±0.030 1.085
表2 不同浓度Ca2+对银屑病非皮损区角质形成细胞PPARβ/δmRNA和蛋白的表达(±s)

表2 不同浓度Ca2+对银屑病非皮损区角质形成细胞PPARβ/δmRNA和蛋白的表达(±s)
注:n=12。a:与基线相比,差异有统计学意义P<0.01
Ca2+浓度(mmol/L) mRNA表达量 t值 蛋白表达量 t值0 0.257±0.020 0.415±0.029 0.5 0.310±0.026 5.455a 0.503±0.029 7.225a 1.0 0.361±0.023 11.740a 0.644±0.034 17.460a 2.0 0.301±0.030 4.172a 0.504±0.028 7.445a 3.0 0.256±0.023 0.094 0.402±0.030 1.085
讨论
研究表明,PPAR在皮肤自稳态的维持方面起调节作用,具有促进细胞分化、调节细胞增殖、抗炎及免疫调节等作用[2]。作为PPAR在表皮中最主要的亚型,PPARβ/δ对调节KC增殖,表皮对炎症的反应具有重要作用[1]。近年来,越来越多的研究支持PPARβ/δ和银屑病发病的关系,小鼠体内实验发现PPARβ/δ活化能够触发银屑病特征性的免疫反应,引起银屑病样皮肤损害[3]。由于发现PPARβ/δ促进了细胞增殖和阻碍了银屑病皮损中T细胞的凋亡[4],因此还认为PPARβ/δ是银屑病发病机制中不正常的免疫和炎症反应之间的联系纽带[5]。我们的研究结果显示,正常表皮角质形成细胞PPARβ/δ的mRNA和蛋白的基础表达水平均较显著,而在银屑病皮损中表达水平较正常更高。
关于PPARβ/δ在银屑病中的表达水平,研究结果尚不统一。庞晓文等[6]免疫组化的研究结果显示,在银屑病皮损中PPARβ/δ表达是下降的。国外学者报道在银屑病皮损中PPARβ/δ表达明显升高[7-8]。我们通过免疫组化、mRNA和蛋白表达水平证实,进行期银屑病皮损中PPARβ/δ表达明显上调,和国外学者的研究结果较一致。我们的研究结果和庞晓文等[6]报道存在不一致,可能原因是患者选择不同。我们所选取的均为进行期银屑病患者皮损,而庞晓文等[6]的研究中进行期和稳定期患者各占一半,推测银屑病不同时期的皮损和非皮损中PPARβ/δ的表达量有不同,但本研究和庞晓文等的研究均未作分组比较且病例数较少,目前尚不能得出肯定结论。
在已发表的研究中,PPARβ/δ对表皮的增殖作用存在争议,一些研究认为,PPARβ/δ的激活促进了表皮细胞的增殖[9],而另一些研究认为其活化后会抑制表皮细胞增殖[10-11]。对于这些研究现象的争议,目前的解释认为:细胞中PPARβ/δ活化可能存在双相反应,这种反应主要依赖于炎症信号所诱发的变量情况,即在炎症刺激作用下,PPARβ/δ表现为促进细胞增殖作用,而在非炎症情况下表现为抑制细胞增殖功能。我们的免疫组化结果显示,非皮损区和正常表皮PPARβ/δ散在表达于全层角质形成细胞核,而在皮损区主要表达在基底细胞层以上,推测正常情况下PPARβ/δ对KC增殖或分化作用仅限于基底层,分布比较稳定,而在炎症刺激情况下,PPARβ/δ表达升高可能促进了表皮各层KC的增殖,并影响了其正常分化,参与了银屑病皮损的病理形成过程。
本研究应用不同浓度的GW501516和银屑病非皮损区KC共同培养,检测发现GW501516在一定浓度范围内能促进PPARβ/δ表达,10 ng/ml时达到最大效能,此后回到基线水平。提示外源性PPARβ/δ激动剂在一定浓度范围内能够促进其表达,推测内源性PPARβ/δ激动剂同样能够促进其表达。体外研究发现,Ca2+参与表皮KC的增殖[12]。我们应用不同浓度的钙离子和银屑病非皮损区KC共同培养,发现Ca2+在一定浓度范围内能促进PPARβ/δ表达,1.0 mmol/L Ca2+时效应最明显。提示外源性Ca2+能够促进其表达,但是钙离子是否直接影响了PPARβ/δ的表达,还是通过其他途径如通过内源性PPARβ/δ激动剂促进其表达,进一步的研究将会提供有价值的线索。我们的研究显示,GW501516和Ca2+均在中间浓度时能够最大效能促进 KC的PPARβ/δ表达,表达趋势类似一抛物线。分析其可能原因为受体结合区域可能在一定浓度范围内呈现出饱和性,激活的PPARβ/δ和维A酸受体形成二聚体后才能发挥作用,推测高浓度GW501516和Ca2+,可能会抑制与受体的结合,从而影响了PPARβ/δ表达水平。
[1]Man MQ,Barish GD,Schmuth M,et al.Deficiency of PPARβ/δ in the epidermis results in defective cutaneous permeability barrier homeostasis and increased inflammation[J].J Invest Dermatol,2008,128(2):370-377.
[2]Kuenzli S,Saurat JH.Peroxisome proliferator-activated receptors in cutaneous biology[J].Br J Dermatol,2003,149(2):229-236.
[3]Romanowska M,Reilly L,Palmer CN,et al.Activation of PPARbeta/ delta causes a psoriasis-like skin diseasein vivo[J].PLoS One,2010,16,5(3):e9701.
[4]al Yacoub N,Romanowska M,Krauss S,et al.PPARdelta is a type 1 IFN target gene and inhibits apoptosis in T cells[J].J Invest Dermatol,2008,128(8):1940-1949.
[5]Villarrubia VG,Vidal-Asensi S,Pérez-Bañasco V,et al.Lipid nutrition and the epidermal barrier:The connection between immune-mediated inflammatory diseases and peroxisome proliferator-activated receptors,anew therapeutictargetin psoriasis and atopic dermatitis[J].Actas Dermosifiliogr,2010,101(7):585-599.
[6]庞晓文,杨雪琴,张萍,等.过氧化物酶体增殖物激活受体在寻常性银屑病患者表皮中的表达[J].中华皮肤科杂志,2011,44 (7):519-521.
[7]Romanowska M,al Yacoub N,Seidel H,et al.PPARdelta enhances keratinocyte proliferation in psoriasis and induces heparinbinding EGF-like growth factor[J].J Invest Dermatol,2008,128 (1):110-124.
[8]El Eishi N,Hegazy R,Abou Zeid O,et al.Peroxisome proliferator receptor(PPAR)β/δ in psoriatic patients before and after two conventional therapeutic modalities:methotrexate and PUVA[J]. Eur J Dermatol,2011,21(5):691-695.
[9]Hao CM,Redha R,Morrow J,et al.Peroxisome proliferator-activated receptor delta activation promotes cell survivalfollowing hypertonic stress[J].J Biol Chem,2002,277(24):21341-21345.
[10]Burdick AD,Bility MT,Girroir EE,et al.Ligand activation of peroxisome proliferator-activated receptor-beta/delta(PPARbeta/ delta)inhibits cell growth of human N/TERT-1 keratinocytes[J]. Cell Signal,2007,19(6):1163-1171.
[11]Borland MG,Foreman JE,Girroir EE,et al.Ligand activation of peroxisome proliferator-activated receptor-beta/delta inhibits cell proliferation in human HaCaT keratinocytes[J].Mol Pharmacol,2008,74(5):1429-1442.
[12]Karvonen SL,Korkiamäki T,Ylä-Outinen H,et al.Psoriasis and altered Calcium metabolism:downregulated capacitative Calcium influx and defective calcium-mediated cell signaling in cultured psoriatic keratinocytes[J].J Invest Dermato1,2000,114(4): 693-700.
2014-01-09)
(本文编辑:吴晓初)
Expression of peroxisome proliferator-activated receptor β/δ in psoriatic epidermal keratinocytes
Hu Xiaoping,Zhang Wei,Chen Bancheng,Chen Shihong,Wang Yongqiang,Yu Bo.Department of Dermatology,Peking University Shenzhen Hospital,Guangdong 518036,China
Yu Bo,Email:yubomd@163.com
ObjectiveTo measure the expression of peroxisome proliferator-activated receptor β/δ(PPARβ/ δ)in epidermal keratinocytes from patients with psoriasis,and to investigate its regulatory factors.MethodsTissue specimens were obtained from both lesional and non-lesional skin of 20 patients with psoriasis as well as from normal skin of 15 human controls.An immunohistochemical method was used to examine the expression of PPARβ/δ in these tissue specimens.Epidermal keratinocytes were isolated from these tissue specimens and subjected to a primary culture.After several passages of subculture,non-lesional psoriatic keratinocytes were stimulated with different concentrations of GW501516(an agonist of PPARβ/δ,0-100 ng/ml)and Ca2+(0-3.0 mmol/L).Reverse transcription-PCR and Western blot were performed to measure the mRNA and protein expressions of PPARβ/δ in the primary keratinocytes and stimulated keratinocytes respectively.ResultsImmunohistochemistry showed that the expression intensity of PPARβ/δ was significantly higher in lesional psoriatic skin than in normal control skin(t= 19.28,P<0.01)and non-lesional psoriatic skin(t=23.26,P<0.01).Increased mRNA and protein levels of PPARβ/δ were observed in lesional psoriatic keratinocytes as compared to normal control keratinocytes(bothP<0.01)and non-lesional psoriatic keratinocytes(bothP<0.01).Among these stimulated non-lesional psoriatic keratinocytes,those treated with GW501516 at 10 ng/ml and those with Ca2+of 1.0 mmol/L showed the strongest expression of PPARβ/δ(bothP<0.01).ConclusionsThe expression of PPARβ/δ,which is higher in lesional psoriatic skin,can be enhanced by GW501516 and Ca2+in keratinocytes.
Psoriasis;Keratinocytes;PPARβ/δ
10.3760/cma.j.issn.0412-4030.2014.10.011
广东省自然科学基金(S2012040006694);广东省医学科研基金(B2012329);深圳市科技计划项目(201203035)
518036深圳,北京大学深圳医院皮肤科
于波,Email:yubomd@163.com
