六味地黄丸含药血清对软脂酸诱导人脐静脉内皮细胞损伤抗氧化的机制
2014-12-03赵丹玉王艳杰冯晓帆杨雪峰张瑞鹏
于 洋 赵丹玉 王艳杰 冯晓帆 杨雪峰 张瑞鹏 柳 春
(辽宁中医药大学基础医学院生化教研室,辽宁 沈阳 110032)
目前,糖尿病(DM)已成为第三大危害人类健康的全球性慢性疾病。其中胰岛素抵抗(IR)是2型糖尿病(T2DM)的发病基础〔1〕。IR即胰岛素作用的靶器官对胰岛素的敏感性下降,从而使葡萄糖的利用能力降低。研究证明,组织和细胞对胰岛素的摄取和利用能力下降与血管内皮细胞功能不全(ECD)同时存在〔2〕。细胞代谢过程会产生各种活性物质,DM脂代谢紊乱时,氧化系统的作用超过抗氧化系统的清除能力,造成氧化应激反应〔3〕。六味地黄丸(LWDHP)被誉为“补阴方药之祖”,具有抗氧化、降糖降脂之功效,临床应用其治疗DM取得良好的疗效〔4〕。本实验以软脂酸(PA)诱导人脐静脉内皮细胞(HUVEC)建立IR模型,探讨LWDHP含药血清对内皮细胞损伤抗氧化的保护作用机制。
1 材料与方法
1.1 主要试剂 LWDHP(浓缩丸),北京同仁堂(国药准字Z19993068);胰岛素,PA,噻唑蓝(MTT),Sigma公司;DMEM 培养基,胎牛血清,美国 HyClone公司;二喹啉甲酸(BCA)蛋白浓度测定试剂盒,二甲基亚砜(DMSO),北京鼎国昌盛生物技术有限责任公司;兔抗人还原型辅酶素(NADPH)氧化酶4(NOX4)一抗,鼠抗人甘油醛-3-磷酸脱氢酶(GAPDH)一抗,美国Proteintech Group公司;辣根过氧化物酶(HRP)标记的羊抗兔、羊抗鼠IgG二抗,Cell Signaling Technology公司;RT-PCR试剂盒,TaKaRa公司;二甲双胍(MET),上海生工生物工程有限公司;总超氧化物歧化酶(SOD)活性检测试剂盒,丙二醛(MDA)检测试剂盒,碧云天生物技术研究所。其他试剂均为国产分析纯。
1.2 LWDHP含药血清的制备 52只SPF级Sprague-Dawley(SD)大鼠,体质量300~350 g,雌雄各半,购自辽宁长生生物技术有限公司(许可证号:SCXK(辽)2010-0001)。标准环境下分笼喂养,早晚各喂食1次,换水1次/d,自由饮水进食,昼夜自然采光,室温16℃ ~25℃,相对湿度60%。适应性喂养3 d后,按随机数字法分为两组,正常对照组34只,LWDHP中药组18只。中药组给予LWDHP粉末水溶液(生药质量浓度为15 g·kg-1·d-1)灌胃,3 ml/次/只,2次/d,正常对照组给予等体积的生理盐水,连续灌胃5 d。第6天于末次给药1~2 h后10%水合氯醛腹腔麻醉(1.5 ml/只),腹主动脉采血,分离血清,56℃灭活30 min,过滤除菌、分装、封口、-80℃保存备用。
1.3 细胞培养及模型的建立 取对数生长期的EA.hy926 HUVEC(购自中国科学院上海生命科学研究院细胞资源中心)用含10%胎牛血清的DMEM培养基调整密度0.5×105个/ml接种于96孔培养板中,200 μl/孔,分为正常对照组、模型组、LWDHP治疗组(2.5%、5%、10%含药血清)、MET组,每组6个复孔,于37℃,5%CO2的孵育箱中培养。待细胞90%生长融合后,LWDHP治疗组换成不同浓度梯度含大鼠血清的DMEM培养基,MET组加入MET(终浓度2 mmol/L),继续培养24 h。加入PA(终浓度为400 μmol/L)孵育1 h后,再加入胰岛素(终浓度50 nmol/L)。PA作用细胞24 h后,加入MTT(5 mg/ml),20 μl/孔,4 h 后加 DMSO(150 μl/孔)震荡细胞15 min,酶标仪检测OD值(490 nm),计算细胞存活率。
1.4 总SOD活性和MDA含量检测 细胞于96孔培养板中正常培养,分为正常对照组、模型组,5%LWDHP含药血清治疗组、MET组,每组6个复孔。LWDHP含药血清,MET及PA处理细胞的方法同1.3。细胞处理后弃去培养基,按1×106个/ml细胞加入0.1 ml的RIPA裂解液(含10 μl/ml的蛋白酶抑制剂PMSF),1 600 r/min离心10 min取上清液,严格按照检测试剂盒的操作步骤检测细胞裂解液中总SOD活性和MDA含量。
1.5 RT-PCR测定细胞NOX4 mRNA表达 将细胞按5×105个/ml密度接种到25 cm2培养瓶内,每瓶加4 ml培养基,分组同1.4。各组细胞药物处理后,收集细胞提取细胞总RNA,分别测定OD260和OD280值并计算其比值以鉴定RNA纯度。随后用RT-PCR试剂盒进行逆转录及聚合酶链反应。
β-actin上游引物序列:5'-ACACGAAAGCAATGCTATCACCTC-3',下游引物序列:5'-TGACAGCAGTCGGTTGGAGCGA-3',扩增片段长度153 bp。反应条件为94℃ 2 min,94℃ 30 s,60℃30 s,72℃ 1 min,72℃ 5 min,40 个循环。NOX4 上游引物序列:5'-CAGGAGGGCTGCTGAAGTATCAA-3',下游引物序列:5'-TGACTGGCTTATTGCTCCGGATA-3',扩增片段长度303 bp。反应条件:退火68℃,30个循环。
PCR产物进行1.5%琼脂糖凝胶电泳,通过凝胶成像系统进行分析,以NOX4条带光密度值和对应的β-actin条带光密度值的比值表示NOX4 mRNA的表达量。
1.6 Western印迹测定细胞NOX4蛋白表达 细胞分组加药处理后,收集细胞提取细胞总蛋白,用BCA蛋白浓度测定试剂盒检测各样本蛋白浓度。调整各组的蛋白质上样量(40 μg),进行十二烷基硫酸钠-聚丙烯酰胺粒胶(SDS-PAGE)电泳分离,电转膜,5%脱脂奶粉封闭1 h,加入一抗(1∶500稀释),4℃过夜。HRP标记IgG二抗(1∶2 000稀释),37℃水浴震荡2 h,DAB显色,扫描条带,ImageJ2x软件进行灰度值分析,以GAPDH作为内参,NOX4和GAPDH蛋白表达强度进行灰度比值显示NOX4表达水平。
2 结果
2.1 LWDHP含药血清对PA损伤的HUVEC增殖的影响 模型组细胞的存活率是 60.62%(OD 值0.75±0.04),与正常对照组(OD 值1.24±0.05)比较有显著性差异(P<0.01)。用不同浓度的LWDHP含药血清对细胞进行干预保护,2.5%含药血清,HUVEC 的存活率只有 31.67%,OD 值 0.39±0.03;5%、10%含药血清组和 MET组细胞存活率分别为 77.46%、130.87%和 102.46%,OD 值分别为 0.96±0.03、1.62±0.02 和1.27±0.11,均明显高于模型组(P<0.01)。
2.2 LWDHP含药血清对PA损伤的HUVEC总SOD活性的影响 PA损伤的细胞裂解液中总 SOD活性下降〔(48.42±4.06)U/ml〕,与正常对照组〔(67.41±4.08)U/ml〕比较差异显著(P<0.01)。5%LWDHP 含药血清〔(63.46±2.67)U/ml〕和MET〔(64.27±3.24)U/ml〕能显著增加 PA 损伤 HUVEC 的总SOD活性,其改善作用与模型组比较差异显著(P<0.01)。
2.3 LWDHP含药血清对PA损伤的HUVEC MDA含量的影响 PA损伤的细胞裂解液中脂质氧化终产物MDA含量〔(0.748±0.048)μmol/L〕增高,与正常对照组 〔(0.346±0.031)μmol/L〕比较差异显著(P<0.01)。5%LWDHP 含药血清〔(0.576±0.016)μmol/L〕和 MET〔(0.540±0.022)μmol/L〕能显著降低MDA含量,与模型组比较差异显著(P<0.01)。
2.4 各组NOX4 mRNA的表达 与正常对照组(0.545±0.000 4)比较,PA 组细胞内 NOX4 mRNA 的表达量(0.823±0.000 9)升高(P<0.01)。与 PA 组比较,LWDHP 组(0.256±0.000 7)和 MET 组(0.545±0.000 7)细胞内 NOX4 mRNA 表达量下降(P<0.01)。见图1。
2.5 各组 NOX4蛋白的表达 与正常对照组(0.099±0.000 4)比较,PA组细胞内 NOX4蛋白的表达量(0.166±0.000 9)显著升高(P<0.01)。LWDHP 组(0.117±0.000 5)和MET组(0.139±0.000 5)与PA组比较,细胞内NOX4蛋白表达量均下降(P<0.01)。见图2。
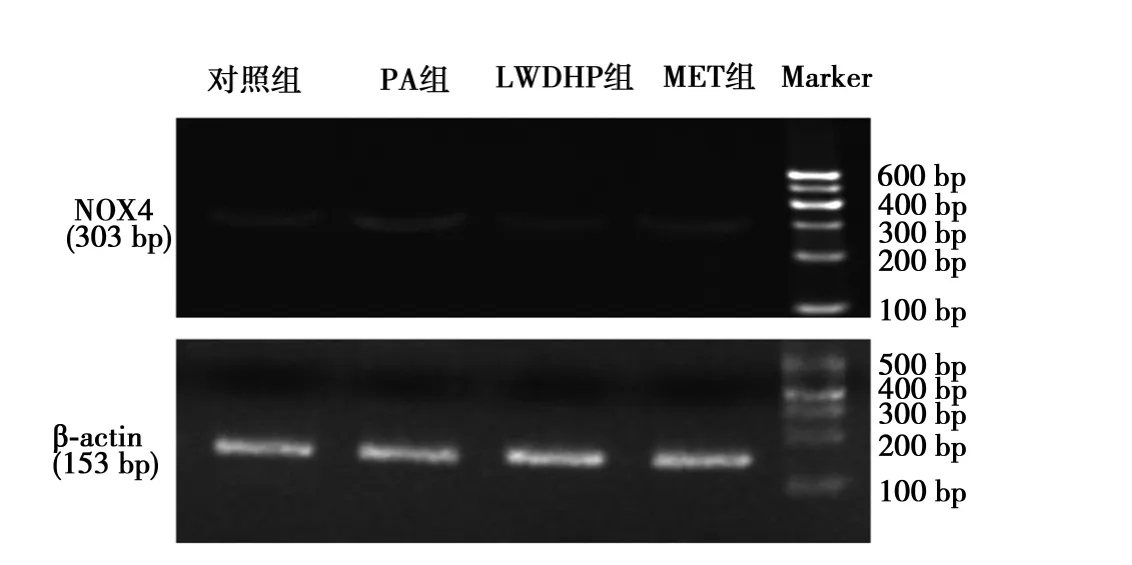
图1 各组HUVEC内NOX4 mRNA的表达比较
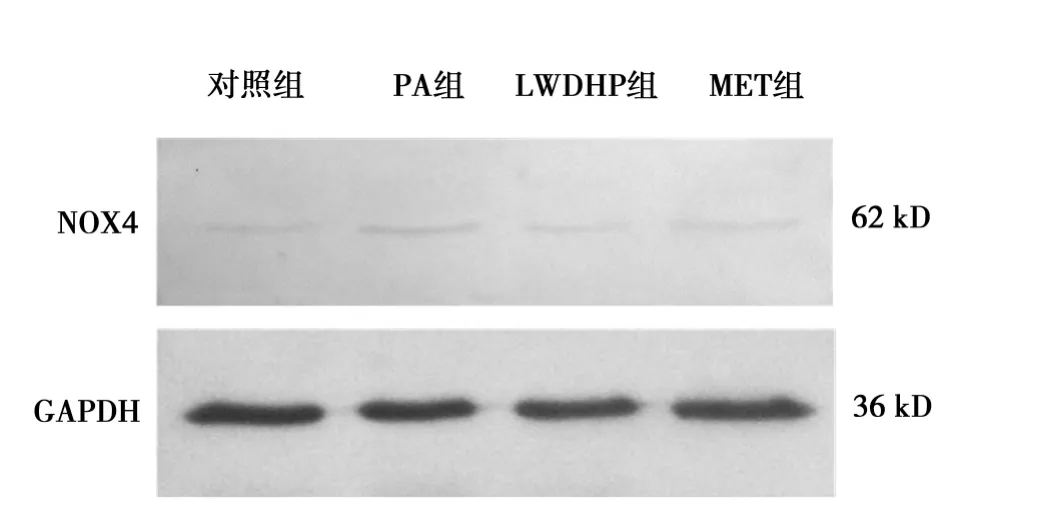
图2 各组HUVEC内NOX4蛋白表达的比较
3 讨论
DM是一种与遗传因素和多种环境因素相关的以慢性高血糖、高血脂为特征的代谢紊乱综合征,目前认为DM的病理发病基础之一是IR。IR是指胰岛素作用的靶器官如肝脏、肌肉和脂肪组织等对一定量的胰岛素作用敏感性下降,生物学反应低于正常水平,从而使葡萄糖利用减少,引起血糖水平升高。另外,IR会导致游离脂肪酸生成增多,沉积在血管内皮上,引起内皮细胞(EC)凋亡,导致 ECD〔5〕。
正常的EC不仅是血液和血管平滑肌之间的半透屏障,而且还是一个非常活跃的代谢和内分泌器官。细胞在代谢过程中会产生很多的高活性物质,其中的氧自由基作用于膜脂质发生过氧化反应,最重要的终产物之一为MDA,可通过测定MDA来了解细胞受损的程度〔6〕。体内氧自由基的产生有多种酶参与,其中NOX目前被认为是活性氧生成的关键酶,在NOX家族中,血管EC主要表达NOX4〔7〕。同时体内还存在抗氧化系统,最重要的是SOD,SOD能催化超氧化物阴离子发生歧化作用,生成过氧化氢和氧气,是生物体内一种重要的抗氧化酶。如果氧自由基和抗氧化系统的动态平衡遭到破坏,氧自由基过度生成或清除减少,SOD的抗氧化能力下降,导致MDA显著增加,细胞功能进一步受损〔8〕。本实验说明细胞受损严重,膜的完整性遭到破坏,意味着PA可能通过NOX4途径诱导HUVEC产生了氧化损伤。
近年研究表明,中医药在保护EC、预防EC损伤方面具有较为理想的调控效果,尤其是复方治疗更具有优势〔9〕。中医认为气虚阴亏是DM发生的基本病因病机,而LWDHP是滋补气阴两虚的传统名方,临床上用以治疗DM显现出明显的优势〔10〕。本实验用不同浓度的LWDHP含药血清对PA损伤的EC进行预保护,结果说明血清浓度太低,细胞生长的状态比较差。大鼠血清本身就有刺激细胞增殖的效应,会掩盖PA造模的效果,因此选定5%LWDHP含药血清作为最佳治疗浓度。
所以用5%LWDHP含药血清进行后续实验的干预后,能显著增加PA损伤HUVEC的总SOD活性,降低MDA含量,同时能下调受损细胞的NOX4 mRNA和蛋白表达,证明LWDHP能降低PA对HUVEC的氧化损伤程度,增强抗氧化酶的活性,改善受损的EC状态,提示LWDHP可能通过抑制NOX4的表达进而发挥它的抗氧化功效。
1 Mather KJ,Steinberg HO,Baron AD.Insulin resistance in the vasculature〔J〕.J Clin Invest,2013;123(3):1003-4.
2 Rubin RC.Insulin resistance.What it is and why it matters〔J〕.Diabetes Self Manag,2013;30(2):29-30,32.
3 Ren CJ,Zhang Y,Cui WZ,et al.Progress in the role of oxidative stress in the pathogenesis of type 2 diabetes〔J〕.Sheng Li Xue Bao,2013;65(6):664-73.
4 翁立元.关于六味地黄丸加减治疗糖尿病的探究〔J〕.时珍国医国药,2013;24(4):874-5.
5 Turenkov IN,Voronkov AV,Slietsans AA.Role of endothelial dysfunction in the development of vascular complications of diabetes〔J〕.Patol Fiziol Eksp Ter,2013;(2):80-4.
6 Galhardi F,Mesquita K,Monserrat J M,et al.Effect of silymarin on biochemical parameters of oxidative stress in aged and young rat brain〔J〕.Food Chem Toxicol,2009;47(10):2655-260.
7 Venkatesan B,Valente AJ,Das NA,et al.CIKS(Act1 or TRAF3IP2)mediates high glucose-induced endothelial dysfunction〔J〕.Cell Signal,2013;25(1):359-71.
8 Kim CH.Expression of extracellular superoxide dismutase protein in diabetes〔J〕.Arch Plast Surg,2013;40(5):517-21.
9 徐娟萍,张晓峰.氧化低密度脂蛋白致血管内皮损伤机制及中药复方防治的研究进展〔J〕.现代药物与临床,2011;26(3):195-8.
10 冯兴中,尹英杰,姜 敏,等.六味地黄汤治疗2型糖尿病肾阴虚证与非肾阴虚证的临床实验研究〔J〕.中华中医药杂志,2012;27(11):2995-9.
