苯妥英钠片溶出度试验方法的改进
2014-12-03李杨闻京伟蒋登高郭毅河南省食品药品检验所郑州450003郑州大学化工与能源学院郑州45000
李杨,闻京伟,蒋登高,郭毅(.河南省食品药品检验所,郑州450003;.郑州大学化工与能源学院,郑州 45000)
苯妥英钠(Phenytoin sodium)主要作为癫痫大发作的首选药物,在空气中会渐渐吸收二氧化碳分解成苯妥英;其水溶液显碱性反应,常因发生部分水解而产生浑浊[1];且笔者根据试验发现,该药在酸性溶液和在pH 9.6以下的缓冲液中均产生沉淀。该药临床使用个体差异大,治疗浓度范围窄(有效血药浓度10~20 μg/ml)[2],据医院临床血药浓度监测人员反映,不同厂家、不同批次的苯妥英钠片在同一患者体内的血药达峰浓度和时间均不一样,患者在更换药品厂家和批号时常出现不良反应。可见,该药在各厂家各批次之间有显著差异,进行溶出度的考察很有必要。
2010年版《中国药典》(二部)中以水作为溶出介质考察苯妥英钠的溶出度[1],但由前所述苯妥英钠的性质可知,其在水中不稳定;笔者经过试验发现,对照品水溶液在短时间内吸光度就有明显下降,因此,这对大批量检验十分不便;此外,水对不同厂家片剂的区分作用也比较差。在日本橙皮书中并未收载该药的溶出行为,其所常用的几种介质也均偏酸性,均可使该药产生沉淀,无法测定,即使尝试加入表面活性剂和模拟人工胃液后也同样产生沉淀。为了更好地区分药品的溶出行为,以及使其在溶出介质中性质更稳定,不在短时间内降解,笔者决定采用pH 10.0的缓冲液(硼砂-氢氧化钠)为溶出介质,对苯妥英钠片进行溶出度评价。结果表明,建立的方法区分作用强,并且使溶液更加稳定。本试验中,笔者根据医院推荐得知某知名企业S药厂生产的产品效果最佳,决定以该厂产品作为参比制剂进行以下试验。
1 材料
1.1 仪器
UV-2550紫外分光光度测定仪(日本岛津公司);FOPT-601FX光纤药物溶出仪(上海富科思生物技术发展有限公司);ZKT-18F真空脱气仪(天津市天大天发科技有限公司)。
1.2 药品与试剂
苯妥英钠对照品(中国食品药品检定研究院,批号:100210-201002,纯度:98.6%);苯妥英钠片(国内12家药厂生产产品,厂家编号为A~L,产品共247批,规格分别为:每片50、100 mg);参比制剂苯妥英钠片(S药厂,批号:043120302,规格:每片50 mg)。
2 方法与结果
2.1 对照品溶液的制备
分别取苯妥英钠对照品40 mg两份,精密称定,分别置于两个200 ml量瓶中,用水和pH 10.0缓冲液(0.05 mol/L硼砂50 ml和0.2 mol/L氢氧化钠溶液43 ml混合,稀释至200 ml)分别溶解并稀释至刻度,得两种溶出介质的对照品溶液。
2.2 测定条件
光纤溶出仪测定;测定间隔:60 s;探头规格:5 mm;检测波长:258 nm,参比波长:550 nm[3];溶出时间:60 min。
2.3 溶出条件的选择
2.3.1 方法、转速及溶出介质体积。根据2010年版《中国药典》方法[1],仍采用桨法;为了更好地体现区分作用,转速拟定为50 r/min;由于采用了5 mm的探头,为了使吸光度在0.3~0.7内,溶出介质体积采用500 ml。
2.3.2 溶出曲线考察比较。取12个厂家中具有代表性的100批样品,分别以水和pH 10.0缓冲液为溶出介质进行溶出度考察,绘制溶出曲线,并与参比制剂进行比较,见图1。
溶出曲线与参比制剂相似的产品,才有可能在体内具有与参比制剂相似的功效。因此,能够最大限度地区分各个产品之间的差异的溶出介质则为最理想溶出介质。考察相似性的方法一般采用相似因子(f2)法:

式中,Rt和Tt分别代表参比制剂和受试制剂第t时间点的平均累积释放度,n为测试点数。
以受试制剂和参比制剂各个时间点的溶出量的差值为统计量进行分析,判断标准(条件:任一溶出点平均差异限度不大于10%):f2小于50,两条溶出曲线不相似;f2界于50~100,可认为两条溶出曲线相似。
结果,除去抽验中一些生产批数少和批号重复等部分不具有统计学意义的厂家,选取了国内3家产量大的药厂L、H、F,比较情况见表1。
由表1结果可知,L厂家产品与参比制剂在两种介质中最为相似,f2分别达到了78、100;而F厂家产品在水中f2为23,在缓冲液中却全部不相似;H厂家产品在缓冲液中也较在水中的f2更低。可见,pH 10.0的缓冲液区分作用明显,多数在水中与参比制剂相似的产品,在缓冲液中体现出了差异。据此,可推测用pH 10.0的缓冲液作为溶出介质比水对苯妥英钠片溶出量的鉴别力更强。
2.3.3 溶出介质的选择。根据上述溶出曲线的考察和相似性比较的结果,决定采用pH 10.0缓冲液为溶出介质。
2.3.4 限度的确定。根据溶出度检测要求的规定,如果第1次出现相邻的2个点溶出量均达到85%以上,且二者的平均值的差值在5%以内,则第1个点即为质量标准的取样点。参比制剂在30、31 min时溶出量均达到100%,最终选择30 min作为取样点。该点的溶出量为100%,减去15%,可得溶出限度Q为85%[4]。取全国抽验的247批产品进行光纤溶出测定后,验证得该时间点和限度的要求有效、可行。
2.4 含量测定方法
2.4.1 专属性试验。取已知处方的苯妥英钠片生产厂家的辅料按照处方配制成样品再按供试品溶液制备方法制备,在本试验条件下检测,结果辅料在258 nm波长处的吸光度为0.01~0.04,供试品溶液在258 nm波长处的吸光度为0.5~0.75,可见辅料对本方法测定未见影响,方法专属性良好。

图1 不同厂家样品在两种溶出介质中的溶出曲线比较Fig 1 Comparison of dissolution curves of samples from different manufacturers in 2 dissolution mediums
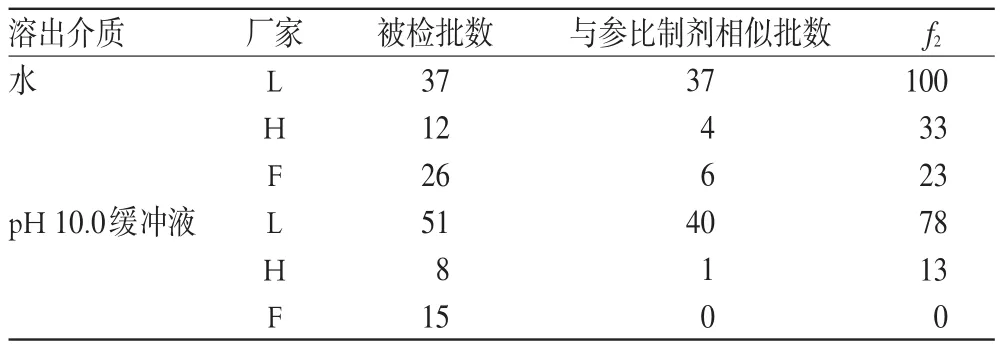
表1 各厂家产品在两种介质中的相似性考察Tab 1 Similarities assessment of samples from different manufacturers in 2 dissolution mediums
2.4.2 线性关系考察。精密称取苯妥英钠对照品约32 mg,置于50 ml量瓶中,加pH 10.0缓冲液溶解并稀释至刻度,摇匀得贮备液。精密量取贮备液置于量瓶中,加缓冲液稀释至刻度,摇匀,分别配制质量浓度为0.032、0.064、0.080、0.160、0.192、0.320 mg/ml的系列溶液,于258 nm波长处测定。以质量浓度(x)为横坐标、吸光度(y)为纵坐标进行线性回归,得回归方程为y=3.3706x-0.0045(r=0.9999),结果表明苯妥英钠检测质量浓度线性范围为0.032~0.320 mg/ml。
2.4.3 重复性试验。取“2.4.2”项下溶液(0.192 mg/ml),重复测定6次,结果吸光度的RSD=0.2%(n=6)。
2.4.4 稳定性试验。取某批样品配制成供试品溶液(溶剂为pH 10.0的缓冲液)后分别在0、1、2、4、8、24 h测定吸光度,结果吸光度的RSD=0.3%(n=6),表明苯妥英钠在pH 10.0的缓冲液中24 h内稳定性很好。
2.4.5 耐用性试验。更换紫外分光光度计,由3名不同人员测定同一供试品溶液,测得吸光度的RSD=0.3%(n=3),可见方法耐用性好。
2.4.6 回收率试验。分别精密称取苯妥英钠对照品及辅料置于200 ml量瓶中,制备质量浓度为0.10、0.15、0.20 mg/ml的溶液各3份,测定吸光度,计算得回收率,见表2。

表2 回收率试验结果(n=3)Tab 2Results of recovery tests(n=3)
2.5 在pH 10.0的缓冲液与水溶液中稳定性比较
在进行pH 10.0的缓冲液的稳定性试验时,同时配制水溶液,平行做稳定性试验,分别在0、1、2、4、8、24 h测定吸光度。结果吸光度分别为 0.674、0.667、0.660、0.651、0.648、0.621,RSD=2.9%(n=6)。可见与pH 10.0的缓冲液相比,苯妥英钠水溶液的稳定性较差,苯妥英钠分解较快。
2.6 测定结果
取抽样量较大的3家企业样品采用《中国药典》方法和本方法的测定结果见表3。
由表3结果可见,取全国12个厂家247批样品按照建立的方法测定溶出度,结果不合格率为8.1%;而按《中国药典》方法检测的结果却是样品全部合格,二者结果有显著差异。其中L厂家的合格率为100%,H厂家的合格率为94%,F厂家的合格率为91%,这与溶出曲线的相似率比较结果也是一致的。从试验中笔者还发现,这些产品在缓冲液中的溶出曲线千差万别,部分样品3 min就全部溶出了,而部分样品在整个溶出时间内都没有平台期,这可能就是为什么不同厂家不同批号的产品,虽然检查结果都是合格的,但在同一个患者身上产生的效果不一样的原因。如果用水溶液为溶出介质,这种差别就无法体现了,并且稳定性也不好。由此可以确证,现行标准的区分作用明显不够,采用pH10.0的缓冲液作为溶出介质能够显著提高区分作用。

表3 两种测定方法测得合格率比较Tab 3 Comparison of qualification rate between 2 kinds of methods
3 讨论
为了使溶液稳定不降解,并能够有效地区分产品的优劣,笔者认为现行法定标准中苯妥英钠片溶出度考察时需要改变溶出介质的pH,并建议以pH 10.0的缓冲液代替水作为溶出介质。
笔者在考察了郑州市几家大型医院苯妥英钠片的临床使用情况并进行了血药浓度监测后发现,服药后患者的血药浓度差别较大。经分析后估计,随着人年龄的增长,胃酸的分泌越来越稀,胃动力也越来越差,药物的吸收也将越来越难,由此造成血药达峰时间随着年龄增长越来越延长。考虑到中老年人的胃动力并且为了更好体现区分作用,建议苯妥英钠片溶出度考察时转速设为50 r/min,而不是《中国药典》中的100 r/min,取样时间则根据试验结果定为30 min。
在试验中发现,F厂家样品与参比制剂相比溶出曲线差别最大,且厂内批与批之间的重复性也很差,分析可能是由于所有的厂家几乎都用了淀粉作为填充剂,而F厂没有使用淀粉作为填充剂,并且制剂工艺不稳定所致。L厂家的产品与参比制剂相似性最高,但在辅料中只用到了淀粉和硬脂酸镁,比参比制剂相比少用了两种辅料。可见,淀粉和硬脂酸镁是达到苯妥英钠最佳溶出的必需辅料,其余辅料可视情况而定。而H厂家用到的辅料以及制片过程与L厂家都近似,但相似率却不高,分析可能是因为制片过程中操作不同造成的。
综上所述,本文建立的苯妥英钠片溶出度方法区分作用强、溶液稳定,不仅对药品的质量控制具有现实意义,而且对于改进制剂工艺、进一步提高药物的生物利用度也具有较好的考察作用。
[1]国家药典委员会.中华人民共和国药典:二部[S].2010年版.北京:中国医药科技出版社,2010:440.
[2]王苹,柯永勤,王念祖.苯妥英钠血药浓度测定及其临床意义[J].贵阳医学院学报,1990,15(2):159.
[3]陈英,贝琦华.光纤药物溶出原位过程监测仪评价茶苯海明片的体外溶出度[J].中国药房,2010,21(33):3144.
[4]郑淑凤,郭伟斌.氨苯蝶啶片溶出度试验方法的建立[J].药物分析杂志,2011,31(12):2338.
