rhCNTF对Aβ损伤海马神经元的作用机制研究
2014-12-03刘泽源曲恒燕军事医学科学院附属医院临床药理学研究室北京100071
张 琴,刘泽源,曲恒燕(军事医学科学院附属医院临床药理学研究室,北京 100071)
阿尔茨海默病(Alzheimer's disease,AD)是一种进行性中枢神经系统退行性疾病。目前,治疗药物仅能改善AD患者的部分症状,而不能减轻神经细胞的退化和AD疾病的发展进程,故需寻求能够营养或修复神经元、改善AD病理进展的药物。AD主要的病理特征为β淀粉样肽(β-amyloid fragment,Aβ)沉积所形成的老年斑和tau蛋白过度异常磷酸化导致的神经纤维缠结[1]。Aβ的沉积和聚集是导致AD发生的重要因素[2-3],而聚集态的 Aβ25-35是β淀粉样肽对神经元的直接毒性片段[4]。重组人睫状神经营养因子(recombinant human ciliary neurotrophic factor,rhCNTF)能够维持多种神经细胞的存活,阻止体内神经元的退行性丧失[5-6]。本实验采用聚集态Aβ25-35损伤体外培养的海马神经元以模拟体内神经元受损状态,考察rhCNTF对损伤细胞的作用及相关机制。
1 材料和方法
1.1 实验动物
新生24 h的Wistar乳鼠,SPF级,由军事医学科学院实验动物中心提供,动物合格证号:SCXK-(军)2012-0004。
1.2 药物与试剂
rhCNTF(美国Sigma公司);胎牛血清(杭州四季青生物工程材料有限公司);马血清(Gibco公司);DMEM培养基(HyClone公司);N-2(Gibco公司);B-27(Gibco公司);阿糖胞苷(美国Sigma公司);Aβ25-35(美国Sigma公司);多聚赖氨酸(美国Sigma公司);NSE免疫组化试剂盒(武汉博士德生物工程有限公司);CCK-8溶液(日本株式会社同仁化学研究所);Annexin V-FITC/PI细胞凋亡检测试剂盒(南京凯基生物科技发展有限公司)。
1.3 仪器
倒置荧光显微镜IX-51(Olympus公司);全自动酶标仪-128C(CliniBio公司);流式细胞仪(Becton Dickinson公司)。
1.4 海马神经元的分离与培养
取新生24 h的Wistar乳鼠,酒精消毒断头后,分离海马组织,将其放入盛有预先冰冷的解剖液的平皿中,用0.25%胰蛋白酶于37 ℃消化20 min,800 r·min-1离心5 min后用种植液重悬、过滤,制成细胞悬液,活细胞以106个· mL-1的密度接种在涂有多聚赖氨酸的6孔板中,置37 ℃、5% CO2孵育箱培养。24 h后镜下可见细胞贴壁生长,进行全量换成含N-2和B-27的饲养液,以后隔天半量换液。培养72 h后加阿糖胞苷以抑制非神经元细胞生长。
1.5 海马神经元的鉴定
将培养至第7天的海马神经元进行SABC法免疫组化鉴定,实验操作按照武汉博士德生物工程有限公司NSE免疫组化试剂盒的说明进行。
1.6 CCK-8法检测海马神经元的活动度
1.6.1 Aβ25-35损伤后再给予rhCNTF 将Aβ25-35于37 ℃温育72 h,使其成为有直接毒性的凝聚态,并使Aβ25-35的终浓度为10 μmol·L-1;使rhCNTF溶液的终浓度为100 ng·mL-1。培养至第7天的海马神经元以5×105个·mL-1的密度种植到96孔板用于实验。实验分组为:空白组;对照组(DMEM培养基);Aβ25-35组(10 μmol·L-1);rhCNTF组(100 ng·mL-1);Aβ25-35+ rhCNTF组(10 μmol·L-1的Aβ25-35+ 100 ng·mL-1的rhCNTF)。待细胞贴壁后,加入Aβ25-35溶液孵育24 h,加入rhCNTF溶液孵育24 h。加入CCK-8溶液孵育2 h,于450 nm波长处用全自动酶标仪测定吸光度值(A450)。计算细胞活动度,细胞活动度=A450(试验组-空白组)/A450(对照组-空白组)×100%。
1.6.2 rhCNTF预防后再给予Aβ25-35实验分组为:空白组;对照组(DMEM培养基);Aβ25-35组(10 μmol·L-1);rhCNTF 组(100 ng·mL-1);rhCNTF + Aβ25-35组(100 ng·mL-1的rhCNTF + 10 μmol·L-1的Aβ25-35)。待细胞贴壁后,加入rhCNTF孵育24 h,加入Aβ25-35溶液孵育24 h。加入CCK-8溶液孵育2 h,用全自动酶标仪测定吸光度值(A450),计算细胞活动度。
1.7 海马神经元早期凋亡的测定
采用Annexin V-FITC/PI法凯基生物试剂盒进行流式细胞术检测细胞凋亡。
1.8 统计学分析
2 结果
2.1 海马神经元的鉴定
培养7 d的海马神经元经NSE免疫组化鉴定,阳性细胞的胞浆被染成棕黄色。图1为成熟生长的海马神经元,突起生长繁多,神经细胞交错成网格。
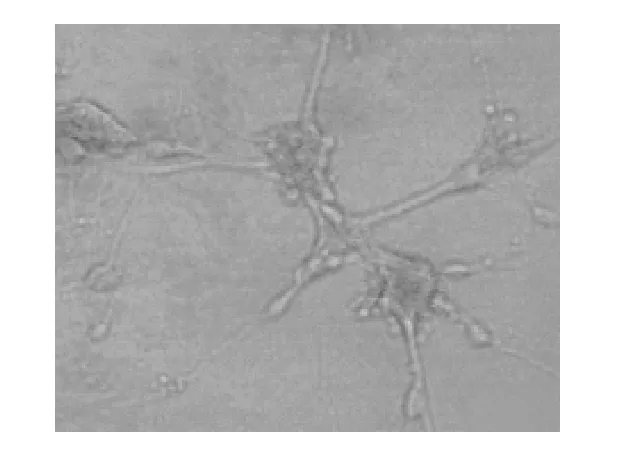
图1 海马神经元的鉴定(× 200)Fig 1 Identification of hippocampal neurons (× 200)
2.2 rhCNTF促进海马神经元生长
rhCNTF作用的海马神经元的细胞活动度与rhCNTF的浓度呈指数相关。详见图2。
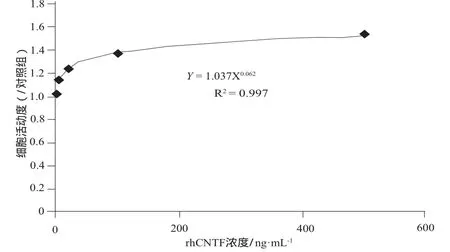
图2 rhCNTF对海马神经元的促生长作用. x ± s, n = 3Fig 2 The growth-promoting effect of rhCNTF on hippocampal neurons.x ± s, n = 3
2.3 rhCNTF对Aβ25-35损伤的海马神经元有改善作用
Aβ25-35组可见淀粉样沉淀且细胞活动度降低,而rhCNTF可改善Aβ25-35的损伤作用,不仅使神经元形态正常而且使细胞活动度明显增加(P < 0.01)。详见图3、图4。

图3 海马神经元的形态观察(×100)A – 对照组,B – Aβ25-35(10 μmol·L-1)组,C – Aβ25-35(10 μmol·L-1)+rhCNTF(100 ng·mL-1)组,D – rhCNTF (100 ng·mL-1)组Fig 3 Microscopic observation of morphology of hippocampal neurons (×100)A – control group, B – Aβ25-35 (10 μmol·L-1) group, C – Aβ25-35 (10 μmol· L-1)+ rhCNTF (100 ng·mL-1) group, D – rhCNTF (100 ng·mL-1) group
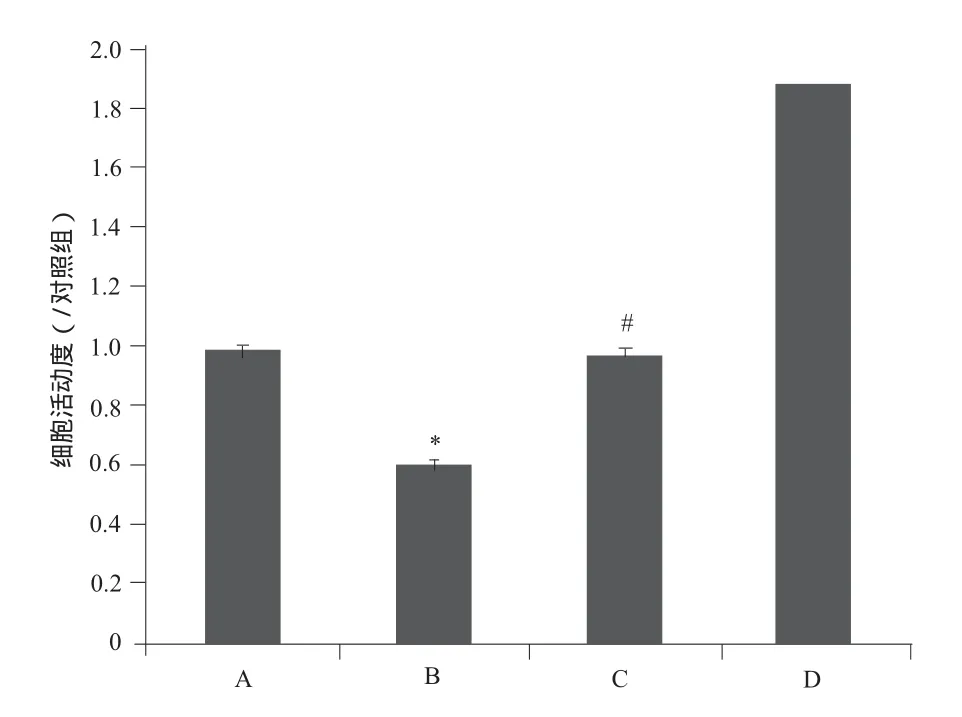
图4 海马神经元细胞活动度的变化. n = 6A – 对照组,B – Aβ25-35(10 μmol·L-1)组,C – Aβ25-35 (10 μmol·L-1) +rhCNTF (100 ng·mL-1)组,D – rhCNTF (100 ng·mL-1)组注:与A组比较,*P = 0.000 4;与B组比较,#P = 0.002 2Fig 4 Variation of cell viability of hippocampal neurons. n = 6 A – control group, B – Aβ25-35 (10 μmol·L-1) group, C – Aβ25-35 (10 μmol·L-1) + rhCNTF (100 ng·mL-1) group, D – rhCNTF (100 ng·mL-1) groupNote: compared with group A, *P = 0.000 4; compared with group B,#P = 0.002 2
2.4 rhCNTF预防海马神经元免受损伤
rhCNTF预处理海马神经元后,Aβ25-35对细胞的生长密度和树突结构无明显影响;rhCNTF + Aβ25-35组的细胞活动度较Aβ25-35组显著增加(P < 0.000 1)。见图5、6。

图5 经 rhCNTF预防下的海马神经元的形态(×40)A – 对照组,B – rhCNTF(100 ng·mL-1) + Aβ25-35(10 μmol·L-1)组,C –rhCNTF (100 ng·mL-1)组Fig 5 Morphology of hippocampal neurons treated with rhCNTF prevention (×40)A – control group, B – rhCNTF (100 ng·mL-1) + Aβ25-35 (10 μmol·L-1)group, C – rhCNTF (100 ng·mL-1) group

图6 rhCNTF预防下的海马神经元的细胞活动度. n = 3A – 对照组,B – Aβ25-35(10 μmol·L-1)组,C – rhCNTF (100 ng·mL-1) +Aβ25-35 (10 μmol·L-1)组,D – rhCNTF (100 ng·mL-1)组注:与A组比较,*P = 0.046 4;与B组比较,#P < 0.000 1Fig 6 Cell viability of hippocampal neurons treated with rhCNTF prior to Aβ25-35 by CCK-8. n = 3A – control group, B – Aβ25-35 (10 μmol·L-1) group, C – rhCNTF (100 ng·mL-1) + Aβ25-35 (10 μmol·L-1) group, D – rhCNTF (100 ng·mL-1) groupNote: compared with group A, *P = 0.046 4; compared with group B,#P < 0.000 1
2.5 rhCNTF降低海马神经元的早期凋亡
Q1象限表示为坏死细胞,Q2象限为晚期凋亡细胞和机械损伤细胞,Q3象限为早期凋亡细胞,Q4象限为正常活细胞。相对于对照组的细胞凋亡率(3.77%),Aβ25-35组的细胞凋亡率(7.33%)较高,而Aβ25-35+ rhCNTF组的细胞凋亡率(6.75%)有所降低。详见图7。
3 讨论
海马神经元是哺乳动物学习记忆和认知功能的重要神经细胞。海马神经元的萎缩或损伤会导致学习记忆、认知功能以及生活能力的减退,也是导致AD的关键神经元[7]。本实验体外培养乳鼠海马神经元,并采用免疫细胞化学方法对NSE染色,成功鉴定海马神经元,模拟体内海马神经元的生存状况以及受损状态。
在AD的发病机理中,主要病理变化为大脑皮层萎缩、Aβ沉积、神经原纤维缠结、大量记忆性神经元数目减少,以及老年斑的形成[8];而Aβ25-35是β淀粉样蛋白的主要毒性片段,其大量聚集和沉积导致老年斑的形成,这是AD形成的关键所在[9]。因此本实验采用Aβ25-35损伤海马神经元来考察rhCNTF对损伤细胞的作用。
AD患者的CNTF蛋白和mRNA水平有所降低[10]。在模拟海马神经元损伤的基础上,发现rhCNTF能够对抗A β引起的海马神经元损伤。rhCNTF对海马神经元有维持和促进生长的作用,这种作用与海马神经元的活动度呈指数相关;本实验中rhCNTF溶液的浓度已能使海马神经元的存活率达到最大。rhCNTF不仅能够改善已遭受Aβ损伤的海马神经元的生长状态和细胞活力,还能够预防对抗Aβ的损伤作用。另外,Aβ引起海马神经元的早期凋亡而rhCNTF可缓解这种凋亡效应。说明rhCNTF对抗Aβ损伤细胞的机制,是通过支持和营养神经元,提高细胞活力,以及减少细胞早期凋亡等途经发挥作用。这对前期关于rhCNTF通过降低过氧化水平而达到改善和缓解Aβ损伤作用的研究进行了补充[11]。本研究为CNTF用于预防和治疗AD疾病提供了理论依据。
