糖尿病大鼠视网膜电图改变及生长抑素水平变化的研究
2014-12-02孙亚东姜艳静赵巧丹吉林省人民医院吉林长春130021
孙亚东,马 彦,姜艳静,赵巧丹,关 红,韩 艳 (吉林省人民医院,吉林 长春 130021)
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病(diabetes mellitus,DM)的重要并发症,是导致患者视力严重下降甚至失明的主要原因。因此探索DR发病机理的研究及治疗方法已成为当务之急。本研究观察DM大鼠早期视觉电生理改变及生长抑素(somatostatin,SS)水平的动态变化并进行初步探讨。
1 资料与方法
1.1 实验材料:链脲佐菌素(streptozotocin,STZ)购自美国Sigma公司;血糖仪购自德国拜耳公司;Wistar雄性大鼠购自吉林大学实验动物中心;SS放射免疫试剂盒购自北京海科锐生物技术公司。
1.2 分组及糖尿病动物模型制备[1]:选用Wistar雄性大鼠30只,体重(200±25)g,约8周龄,检眼镜检查眼底无改变。实验过程中自由饮水、摄食,自然光照适应性喂养l周后,随机等分为正常对照组与糖尿病实验组,各15只。制模:将糖尿病大鼠禁食水12 h后腹腔注射STZ 55 mg/kg(用0.1 mol/L的柠檬酸-柠檬酸钠缓冲液稀释,pH值4.5)。给药后48 h取尾静脉血用血糖仪测血糖,将空腹血糖≥16.7 mmol/L的大鼠定为糖尿病模型。造模成功后不予降糖药物控制血糖。分别于建模前0周、建模后1周、2周、4周、6周、8周监测大鼠的体质量、进食量、饮水量、ERG及SS水平。
1.3 视网膜电图(electroretinogram,ERG)检查[2]:暗适应3 h以上的大鼠,ip速眠新注射液(又名846合剂,长春解放军农牧大学兽医研究所制)麻醉,剂量0.8 ml/kg,将麻醉状态的大鼠固定于有机玻璃实验台上,左眼滴5 g/L的托品酰胺散瞳,尾部、左侧颊部和左眼角膜表面分别安放接地电极、参考电极和记录电极,并在角膜表面滴10 g/L的甲基纤维素。参考电极和接地电极为不锈钢针制成,记录电极为0.2 mm银-氯化银制成的环形电极,采用RETI-port系统(Roland Consult,德国),进行杆细胞反应(rod-response)和最大反应(max-response)记录,杆细胞反应光强为0.011 cd·S/m2。观察ERG a波及b波潜伏期和幅值的变化。
1.4 SS水平测定:眼眶取血,置肝素抗凝管中,立即加入抑肽酶混匀,离心取上清低温保存待测。分别于建模前0周、建模后1周、2周、4周、6周、8周监测大鼠的SS水平。
1.5 统计学方法:应用RETI-port系统进行波形潜伏期和幅值的测量,采用SPSS13.0统计软件,计量资料以均数±标准差(±s)表示,进行组间及组内自身前后t检验,计数资料以率或百分比表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组血糖比较:DM模型组造模均成功,无动物被剔除。对照组大鼠血糖值波动于正常值范围内;实验组大鼠血糖值符合模型要求,与试验前比较差异有统计学意义(P<0.05),1周、2周、4周、6周、8周两组大鼠血糖对比均有统计学意义(P<0.05)。见表1。
表1 两组大鼠的血糖比较(±s,mmol/L)

表1 两组大鼠的血糖比较(±s,mmol/L)
注:与0周比较,①P<0.05;与对照组比较,②P<0.05
组别 例数 0周 1周 2周 4周 6周 8周对照组 15 3.1±0.5 3.3±0.4 3.5±0.3 4.1±0.5 3.7±0.3 3.9±0.4实验组 15 3.3±0.3 17.7±0.3①② 19.1±0.4①② 21.3±0.3①② 19.5±0.3①② 18.9±0.4①②
表2 杆细胞反应a波及b波的潜伏期和幅值(n=15,±s)

表2 杆细胞反应a波及b波的潜伏期和幅值(n=15,±s)
注:与对照组比较,①P<0.05
时间(周) latent period of a-wave(ms)对照组 实验组latent period of b-wave(ms)对照组 实验组amplitude of a-wave(μv)对照组 实验组amplitude of b-wave(μv)对照组 实验组0 39.7±5.4 39.6±5.6 62.3±5.4 62.1±5.5 17.5±3.7 17.4±3.9 30.4±5.5 30.5±5.1 1 38.3±5.9 42.5±5.7① 61.9±5.5 69.1±4.9① 17.3±3.9 17.5±3.7 30.5±5.0 31.4±5.2 2 37.7±5.4 45.1±5.4① 61.7±5.1 72.3±5.1① 16.9±4.5 17.5±4.5 31.2±4.5 30.4±5.0 4 39.5±5.1 46.7±5.1① 62.5±4.7 76.8±5.4① 17.6±3.5 17.5±4.7 30.3±5.1 29.9±5.3 6 39.3±5.5 47.9±5.0① 62.3±5.5 76.9±5.1① 17.4±3.7 14.1±4.1① 30.3±5.4 20.5±4.9①8 38.9±5.3 49.1±5.2① 62.1±4.9 79.7±4.9① 17.5±4.1 10.5±3.9① 30.7±5.2 19.1±5.0①
2.2 ERG检查:与对照组比较,建模后1周实验组大鼠杆细胞反应、最大反应的a波和b波的潜伏期即出现延长(P<0.05),但振幅于第6周时才开始出现下降(P<0.05)。见表2、3。
2.3 两组SS水平比较:1周、2周、4周、6周、8周两组大鼠生长抑素对比均有统计学意义(P<0.05)。见表4。
表3 最大反应a波及b波的潜伏期和幅值(n=15,±s)
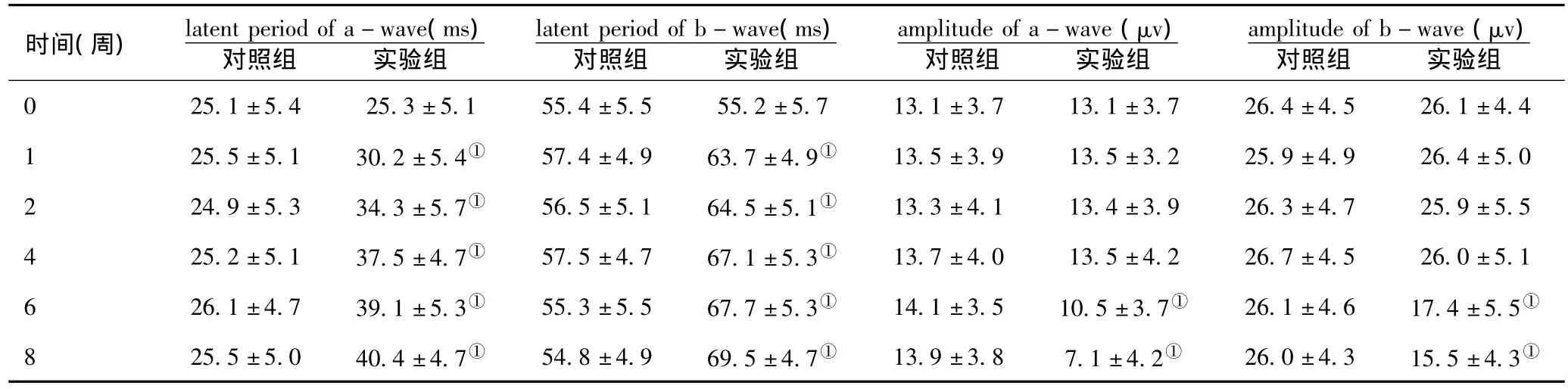
表3 最大反应a波及b波的潜伏期和幅值(n=15,±s)
注:与对照组比较,①P<0.05
时间(周) latent period of a-wave(ms)对照组 实验组latent period of b-wave(ms)对照组 实验组amplitude of a-wave(μv)对照组 实验组amplitude of b-wave(μv)对照组 实验组0 25.1±5.4 25.3±5.1 55.4±5.5 55.2±5.7 13.1±3.7 13.1±3.7 26.4±4.5 26.1±4.4 1 25.5±5.1 30.2±5.4① 57.4±4.9 63.7±4.9① 13.5±3.9 13.5±3.2 25.9±4.9 26.4±5.0 2 24.9±5.3 34.3±5.7① 56.5±5.1 64.5±5.1① 13.3±4.1 13.4±3.9 26.3±4.7 25.9±5.5 4 25.2±5.1 37.5±4.7① 57.5±4.7 67.1±5.3① 13.7±4.0 13.5±4.2 26.7±4.5 26.0±5.1 6 26.1±4.7 39.1±5.3① 55.3±5.5 67.7±5.3① 14.1±3.5 10.5±3.7① 26.1±4.6 17.4±5.5①8 25.5±5.0 40.4±4.7① 54.8±4.9 69.5±4.7① 13.9±3.8 7.1±4.2① 26.0±4.3 15.5±4.3①
表4 两组大鼠的SS水平比较(±s,pg/ml)

表4 两组大鼠的SS水平比较(±s,pg/ml)
注:与对照组比较,①P<0.05
组别 例数 0周 1周 2周 4周 6周 8周对照组 15 27.5±6.3 28.3±6.1 27.9±6.1 28.0±6.5 28.1±5.9 28.3±5.8实验组 15 27.6±6.2 17.7±5.7① 15.6±5.5① 14.9±6.1① 13.2±5.9① 11.7±5.7①
3 讨论
DM是威胁人类健康的四大疾病之一。DR的形成是多步骤、多因素的复杂生物学过程,而糖代谢紊乱是产生DR的根本原因。研究发现[3]视网膜神经元功能异常出现最早,而一些可视性的病理变化一般在建模成功后几个月方可观察到[4]。本研究观察糖尿病大鼠早期ERG改变及SS水平的动态变化,以了解其在早期DR的作用。
SS是一类能抑制生长激素释放的肽类物质,自从1968年发现机体内有SS的存在后,随着免疫放射及免疫细胞化学等检测技术的发展,人们发现除了下丘脑、中枢神经外,体内其它一些部位也能产生SS,其中在胰腺及胃肠道能分泌SS的细胞密度最大,下丘脑、中枢神经次之,周围神经系统、甲状腺、肾上腺等腺体以及眼部组织也有这种细胞的分布[5]。现已证明,SS不仅具有激素的作用,同时还具有神经递质的生物活性作用,参与机体的认知、记忆、运动和行为等诸多生理活动的调节。许多研究表明DM患者及由四氧嘧啶或STZ诱导形成的DM模型鼠胰岛D细胞有形态学改变和SS分泌异常[6-8],提示SS及其类似物与DM有密切关系。视觉电生理检查是反映视网膜各个层次细胞功能状态的检查。a波反映光感受器细胞的生物电活动,是否存在及其幅值高低由光刺激强度及光感觉器完整性决定;而b波通常被认为起源于视网膜双极细胞,是一个灵敏而可靠的诊断视网膜功能的客观指标。本实验研究发现1周、2周、4周、6周、8周两组大鼠血糖对比均有统计学意义,造模后第1wk实验组大鼠杆细胞反应、最大反应的a波和b波的潜伏期即有显著延长,SS水平下降,但振幅没有变化。至第6周时a、b波振幅开始出现减低,第8周时减低尤为明显,这为DR的早期发现提供了有利线索。
我国DM患者日渐增多,DR是DM发展的一个严重阶段,其发生与某些生长因子的水平异常有关,SS类药物已引起内分泌及眼科各临床学科的极大关注。目前对于早期DR的研究尚处于探索阶段,ERG潜伏期延长、振幅降低及SS水平下降有可能成为监测DR早期发展的指标之一,为DR早期发现早期治疗提供线索,有广泛的临床应用前景及积极的社会意义。
[1] 顾永昊,张作明,李 莉.链脲霉素诱导糖尿病大鼠的早期视觉电生理改变[J].第四军医大学学报,2002,23(11):991.
[2] 代海滨,常耀明,张作明,等.实验性糖尿病大鼠早期视网膜电图的变化[J].第四军医大学学报,2004,25(18):1710.
[3] Li Q,Zemel E,Miller B,et al.Early retinal damage in experiment at diabetes:Electroretinographical and morphological observations[J].Exp Eye Res,2002,74(5):615.
[4] 丁慰祖,姚慧萍,刘 嫣,等.大鼠糖尿病模型的建立及其视网膜功能早期改变的研究[J].临床眼科杂志,2014,22(1):80.
[5] Patel PC.General aspects of bioiogy and function of somatostation.Somatostation[M].BERLIN:Springer Sandoz,1992:1.
[6] 熊 静,莫朝晖,谢艳红,等.初诊2型糖尿病患者肠促胰岛素和胰高血糖素水平的变化[J].中国全科医学,2010,13(35):3951.
[7] 邹 钢,邵 豪,陆泽元,等.糖尿病患者血糖与胃泌素、胃动素、生长抑素相互关系的初步探讨[J].海南医学,2005,16(10):1.
[8] Grant MB,Mames RN,Fitzgerald C,et al.The efficacy of octreotide in the therapy of severe nonproliferation and early proliferation diabetic retinopathy[J].Diabetes Care,2000,23(4):504.
