Wingspan支架置入术治疗症状性大脑中动脉狭窄临床观察
2014-12-02张文学佟小光
张文学,佟小光
(1天津医科大学研究生院,天津300070;2天津市环湖医院)
大脑中动脉狭窄患者每年卒中发生率约8%[1],在亚洲人群中这一比例更高[2]。据文献报道,脑动脉狭窄治疗上最好是直接置入支架[3]。我们通过回顾性分析天津市环湖医院收治的46例经皮Gateway球囊成形及大脑中动脉Wingspan支架置入术的患者资料,观察Wingspan支架置入治疗症状性大脑中动脉狭窄的近期疗效。
1 资料与方法
1.1 临床资料 2009年1月~2013年5月共收治症状性大脑中动脉狭窄并行Wingspan支架置入者46例,其中男34例、女12例,年龄32~74(52.5±9.7)岁。其中右侧大脑中动脉狭窄者 19例(41.3%),左侧 27 例(58.7%)。临床症状以频繁的短暂性脑缺血发作为主,即头晕、言语不清、肢体麻木无力等。本组病例均为择期手术,无急诊溶栓行支架置入术者。50岁以下患者均行血管免疫检查排除免疫性动脉炎、肌纤维发育不良等。
1.2 影像学检查及评价 所有患者术前均行头CT或MRI检查,44例(95.7%)提示有与大脑中动脉狭窄明显相关的梗塞灶,20例行头颅CT灌注或MR灌注检查,均提示病变侧低血流灌注。46例患者术前均有颅内CTA、MRA或者DSA证实存在大脑中动脉狭窄,且无明显的颅内血流代偿。大脑中动脉M1段按形态(图1)分,其中平直型26例、弓型15例、S型5例;按Mori分型分,其中A型者10例,B型者32例,C型者4例;按狭窄程度分,其中中度狭窄(50%~69%)2例,重度狭窄(70%~89%)29例,极重度狭窄(≥90%)15例。
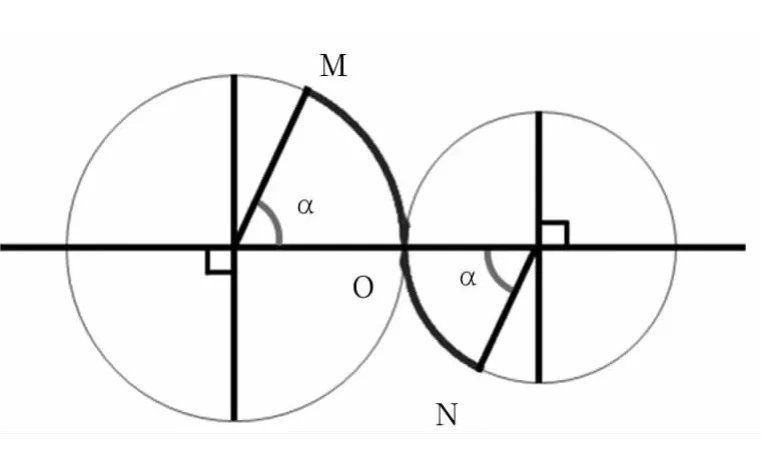
图1 M1段各形态图例简释
1.3 Wingspan支架置入术手术方法 全麻下采用6F导引导管置于颈内动脉颈段远端,造影选择最佳投照角度,测量狭窄部位的长度及狭窄率。使用标准的微导管微导丝技术,在路径图指导下以微导管配合将微导丝通过狭窄段置于能够提供球囊及支架足够支撑力的合适部位,撤出微导管。沿微导丝送入Gateway球囊至狭窄段,逐渐加压扩张满意后撤出球囊,再借助微导丝送入Wingspan支架,逐渐释放支架满意后,撤出支架释放系统,留置微导丝观察10 min。造影复查后,撤除微导丝和导引导管,缝合股动脉穿刺处。
1.4 统计学方法 采用SPSS17.0统计软件。计量资料以±s表示,采用Fisher确切概率法检验;计数资料比较用χ2检验。P≤0.05为差异有统计学意义。
2 结果
本组46例手术均获成功,平均管腔狭窄率从术前84.7% ±6.9%降至术后 21.2% ±14.4%,(P <0.05)。本组46例患者中,除2例患者术后颅内出血和1例基底节区梗死外,其他患者临床症状均有不同程度缓解。本组病例术中出现并发症者共3例(6.5%):1例支架置入成功后即刻造影见大脑中动脉支架置入处血管闭塞;1例患者术中支架置入后,造影见造影剂滞留,大脑中动脉显影延迟,为术侧颈内动脉痉挛;1例患者M1段球囊扩张后发生痉挛。术后出现并发症者共9例(19.6%):1例患者当天脑缺血发作,经MRI证实支架侧再发基底节梗死,考虑为穿支动脉闭塞所致;2例患者当天出现意识障碍,经头CT证实为蛛网膜下腔出血合并颅内血肿;术后第1天有2例患者发生头晕、恶心、呕吐等过灌注表现;术后第2天有2例患者短暂性脑缺血发作;术后第3天上消化道出血者1例,考虑过灌注所致;1例患者术后第4天出现头痛,经头CT证实为支架侧额叶梗死灶内渗血。本组病例中没有微导丝穿破血管致颅内出血、急性血栓形成、造影剂外渗及其他相关的血管内介入并发症者。
大脑中动脉M1段平直型、弓型、S型发生并发症分别为7、2、3例;Mori分型中A型、B型、C型发生并发症分别为1、9、2例;狭窄程度中中度狭窄、重度狭窄、极重度狭窄发生并发症分别为1、4、7例。通过Fisher确切概率法计算各分类方法中各型的并发症发生例数比较有明显差异(P<0.05)。通过计算分析M1段形态为S型、Mori C型及极重度狭窄患者并发症率高,近期疗效差。M1段S型患者术中1例发生支架处闭塞,1例发生 M1扩张后痉挛;Mori C型患者术后1例发生支架侧基底节梗死,1例发生支架侧基底节及颞叶出血,二者均为严重并发症。极重度狭窄者发生脑出血及过度脑血流灌注者中1例为重度狭窄,4例为极重度狭窄。见表1。
表1 不同M1形态、Mori分型、狭窄程度分级患者手术前后管腔狭窄率比较(±s)
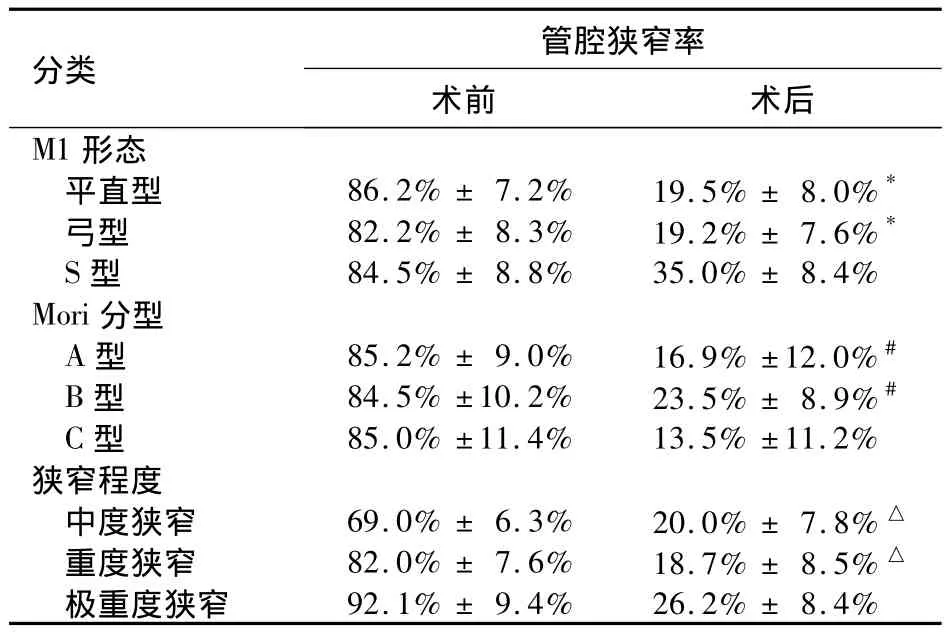
表1 不同M1形态、Mori分型、狭窄程度分级患者手术前后管腔狭窄率比较(±s)
注:与S型比较,*P <0.05;与C 型比较,#P <0.01;与极重度狭窄比较,△P <0.05
分类 管腔狭窄率术前 术后M1 92.1% ± 9.4% 26.2% ± 8.4%形态平直型 86.2% ± 7.2% 19.5% ± 8.0%*弓型 82.2% ± 8.3% 19.2% ± 7.6%*S 型 84.5% ± 8.8% 35.0% ± 8.4%Mori分型A 型 85.2% ± 9.0% 16.9% ±12.0%#B 型 84.5% ±10.2% 23.5% ± 8.9%#C 型 85.0% ±11.4% 13.5% ±11.2%狭窄程度中度狭窄 69.0% ± 6.3% 20.0% ± 7.8% △重度狭窄 82.0% ± 7.6% 18.7% ± 8.5% △极重度狭窄
3 讨论
颅内动脉粥样硬化是缺血性卒中的一个重要原因。颅内动脉粥样硬化引起脑缺血的病理生理机制的复杂性,可以解释尽管给予“有效的”抗栓药物治疗,但仍然不能达到完全预防卒中的效果[4]。大脑中动脉狭窄的手术治疗包括颅外—颅内搭桥术、脑动脉狭窄支架置入术[3]。国外 Henkes等[5]及 Bose等[6]先后发表了用Wingspan支架联合 Gateway球囊治疗症状性颅内动脉狭窄的报道,手术成功率近似100%。国内姜卫剑等[7]报道了使用球囊扩张支架治疗颅内动脉狭窄取得良好的效果,血管内支架已被成功的应用于颅内外动脉狭窄的治疗中,被认为可以提高血管的长期通畅性以及可以防止动脉夹层导致急性闭塞的危险。
本组病例术后狭窄率的改变,与娄萍等[8]报道的国人Wingspan支架置入术治疗颅内动脉狭窄的手术结果相似。而国外Fiorella等[9]报道78例患者82处颅内动脉狭窄,术前平均狭窄程度为74.6% ±13.9%、术后为27.2% ±16.7%;Bose 等[6]报道病例术前狭窄为74.9% ±9.8%,术后为 31.9% ±13.6%,我们与之不甚一致。从数据对比中不难发现,国外对此类颅内动脉狭窄的支架治疗更为积极,而对血管扩张的程度相对保守。在本组病例中术前M1各形态的平均狭窄率虽差别不大,但术后S型者平均残余狭窄率最高,且发生并发症者3例,这与传统观念“适当扩张原则”并不矛盾,这提示对于此类大脑中动脉狭窄的支架置入术,M1段的形态较狭窄的改善率对手术并发症影响更大,更需要引起临床医生的高度注意。所以当M1段形态呈S型者,术者在行支架扩张手术时应该以患者的手术预后为目的,而不可以偏执地追求完美的影像效果而引起严重的并发症。按Mori分型分类可发现三者术前平均狭窄率差异并不大,但术后残余狭窄率以Mori C型者最低,但术后2例发生严重并发症,这说明Mori C型的狭窄在行此类支架置入术时,在相同技术及置入同规格的支架,其狭窄改善最明显,这提示在Mori C型者形成狭窄的斑块可能为质地较软的斑块,这种斑块是最不稳定的斑块,在支架释放后,斑块碎裂最容易形成穿支动脉闭塞、斑块闭塞远端血管及由于血流突然增大造成的过灌注甚至脑出血。在M1段的显微解剖研究方面,Rhoton等发现豆纹动脉主要起自分叉前M1段,平均为3支形成多达30支树枝状分支血管进入前穿质,这也可能解释了术后当天1例患者发生短暂性脑缺血发作且呈进展趋势,MRI证实为支架侧基底节区新发急性梗塞灶。这与过度扩张造成豆纹动脉狭窄或闭塞,进而梗塞的情况不谋而合。所以对于Mori C型的狭窄在行支架置入术时,可选用直径偏小的Wingspan支架,既达到扩张血管的目的也可降低穿支动脉闭塞以及过灌注脑出血的风险,这也提示目前兴起的高分辨率核磁对于血管内斑块形状检查的必要性。此外,发生脑出血及过灌注表现者以M1段极重度狭窄的患者居多,这重新提醒了介入医师对于血管狭窄支架置入术时应适度扩张。由此可见,对M1段S型、Mori C型的极重度狭窄者需谨慎手术,术前一定要仔细评价狭窄部位的解剖学特点,以便评价大脑中动脉支架置入的危险系数,从而提高手术疗效和安全性。
然而,支架内再狭窄也是神经介入治疗时令人困惑的问题之一。国内相关文献报道的国人支架后再狭窄的独立危险因素为吸烟、2个部位以上狭窄以及术后是否规范用药[10]。此外在控制这些因素的基础上,药物涂层支架在动物实验也取得了初步成效[11],有望在不久的将来可用于颅内动脉狭窄的临床治疗。另外术后颅内出血、穿支动脉闭塞等严重致残致死并发症,也严重限制了其发展。根据其解剖学的特点,曾一度被否定颅内外血管搭桥术,以其安全性再次受到广大神经科医师的青睐。目前,我们认为颅内血管支架和颅内外血管搭桥,两者应该是相互补充的,医师应根据具体情况采用最为有效的治疗手段,从而给患者带来更多的选择。
总之,Wingspan支架置入术治疗症状性大脑中动脉狭窄有较好的安全性和短期临床疗效。大脑中动脉M1段不同形态、Mori分型及狭窄程度在一定程度上影响手术并发症发生的频次,以M1段呈S型、Mori C型及极重度狭窄患者手术并发症的频率较高,对此类患者须术前严格筛查,支架术后的长期疗效还需要大病例样本及长时间的病例随访研究,对于术后再狭窄及支架手术风险系数高的患者是否更适合颅内外的搭桥手术尚待进一步研究。
[1]Bogousslav sky J,Barnett H J M,Fox A J,et al.A therosclerotic disease of the middle cerebra l artery[J].Stroke,1986,(17):12-22.
[2]Higashida RT,Meyers PM,Connors JJ 3rd,et al.Intracranial angioplasty&stenting for cerebral atherosclerosis:a position statement of the American Society of Interventional and Therapeutic Neuroradiology,Society of Interventional Radiology,and the American Society of Neuroradiology [J].AJNR Am J Neuroradiol,2005,26(9):2323-2327.
[3]Marks MP,Marcellus ML,Do HM,et al.Intracranial angioplasty without stenting for symptomatic atherosclerotic stenosis:long-term follow-up [J].AJNR Am J Neuroradiol,2005,26(3):525-530.
[4]Chimowitz MI,Lynn MJ,Howlett-Smith H,et al.Comparison of warfarin and aspirin for symptomatic intracranial arterial stenosis[J].N Engl J Med,2005,352(13):1305-1316.
[5]Henkes H,Miloslavski E,Lowens S,et al.Treatment of intracranial atherosclerotic stenoses with balloon dilatation and self-expanding stent deployment(WingSpan)[J].Neuroradiology,2005,47(3):222-228.
[6] Bose A,Hartmann M,Henkes H,et al.A novel,self-expanding,nitinol stent in medically refractory intracranial atherosclerotic stenoses:the Wingspan study[J].Stroke,2007,38(5):1531-1537.
[7]Jiang WJ,Wang YJ,Du B,et al.Stenting of symptomatic M1 stenosis of middle cerebral artery:an initial experience of 40 patients[J].Stroke,2004,35(6):1375-1380.
[8]娄萍,录海斌,李强.镍钛合金材料自膨胀式Wingspan支架置入症状性颅内动脉狭窄血管13例1年随访[J].中国组织工程研究与临床康复,2011,15(38):7213-7216.
[9]Fiorella D,Levy EI,Turk AS,et al.US multicenter experience with the wingspan stent system for the treatment of intracranial atheromatous disease:periprocedural results[J].Stroke,2007,38(3):881-887.
[10]贺雄军,缪中荣,凌锋,等.症状性大脑中动脉狭窄患者支架置入术后再狭窄影响因素的分析[J].中国脑血管病杂志,2008,15(11):10-15.
[11]Steinfort B,Ng PP,Faulder K,et al.Midterm outcomes of paclitaxel-eluting stents for the treatment of intracranial posterior circulation stenoses[J].J Neurosurg,2007,106(2):222-225.
