瘦素对快速动眼睡眠剥夺大鼠焦虑行为的影响及其机制探讨
2014-12-02马文彬韩笑峰李希芝葛汝丽
马文彬,韩笑峰,郑 麒,陈 芳,李希芝,葛汝丽
(滨州医学院附属医院,山东 滨州 256603)
研究发现,快速动眼(REM)睡眠剥夺与大鼠焦虑行为的变化呈时间相关性[1]。短期REM睡眠剥夺对大鼠焦虑行为无明显影响,长期REM睡眠剥夺可导致大鼠焦虑行为显著减少,而瘦素可消除长期REM睡眠剥夺导致的大鼠焦虑行为减少。因此,瘦素可能参与REM睡眠剥夺的抗焦虑作用。2012年1月~2013年12月,我们观察了瘦素对REM睡眠剥夺大鼠焦虑行为的影响,并探讨其机制。
1 材料与方法
1.1 动物 健康雄性封闭群Wistar大鼠90只,SPF级,体质量(160 ±10)g。
1.2 方法
1.2.1 动物分组及处理方法 采用随机数字分布表法将大鼠分为3组,每组30只,分别为L-SD组、NS-SD组、NS组,根据处理时间不同每组再分为3个亚组各10只。NS-SD组、L-SD组置入REM睡眠剥夺小平台中,使其始终不能进入REM睡眠期[2],分别于睡眠剥夺24、72、120 h腹腔注射生理盐水2 mL/d、瘦素200 μg/d(2 mL/d);NS 组分别于正常群居24、72、120 h腹腔注射生理盐水2 mL/d。
1.2.2 焦虑行为观察方法 参照 Pellow等[3~5]的方法制备高架十字迷宫,正中悬挂红外摄像头与挡板外电脑连接。实验时操作者位于挡板外,通过电脑屏幕观察大鼠行为。焦虑行为指标包括:①开放臂次数(OE):进入到任一开放臂的次数,以大鼠4个爪子均进入到臂内为准。②开放臂时间(OT)。③封闭臂次数(CE):进入到任一封闭臂的次数,以大鼠4个爪子均进入到臂内为准。④封闭臂时间(CT)。⑤开放臂和封闭臂的总次数(OE+CE):表示大鼠的运动活力。⑥开放臂次数比例(OE%):即OE/(OE+CE)×100%。表示大鼠的焦虑程度,焦虑程度越严重该数值越小。⑦开放臂停留时间比例(OT%):即OT/(OT+CT)×100%,表示大鼠的焦虑程度,焦虑程度越严重该数值越小。
1.2.3 下丘脑组织神经肽Y(NPY)mRNA检测方法 行为学测试后大鼠乙醚麻醉,心脏灌注50 mL冰生理盐水2次,按大鼠脑立体定位图谱[10]将下丘脑取出后立刻放在冻存管中,放入液氮保存,再移至-80℃冰箱保存备用。采用RT-PCR方法检测下丘脑组织NPY mRNA,步骤参照试剂盒说明书。取1 μL RNA进行凝胶电泳,另取1 μL RNA稀释10倍用Pharmacia Biotech GeneQuant DNA/RNA分光光度计测量OD260值。
1.2.4 统计学方法 采用SPSS13.0统计软件。计量资料以±s表示。多组间比较采用多重比较秩和检验,两组间比较采用两样本比较秩和检验,各组组内比较采用单因素方差分析。P≤0.05为差异有统计学意义。
2 结果
2.1 焦虑行为比较 见表1。
表1 各组大鼠焦虑行为比较(±s,n=10)

表1 各组大鼠焦虑行为比较(±s,n=10)
注:与 NS组24 h比较,*P <0.01;与 NS组120 h比较,△P <0.01;与 NS-SD 组120 h比较,▲P<0.01;与 L-SD组120 h比较,#P <0.01
组别 OE(次) OT(s) CE(次) CT(s) OE+CE(次)OE% OT%NS 组24 h 2.40 ±0.84 33.30 ± 5.66 8.40 ±2.07 234.50 ±19.48 10.50 ±2.22 22.20 ±5.59 12.40 ±2.17 72 h 2.50 ±0.85 31.60 ± 5.30 8.60 ±2.01 233.70 ±16.45 11.10 ±2.42 22.50 ±6.36 12.00 ±2.00 120 h 2.50 ±1.08 32.60 ± 5.84 8.40 ±2.27 232.80 ±15.63 10.90 ±3.11 22.20 ±6.37* 13.30 ±2.79*NS-SD组24 h 4.50 ±1.90 42.10 ±19.96 11.60 ±2.50 201.50 ±36.73 15.80 ±3.94* 27.70 ±9.37▲ 17.70 ±8.86▲72 h 3.30 ±1.89 28.40 ±16.21 9.80 ±2.53 233.20 ±35.00 12.80 ±3.99 24.20 ±9.07▲ 11.00 ±6.57▲120 h 7.20 ±2.25 87.30 ±20.86 11.00 ±1.94 159.80 ±21.07 18.20 ±3.85△ 38.90 ±5.86△ 35.10 ±7.05△L-SD组24 h 4.30 ±2.21 51.30 ±27.79 11.20 ±3.52 195.70 ±37.26 15.40 ±5.36* 26.70 ±9.65# 20.40 ±10.97#72 h 3.40 ±1.84 30.50 ±15.15 9.80 ±2.82 231.70 ±33.37 12.90 ±4.18 25.10 ±9.29# 11.90 ±6.01#120 h 1.60 ±0.52 26.40 ±14.76 9.80 ±2.53 241.00 ±25.76 11.60 ±2.80△ 14.30 ±4.86△▲ 8.40 ±4.03△▲
2.2 下丘脑组织NPY mRNA NS-SD组、L-SD组各时间点下丘脑组织NPY mRNA表达量均高于相同时间点 NS组(P<0.05 或 <0.01)。24、72、120 h时NS-SD组下丘脑组织NPY mRNA表达量逐渐增加(P均<0.05);L-SD组表达量逐渐下降(P均<0.05)。见表2。
3 讨论
睡眠剥夺可以显著影响脑功能,并对神经系统产生长远而复杂的影响。无论在人体或动物,研究均显示睡眠时间减少或睡眠剥夺可导致睡眠体内血清瘦素水平及节律幅度下降[6]。瘦素缺乏会影响睡眠深度,增加睡眠觉醒次数和转换次数,减少动物的总睡眠时间。因此,睡眠时间与瘦素水平有着极为密切的关系。睡眠剥夺还可导致大脑下丘脑食欲素及 NPY浓度增加,海马区 NPY水平上调[7]。NPY是一个促进食欲的因子,具有明显的抗焦虑作用。目前的研究认为,主要由脂肪细胞分泌的瘦素是NPY最强的体内抑制剂[8]。脑室内注射NPY可表现出明显的抗焦虑作用,并且这种作用具有剂量效应关系[9]。脑内NPY系统被认为是治疗焦虑症、抑郁症及酒精依赖的候选靶标[10]。NPY的抗焦虑作用主要通过Y1、Y5受体介导。通过对Y1、Y5受体的拮抗可以导致动物出现焦虑行为[11]。研究[12]表明,NPY改善动物的焦虑行为主要是在海马及下丘脑发挥作用,而Y1和Y5受体激动剂均具有抗焦虑作用。
表2 各组大鼠下丘脑组织NPY mRNA结果比较( ± s,n=10)
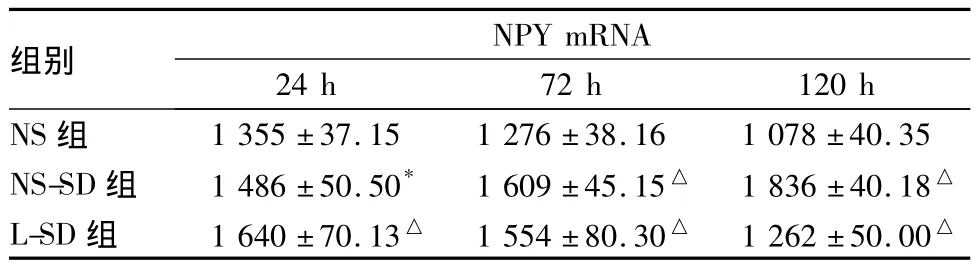
表2 各组大鼠下丘脑组织NPY mRNA结果比较( ± s,n=10)
注:与相同时间点 NS组比较,*P <0.05,△P <0.01;24、72、120 h时NS-SD组表达量逐渐增加(P均<0.05),L-SD组表达量逐渐下降(P 均 <0.05)
组别NPY mRNA 24 h 72 h 120 h NS组1 355 ±37.15 1 276 ±38.16 1 078 ±40.35 NS-SD组 1 486±50.50* 1 609±45.15△ 1 836±40.18△L-SD组 1 640±70.13△ 1 554±80.30△ 1 262±50.00△
睡眠持续时间对瘦素的影响可能同时反映与瘦素相互作用的激素也受睡眠的调节。反之,瘦素的睡眠依赖性改变可能导致瘦素敏感的激素轴发生改变。有文献报道,地震后出现创伤后应激障碍的患者较健康成人血清瘦素水平明显增高,推测血清瘦素水平升高与患者的高警觉性有关[13]。研究证实,不合并抑郁症的单纯强迫症患者血清瘦素水平升高[4],而高瘦素血症被认为是产生焦虑的原因之一[14],并被认为是抗焦虑治疗的新的潜在靶点。
本研究结果表明,瘦素睡眠剥夺组大鼠下丘脑NPY mRNA表达呈下降趋势,表明下丘脑瘦素水平的增高对下丘脑NPY表达有抑制作用。REM睡眠剥夺组大鼠下丘脑NPY mRNA表达呈递增趋势,表明睡眠剥夺可导致大鼠下丘脑NPY mRNA表达增高,且具有时间依赖性。睡眠剥夺的第72小时焦虑行为并未出现明显变化;睡眠剥夺第120小时焦虑行为出现显著改善,而瘦素可消除上述作用。表明下丘脑瘦素浓度的减少和NPY浓度的增加是一个逐渐变化的过程。因此,瘦素和NPY介导的通路很可能是睡眠剥夺导致抗焦虑作用的机制之一。但是,本研究采用单平台睡眠剥夺模型,与改良多平台模型相比,大鼠的社会隔离和制动可能会对实验结果造成一定影响。另外,本研究对下丘脑NPY的检测仅限于基因水平,并未对实验结果进行蛋白水平的检测。下一步研究将在蛋白水平进行NPY检测,并将对NPY的Y1、Y5受体进行分子生物学检测,以完善实验结果,增加其准确性。
[1]潘集阳,田径,马文彬,等.REM睡眠剥夺对大鼠焦虑行为的影响及瘦素的作用[J].实用医学杂志,2010,26(13):2292-2295.
[2]黄建欧,赵忠新.大鼠睡眠剥夺方法的研究进展[J].中华神经医学杂志,2004,3(3):229-231.
[3]Pellow S,Chopin P,File SE,et al.Validation of open:closedarm entries in an elevated plus maze as a measure of anxiety in the rat[J].J Neurosci Methods,1985,14(3):149-167.
[4]Arcelo C,Bulletin BR.Evaluation of the elevated T-maze as an animal model of anxiety in the mouse[J].Brain Res Bull,1999,48(4):407-411.
[5] Carobrez AP,Bertoglio LJ.Ethological and temporal analyses of anxiety-like behavior:the elevated plus-maze model 20 years[J].Neurosci Biobehav Rev,2005,29(8):1193-1205.
[6]Laposky AD,Shelton J,Bass J,et al.Altered sleep regulation in leptin-deficient mice[J].Am J Physiol Regul Integr Comp Physiol,2006,290(4):R894-903.
[7]Richy S,Burlet A,Max J,et al.Effect of chronic intraperitoneal injections of leptin on hypothalamic neurotensin content and food intake[J].Brain Res,2000,862(1-2):276-279.
[8]Atmaca M,Tezcan E,Kuloglu M,et al.Serum leptin levels in obsessive-compulsive disorder[J].Psychiatry Clin Neurosci,2005,59(2):189-193.
[9]Heilig M,Sderpalm B,Engel JA,et al.Centrally administered neuropeptide Y(NPY)produces anxiolytic-like effects in animal anxiety models[J].Psychopharmacology,1989,98(4):524-529.
[10]刘耀文.脑神经肽Y系统:治疗焦虑症、抑郁症及酒精依赖的候选靶标[J].国外医学:药学分册,2004,31(6):348-351.
[11]Velísek L.Prenatal exposure to beta-methasone decreases anxiety in developing rats:hippocampal neuropeptide Y as a target molecule[J].Neuropsychopharmacology,2006,31(10):2140-2149.
[12]Primeaux SD,Wilson SP,Cusick MC,et al.Effects of altered amygdala neuropeptide Y expression on anxiety-related behaviors[J].Neuropsychopharmacology,2005,30(9):1589-1597.
[13]Liao SC,Lee MB,Lee YJ,et al.Hyperleptinemia in subjects with persistent partial posttraumatic stress disorder after a major earthquake[J].Psychosom Med,2004,66(1):23-28.
[14]Liao SC,Lee MB,Lee YJ,et al.The counterbalance between leptin and cortisol may be associated with comorbid depression and anxiety[J].Psychiatry Clin Neurosci,2006,60(1):120.
