当归芍药散对代谢性炎性反应小鼠血脂和血清炎性反应因子IL-6、MCP-1 及 NF-κB、PPARγmRNA 表达的影响
2014-12-02贾丽超周明学刘卫红
贾丽超 周明学 张 蕾 刘卫红
(首都医科大学附属北京中医医院 北京市中医研究所,北京100010)
代谢性炎性反应(metaflammation)是一种低度慢性的系统性炎性反应[1]。新近研究[2]发现,肥胖、糖尿病、脂肪肝、动脉粥样硬化(atherosclerosis,AS)等代谢相关疾病都存在慢性低水平炎性反应。其中,AS与代谢性炎性反应关系更为密切。研究[1-3]已证实,AS是一种多细胞及炎性细胞因子参与的慢性炎性疾病。有研究者[2]认为,AS的早期主要病机以痰淤互结为主,治疗通常以活血化痰为主要治法。当归芍药散是活血化痰的代表方剂,由当归、芍药、茯苓、白术、泽泻、川芎6味中药组成,研究[3-6]表明当归芍药散具有明显的调血脂和改善临床证候的作用。为此,本研究采用高脂饮食联合脂多糖注射造成小鼠代谢性炎性反应模型,研究当归芍药散对早期As代谢性炎性反应小鼠的血脂和炎性反应的影响。
1 实验材料和方法
1.1 实验动物
健康雄性C57小鼠,60只,体质量18~20 g,8周龄,由北京维通利华实验动物技术有限公司提供,实验动物合格证号:SCXK(京)2012-0001。
1.2 试剂
脂多糖,购于美国Sigma公司。胆固醇(total cholesterol,TC)试剂盒(批号 100301)、三酰甘油(triglyceride,TG)试剂盒(批号100301)、高密度脂蛋白胆固醇(high density lipoprotein,HDL-C)试剂盒(批号091201),低密度脂蛋白胆固醇(low density lipoprotein,LDL-C)试剂盒(批号091201)均购于英科新创(厦门)科技有限公司。炎性反应因子(IL-6)试剂盒(批号558301)、炎性反应因子(MCP-1)试剂盒(批号558342)均购于北京利文商贸有限责任公司。
1.3 仪器
流式细胞仪BD FACSVerseTM,美国BD公司生产。
1.4 药物
当归芍药散(当归30 g、赤药160 g、茯苓40 g、白术40 g、泽泻80 g、川芎30 g)。中药饮片由首都医科大学附属北京中医医院中药房提供,由北京中医医院制剂中心制备散剂。立普妥为辉瑞制药有限公司生产,批号为H20051408。
1.5 动物模型的建立与分组
将60只雄性C57小鼠在SPF级动物饲养房饲养,实验分为正常组(n=15)、模型组(n=15)、立普妥组(n=15)、当归芍药散组(n=15)。除正常组外,其余各组小鼠均喂饲高脂饲料(高脂饲料配方:73.3%基础饲料、10%猪油、10%蛋黄粉、1.5%胆固醇、0.2%胆汁酸、5%蔗糖购于北京万德锐志生物有限公司),和腹腔注射脂多糖(lipopolysaccharide,LPS)(1 mg/kg),LPS 每周注射1 次。于造模5周后,开始灌胃给药,每天2次,连续灌胃5周。给药组小鼠灌胃量按成人临床等效剂量换算成小鼠剂量,当归芍药散2.2 g/kg,立普妥0.003 g/kg。正常对照组和模型组灌服等体积蒸馏水。
1.6 主动脉病理学检测
末次给药后,禁食12 h,麻醉,解剖动物,取出主动脉,用10%的甲醛固定,每组取9只,随后进行石蜡切片及常规HE染色,光学显微镜下观察主动脉组织病理学改变。使用Image Proplus 6.0测量管壁内中膜厚度(intima-media thickness,μm)。
1.7 血脂测定
末次给药后,禁食12 h,眶下静脉丛取血,离心后分离血清,分别采用总胆固醇检测试剂盒(CHODPOD法)测定血清TC写浓度,三酰甘油测定试剂(缩写GPO-POD法)测定TG浓度和直接法测定HDL-C和LDL-C浓度。
1.8 血清炎性反应因子浓度测定
采用流式细胞术检测小鼠血清中炎性反应因子浓度。取连续倍比稀释的标准品和待测样品(样品量为50 μL),按照试剂盒说明书完成样品孵育步骤并对流式细胞仪进行设置,然后用流式细胞仪和BDCBA软件获取数据并分析。具体方法参照文献[7]。
1.9 反转录聚合酶链式反应(RT-PCR)
末次给药后,禁食12 h,麻醉,解剖动物,取出肝脏,放入液氮中,后转入-80℃保存,用于检测。
1)肝脏组织总RNA的提取:用超纯RNA提取试剂盒(CWbio.Co.Ltd,Cat#CW0581)提取肝脏组织样本中总RNA。电泳分析总 RNA完整性并检测 RNA的纯度和含量,选用吸光度A260/吸光度A280比值为118~210的RNA用作反转录。
2)反转录制备模板CDNA:将RNA模板、引物、5×RT Buffer和无RNase水溶解并置于冰上备用。向反应管中加入20 μL 反应体系的第一部分,Primer mix,2 μL,消化后 RNA,10 μL,65 ℃孵育5 min,迅速冰浴2 min,短暂离心,使管壁上的溶液收集到管底。继续向以上反应管中加入以下试剂:5 ×RT Buffer 4 μL,0.1 mol/L DTT 2 μL,10 mmol/L dNTP Each 1 μL,HiFi-MMLV Enzyme Mix 1 μL,轻轻吸打混匀,37 ℃ 孵育 50 min,70 ℃ 保温 10 min。反应结束后的cDNA放置-20℃保存。
3)目的基因的PCR扩增:NF-κB上下游引物序列:上游:5’-CAATGGCTACACAGGACCAGGAACA-3,下游:5’-GGATTCGCTGGCTAATGGCTTGCTC-3’,扩增产物长度为215 bp。
内参-actin基因PCR引物:上游:5’-GCCTTCCTTCTTGGGTAT-3’,下 游:5’-GGCATAGAGGTCTTTACGG-3’,扩增产物长度为97 bp。
PPARγ 上 下 游 引 物 序 列:上 游:5’-TTTCAAGGGTGCCAGTTTCG-3’,扩增产物长度 196 bp,下游:5’-ATCCTTGGCCCTCTGAGATGAG-3’,扩增产物长度196 bp。内参基因PCR引物:上游:5’-GCCTTCCTTCTTGGGTAT-3’,下 游:5’-GGCATAGAGGTCTTTACGG-3’,扩增产物长度为97 bp。
扩增程序为:95℃ 10 min,(95℃ 15 s,60℃ 60 s)×45个循环。Real time反应体系为:2×UltraSYBR Mixture:10 μL,上游引物(10 μmol/L):0.4 μL,下游引物(10 μmol/L):0.4 μL,模板:2 μL。加入灭菌蒸馏水至 20 μL。
4)PCR产物分析:取5 μL RNA,用1%琼脂糖凝胶进行电泳,用UVP凝胶图像成像系统进行灰度扫描并拍摄打印实验结果,用凝胶图像分析系统(Gel2 Pro Analyzer Version 310)分析结果,并以β-actin校正作相对量分析,数值以两者之间吸光度的比值表示。
1.1 0 统计学方法
应用SPSS 13.0进行统计学处理,计量数据以均数±标准差(±s)表示,组间比较采用单因素方差分析方法和均数两两比较LSD方法。以P<0.05为差异有统计学意义。
2 结果
2.1 造模结果
与正常组小鼠相比,模型组小鼠出现了脂代谢紊乱和炎性反应因子浓度的提高(图1、2),因此建模成功。
2.2 当归芍药散对代谢性炎性反应小鼠主动脉病理改变的影响
与正常组小鼠相比,模型组小鼠主动脉出现内膜增厚和炎性反应细胞的聚集,与模型组小鼠相比,当归芍药散组小鼠主动脉内膜变薄,炎性反应细胞聚集减少。Image Proplus 6.0测量管壁内中膜厚度,模型组明显增厚(P<0.05),当归芍药散组增厚明显减少(P<0.05)。
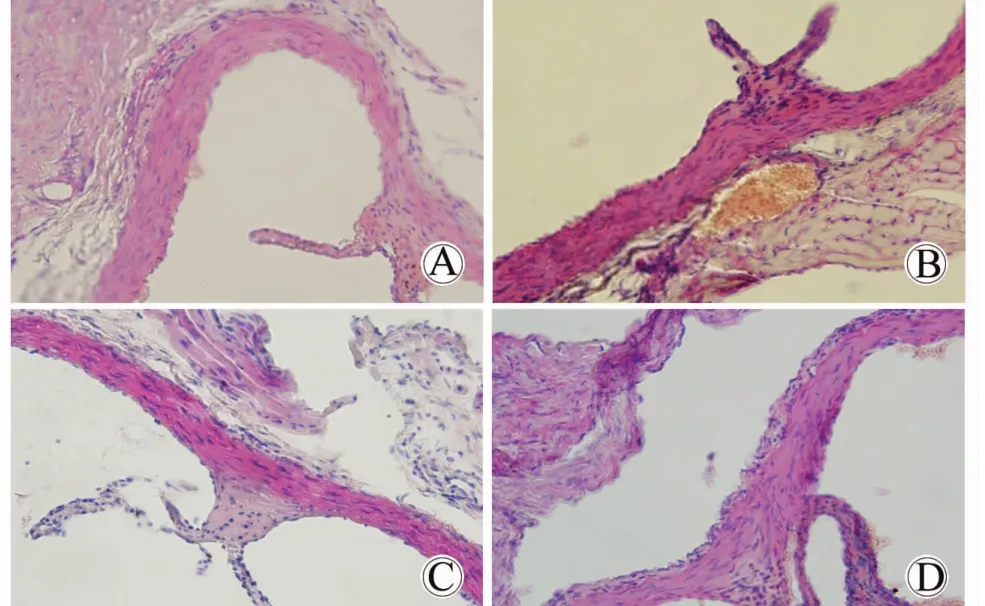
图1 当归芍药散对代谢性炎性反应小鼠主动脉病理改变的影响Fig.1 Effect of Dangguishaoyaosan on the aortic pathological changes of the metaflammatory mice(HE dyed 400×,n=9)
2.3 当归芍药散对代谢性炎性反应小鼠血脂的影响
与正常组小鼠血清血脂相比,模型组小鼠血清TC、TG和LDL-C浓度均明显升高(P<0.01),与模型组小鼠血清血脂相比,当归芍药散组小鼠血清TC、TG和LDL-C浓度降低,差异有统计学意义(P<0.01)。
2.4 当归芍药散对代谢性炎性反应小鼠血清炎性反应因子IL-6和MCP-1浓度的影响
与正常组小鼠血清炎性反应因子水平相比,模型组小鼠血清IL-6和MCP-1水平均升高,差异有统计学意义(P<0.01),与模型组小鼠血清炎性反应因子水平相比,当归芍药散组小鼠血清IL-6和MCP-1浓度降低,差异有统计学意义(P<0.05)。
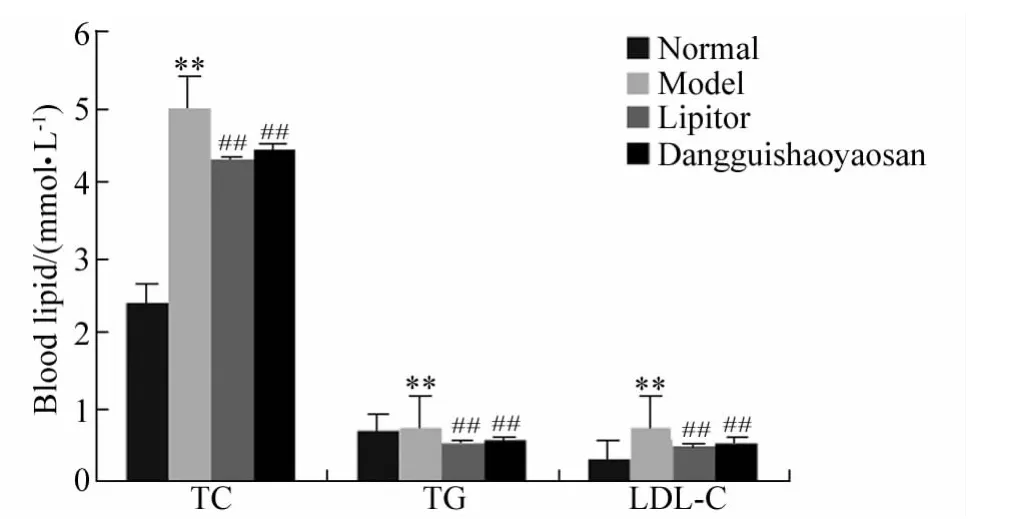
图2 当归芍药散对小鼠血脂水平的影响Fig.2 Effect of Dangguishaoyaosan on the blood lipids of the mice(±s)

图3 当归芍药散对小鼠血清炎性反应因子IL-6和MCP-1浓度的影响Fig.3 Effect of Dangguishaoyaosan on the expression of inflammatory factors,such as IL-6,MCP-1,of the mice(±s)
2.5 当归芍药散对小鼠肝脏NF-κB、PPARγmRNA的表达影响
与正常组小鼠相比,模型组小鼠肝脏NF-κB mRNA水平升高,差异有统计学意义(P<0.05),与模型组小鼠相比,当归芍药散组小鼠肝脏NF-κB mRNA水平降低,差异有统计学意义(P<0.05)。

图4 当归芍药散对小鼠肝脏NF-κB mRNA浓度的影响Fig.4 Effect of Dangguishaoyaosan on the expression of NF-κB mRNA of the mice(±s)
与正常组小鼠相比,模型组小鼠肝脏PPARγ mRNA降低(P<0.05)差异有统计学意义,与模型组小鼠相比,当归芍药散组小鼠肝脏PPARγ mRNA提高,差异有统计学意义(P<0.05)。

图5 当归芍药散对小鼠肝脏PPARγ mRNA的影响Fig.5 Effect of Dangguishaoyaosan on the expression of PPARγ mRNA of the mice(±s)
3 讨论
代谢性炎性反应是由摄入营养物和代谢过剩触发的炎性反应过程,是一种低程度、慢性的系统性炎性反应。研究[8]证实,AS是一种多细胞及炎性细胞因子参与的慢性炎性疾病,并且炎性反应参与AS的全过程。在AS的发展过程中,都有各种炎性反应因子及细胞的参与。其中主要的炎性反应通路就是核因子 κB(nuclear factor kappa B,NF-κB),激活后可促进促炎细胞因子、黏附分子、趋化因子、生长因子以及环氧合酶2和诱导型一氧化氮合酶等氧化应激相关酶基因的过度表达,引起明显的炎性反应,进而可以诱导AS的发生。活化的过氧化物酶体增生物激活受体 γ(peroxisome proliferator-activated receptor gamma,PPARγ)通过多种信号通路,可以抑制AS促炎因子表达,减轻免疫和炎性反应,抑制单核细胞/巨噬细胞向泡沫细胞转化等,调节炎性反应,从而延缓AS发展。PPARγ已成为抗AS新药开发的新靶点。
目前有多种化学物质及微生物(病毒和细菌)可制作慢性炎性反应模型,常用的有酪蛋白皮下注射制作慢性炎性反应模型[9-11]和小剂量腹腔注射脂多糖(lipopolysaccharide,LPS)制作慢性炎性反应模型,本实验中采取了高脂联合LPS来制备小鼠代谢性炎性反应模型,模型小鼠出现了脂代谢紊乱和炎性因子浓度的提高,与既往的研究[12]相符合,成功复制了小鼠代谢性炎性反应模型。而肠道是人体最大的细菌和LPS库,肠道菌群的改变增大了肠壁的通透性,使得血液中内毒素浓度升高,促进炎性反应细胞因子的产生,说明代谢性炎性反应的形成很可能与肠道菌群失调有关。
高脂血症和动脉粥样硬化早期以痰湿为主要病机,随着病情进展出现血瘀证候,由痰致淤,痰淤互结,痰浊贯穿病程始终。本课题组既往研究[13]也证实高脂血症和动脉粥样硬化存在由痰致淤的病理演变,以痰淤互结为主要病机,因此本实验采用了化痰活血的当归芍药散来治疗高脂血症及动脉粥样硬化,以起到痰淤同治的效果。有研究[14]发现当归芍药散对炎性疾病具有一定的疗效。本研究结果表明当归芍药散减低了小鼠的血脂浓度。PPARγ配体或激动剂通过降低TG和LDL-C浓度来调节脂代谢紊乱[15]。
本实验结果表明当归芍药散可以显著降低代谢性炎性反应小鼠血脂和炎性反应因子IL-6和MCP-1浓度,且显著降低了 NF-κB mRNA表达并提高了PPARγ mRNA的表达水平。表明当归芍药散可能通过抑制NF-κB的活化从而减少了炎性反应因子IL-6、MCP-1的表达以抑制炎性反应。同时当归芍药散提高了PPARγ mRNA表达,PPARγ配体或激动剂通过降低TG和LDL-C浓度来调节脂代谢紊乱,通过抑制NF-κB的活化,减少炎性反应因子IL-6、MCP-1的表达,从而抑制炎性反应。本研究表明当归芍药散可通过调节代谢性炎性反应治疗早期动脉粥样硬化,为当归芍药散治疗动脉粥样硬化的临床应用提供了实验依据。
[1] Hotammisligi G S.Inflammation and metabolic disorders[J].Nature,2006,444(7121):860-867.
[2] 王椿野,赵振武,李新龙.基于现代文献的动脉粥样硬化中医病机研究[J].环球中医药,2013,6(2):92-95.
[3] 宋晓宇,张天真,徐薇,等.当归芍药散治疗血脂异常痰瘀互结证的临床观察[J].河北中医学报,2009,24(1):12-13.
[4] 陈静,叶平,阎艳丽,等.当归芍药散防治高脂血症的实验研究[J].天津中医药,2005,22(6):493-494.
[5] 阎艳丽,王鑫国,宋晓宇,等.当归芍药散对高脂血症家兔脂代谢及血流变学的影响[J].辽宁中医杂志,2005,32(2):170-171.
[6] 晓宇,王鑫国,杨旭杰,等.当归芍药散(汤剂)调节血脂异常大鼠脂质代谢组方作用协同性研究[J].陕西中医,2007,28(2):235-237.
[7] 肖平,曾耀英,林蔚.流式细胞术微球阵列法检测急性白血病血清IL-6、IL-10和TNF水平[J].暨南大学学报:医学版,2008,4(29):376-378.
[8] Ganturoco S H,Bradley W A.Pathophysiology of triglycenride-rich lipoproteins in atherothrothmbosis:cellular aspects[J].Clin Cardiol,1999,22(Spl 6):II7-14.
[9] Baltz M L,Gomer K,Davies A J,et al.Differences in the acute phase responses of serum amyloid P-component(SAP)and C3 to injections of casein or bovine serum albumin in amyloid-susceptible and-resistant mouse strains[J].Clin Exp Immunol,1980,39(2):355-360.
[10] Hrabak A,Bajor T,Csuka I.The effects of various inflammatory agents on the alternative metabolic pathways of arginine in mouse and rat macrophage[J].Inflamm Res,2006,55(1):23-31.
[11]Miyamoto M,Sato E F,Nishikawa M,et al.Effect of endogenously generated nitric oxide on the energy metabolism of peritoneal macrophages[J].Physiol Chem Phys Med NMR,2003,35(1):1-11.
[12] Yin K,Tang S L,Yu X H.Apolipoprotein A-I inhibits LPS-induced atheroscler-osis in ApoE-/-mice possibly via activated STAT3-mediated upregulation of tristetraprolin[J].Acta Pharmacologica Sinica,2013,34(6):837-846.
[13]刘卫红,张琪,张蕾,等.高脂血症及动脉粥样硬化痰瘀演变的代谢组学研究[J].中医杂志,2008,49(8):738-741.
[14]桑希生,姜琪,王志国,等.当归芍药散治疗慢性盆腔炎85 例临床观察[J].中医药学报,1999,27(4):29.
[15]祝海,翁博文,徐珞,等.前列腺癌组织PPAR-γ及其配体表达和作用机制的研究[J].中华肿瘤防治杂志,2012,19(11):840-843.
