ACE2/Ang-(1-7)改善肝细胞糖代谢
2014-12-02杨芳远史婷婷谢荣荣杨金奎
曹 曦 杨芳远 史婷婷 谢荣荣 信 中 杨金奎*
(1.首都医科大学附属北京同仁医院内分泌科,北京100730;2.糖尿病防治研究北京市重点实验室,北京100730)
肾素-血管紧张素系统(rennin-angiotensin system,RAS)已被证实参与并促进胰岛素抵抗的发展[1-3]。血管紧张素转换酶2(angiotensin-converting enzyme 2,ACE2)-血管紧张素(1-7)〔Ang-(1-7)〕-Ang-(1-7)受体(MAS)轴作为RAS的一个负调节轴,可能对2型糖尿病的发展起到一定的保护作用[3-4]。肝脏是胰岛素抵抗发展过程中的主要器官之一,已经证实ACE2在肝脏中表达[5]。本文将在细胞水平进一步研究ACE2/Ang-(1-7)对HepG2细胞糖代谢的影响。
1 材料与方法
1.1 细胞培养
HepG2细胞购自中国协和医科大学细胞资源中心(Cell Resource Center,IBMS,CAMS/PUMC),用含10%胎牛血清(FBS)的DMEM进行体外培养(100 U/mL青霉素和0.1 mg/mL链霉素),接种并置37℃、5%CO2饱和湿度的CO2孵箱内培养,每2 d胰酶消化传代。
1.2 质粒的构建和转染
大鼠ACE2基因构建到pcDNA3.1/myc-His(-)B(PCDB)(Sino-Geno Max,China)载体上。质粒DNA采用Lipofectamine TM 2000(Invitrogen公司,美国)脂质体转染法,根据转染试剂盒操作说明转染HepG2细胞。以pcDNA3.1空载体转染HepG2细胞作为对照组。细胞转染48 h后用于后续实验。
1.3 RNA的提取和实时定量RT-PCR
应用Trizol法抽提HepG2细胞总RNA(Invitrogen公司,美国),以2 mg RNA为模板利用Rever TraAceq PCR RT试剂盒(Toyobo公司,日本)反转出cDNA。利用ABI GeneAmp 5700PCR系统(Applied Biosystems公司,美国),SYBR Green PCR master mix反应液检测RNA的表达。经分析系统进行相关表达的定量。引物序列如下表:

表1 RT-PCR引物Tab.1 Primers for RT-PCR
1.4 ROS 检测
HepG2 细胞用 H2O2(250 μmol/L)刺激 5 min,之后用 Ang-(1-7)(10 nmol/L)或 A779(1 μmol/L)处理1 h。二氢乙啶(Dihydroethidium,DHE)检测:培养的细胞用5 μmol/L DHE(Sigma公司,美国)在37℃黑暗中孵育40 min,磷酸缓冲盐溶液(Phosphate Buffered Saline,PBS)洗涤2次,用胰蛋白酶消化,并悬浮在1 mL PBS,立即用流式细胞仪(Biosciences公司,美国)读取荧光强度,激发光为500 nm,发射光为530 nm。
1.5 Western blotting
在4℃条件下,加入裂解液提取HepG2细胞蛋白。用BCA Protein Assay Kit测定样品蛋白浓度。每个样本取30~60 μg蛋白进行SDS聚丙烯酰胺凝胶电泳并转至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)上,用含5%(质量分数)脱脂奶粉的TBST溶液封闭4 h,加入一抗于4℃孵育过夜。TBST漂洗2次,每次5 min,加入1∶5 000辣根过氧化物酶标记的二抗,室温孵育1 h,TBST漂洗6次,每次5 min,肌动蛋白(actin)为内参,将膜用化学发光试剂孵育1 min,于X胶片上曝光,常规显影、定影。将结果用Gelpro3.2软件进行密度分析。P67phox、p22phox购自美国Santa Cruz公司。
1.6 统计学方法
运用Prism5(GraphPad Software)进行统计分析。计量资料用均数±标准差(±s)表示,组间比较使用t检验或方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 ACE2改变糖异生相关基因表达
RT-PCR检测ACE2过表达细胞中PEPCK和G6Pase mRNA的表达量。结果显示,ACE2过表达细胞中PEPCK的表达水平与对照组相比显著降低(P<0.01),而G6Pase与对照组相比,差异无统计学意义,详见图1。
2.2 ACE2改变HepG2细胞中糖代谢相关基因表达
RT-PCR检测过表达细胞中 Glut2、IRS-2、AMPKα2和 SOCS-3 mRNA的表达量。结果显示,ACE2过表达细胞中Glut2、IRS-2和AMPKα2的表达水平与对照组相比显著增高(P<0.01),而SOCS-3与对照组相比表达量显著降低,详见图2。

图1 ACE2对HepG2细胞糖异生基因表达的影响Fig.1 The effect of ACE2 on gluconeogenesis genes expression in HepG2 cells
2.3 Ang-(1-7)减低细胞中ROS的产生
用DHE检测HepG2细胞内ROS浓度,用Ang-(1-7)或A779预处理细胞1 h后,用流式细胞仪检测发现,Ang-(1-7)显著降低HepG2细胞内ROS的浓度,A779显著增加HepG2细胞内ROS的浓度。在H2O2处理下,Ang-(1-7)显著降低HepG2细胞内ROS的浓度,详见图3。
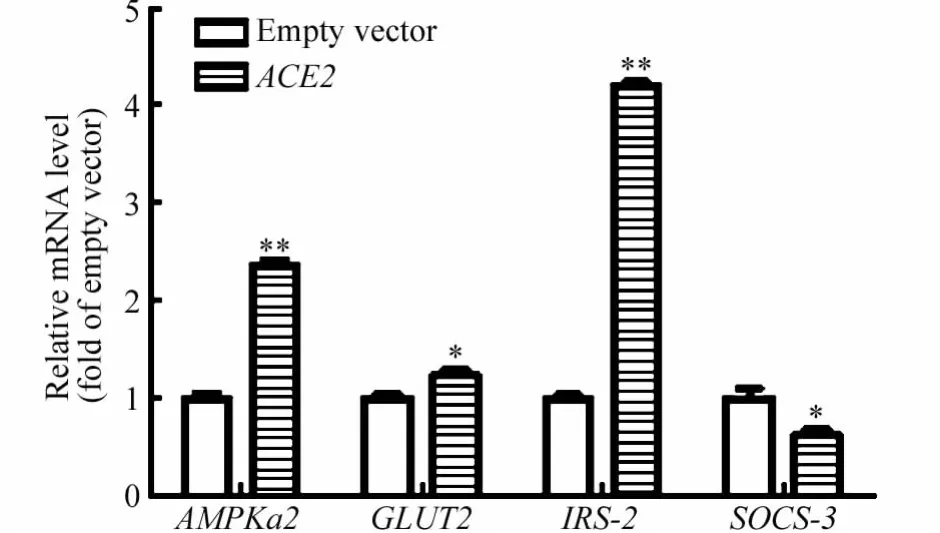
图2 ACE2对HepG2细胞糖代谢相关基因表达的影响Fig.2 The effect of ACE2 on glucose metabolism gene expression in HepG2 cells

图3 Ang-(1-7)降低HepG2细胞内ROS浓度Fig.3 Ang-(1-7)reduces ROS production in HepG2 cells
2.3 激活ACE2/Ang-(1-7)减低NADPH相关亚基表达水平
进一步研究显示,Ang-(1-7)能显著降低HepG2细胞内NADPH亚基p67和p22的表达。此外,Western blotting检测结果也显示,ACE2过表达,也能显著降低HepG2细胞中p67和p22的表达,同时,ACE2对氧化应激的保护作用能被A779抑制,详见图4。
3 讨论
肝脏胰岛素抵抗被认为是2型糖尿病的主要原因之一[6]。研究[7-8]表明,血管紧张素Ⅱ(AngⅡ)在胰岛素抵抗的发生过程中发挥着重要作用。ACE2将AngⅡ分解为Ang-(1-7),Ang-(1-7)通过其受体MAS抑制AngⅡ信号。MAS缺乏的FVB/N小鼠表现出糖耐量受损,降低胰岛素抵抗[9],提示Ang(1-7)信号在2型糖尿病和代谢综合征中的作用。ACE2在多种疾病中起到负调节RAS的作用[10]。Zucker肥胖糖尿病大鼠的胰岛中ACE2蛋白表达升高[11],高糖诱导下ACE2基因敲除的小鼠胰岛素抵抗加剧[12]。这些数据提示ACE2在预防胰岛素抵抗中的作用。本研究支持了这一观点,ACE2改善肝脏糖代谢相关基因的表达。

图4 ACE2/Ang-(1-7)降低HepG2细胞中NADPH相关亚基的表达Fig.4 ACE2/Ang-(1-7)reduce NADPH expression in HepG2 cells
ROS可通过多个过程产生,如线粒体电子传递链、一氧化氮合酶、黄嘌呤氧化酶,以及NOX家族的NADPH 氧化酶[13]。最近的很多研究[14-16]都在关注NOX酶在胰岛素抵抗中的作用。在骨骼肌细胞,血管紧张素Ⅱ诱导的NADPH氧化酶的活化损害胰岛素信号[14-15]。ACE2-Ang-(1-7)-MAS 轴,作为 RAS 的一个负调节轴,可能通过抗氧化作用以减少胰岛素抵抗[16]。本研究结果支持这一观点,在HepG2细胞中,ACE2/Ang-(1-7)能通过抑制NADPH氧化酶的表达减低氧化应激作用,对肝脏氧化应激有保护作用。
在本研究中,笔者使用HepG2细胞作为模型细胞研究ACE2/Ang-(1-7)对肝脏胰岛素抵抗的影响。众所周知,AMPK是一个能量传感器,它调控糖脂代谢[17]。AMPKα2 的 活 性 与 胰 岛 素 抵 抗 相 关[18]。HepG2细胞已被证实通过AMPK调节胰岛素信号通路和糖代谢相关基因的表达[19]。本研究结果支持这一观点,ACE2诱导 AMPKα2的表达,糖异生基因(PEPCE和G6Pase)表达受到抑制,而Glut-2和IRS-2等糖代谢相关基因表达量增加。
SOCS-3属于SOCS蛋白家族,SOCS-3通过结合胰岛素受体的磷酸化位点来竞争性干预其他含有SH2结构域蛋白的相互结合[20]。此外,在肝脏中,诱导SOCS-3的表达是白介素-6介导的胰岛素抵抗的重要机制之一[21]。综合上述研究,笔者推测,ACE2/Ang-(1-7)抑制 SOCS-3的表达,进而 SOCS-3抑制IRS-2和AKT磷酸化的能力降低,从而能改善胰岛素抵抗。这也可能是ACE2/Ang-(1-7)改善肝脏糖代谢的又一机制。
综上所述,本研究结果表明,激活ACE2/Ang-(1-7)可调节肝脏糖代谢相关基因的表达,这些基因表达量的改变对肝脏胰岛素抵抗有保护作用。而这一过程可能是通过减低氧化应激水平,或是通过AMPKα2和SOCS-3的调控作用来实现的。本研究结果进一步明确了ACE2/Ang-(1-7)在肝脏糖代谢过程中的作用,并为ACE2/Ang-(1-7)在胰岛素增敏机制中的作用提供了新的线索。
[1] Henriksen E J.Improvement of insulin sensitivity by antagonism of the renin-angiotensin system[J].Am J Physiol Regul Integr Comp Physiol,2007,293(3):R974-R980.
[2] Perkins J M,Davis S N.The renin-angiotensin-aldosterone system:a pivotal role in insulin sensitivity and glycemic control[J].Curr Opin Endocrinol Diabetes Obes,2008,15(2):147-152.
[3] Santos S H,Giani J F,Burghi V,et al.Oral administration of angiotensin-(1-7)ameliorates type 2 diabetes in rats[J].J Mol Med(Berl),2014,92(3):255-265.
[4] Santos S H,Braga J F,Mario E G,et al.Improved lipid and glucose metabolism in transgenic rats with increased circulating angiotensin-(1-7)[J].Arterioscler Thromb Vasc Biol,2010,30(5):953-961.
[5] Paizis G,Tikellis C,Cooper M E,et al.Chronic liver inju-ry in rats and humans upregulates the novel enzyme angiotensin converting enzyme 2[J].Gut,2005,54(12):1790-1796.
[6] Taniguchi C M,Ueki K,Kahn R.Complementary roles of IRS-1 and IRS-2 in the hepatic regulation of metabolism[J].J Clin Invest,2005,115(3):718-727.
[7] Richey J M,Ader M,Moore D,et al.AngiotensinⅡ induces insulin resistance independent of changes in interstitial insulin[J].Am J Physiol,1999,277(5 Pt 1):E920-E926.
[8] 崔常清.胰岛素抵抗的机制与临床研究进展[J].中国煤炭工业医学杂志,2012,(7):1119-1121.
[9] Santos S H,Fernandes L R,Mario E G,et al.Mas deficiency in FVB/N mice produces marked changes in lipid and glycemic metabolism[J].Diabetes,2008,57(2):340-347.
[10] Clarke N E,Turner A J.Angiotensin-converting enzyme 2:the first decade[J].Int J Hypertens,2012,2012:307315.
[11] Tikellis C,Wookey P J,Candido R,et al.Improved islet morphology after blockade of the renin-angiotensin system in the ZDF rat[J].Diabetes,2004,53(4):989-997.
[12] Takeda M,Yamamoto K,Takemura Y,et al.Loss of ACE2 exaggerates high-calorie diet-induced insulin resistance by reduction of GLUT4 in mice[J].Diabetes,2013,62(1):223-233.
[13] Bedard K,Krause K H.The NOX family of ROS-generating NADPH oxidases:physiology and pathophysiology[J].Physiol Rev,2007,87(1):245-313.
[14]Wei Y,Sowers J R,Nistala R,et al.AngiotensinⅡ-induced NADPH oxidase activation impairs insulin signaling in skeletal muscle cells[J].J Biol Chem,2006,281(46):35137-35146.
[15]臧莎莎,宋桉,宋光耀.骨骼肌胰岛素抵抗影响因素研究[J].解放军医药杂志,2013,(11):99-101.
[16] Yuan L,Li X,Li J,et al.Effects of renin-angiotensin system blockade on the islet morphology and function in rats with long-term high-fat diet[J].Acta Diabetol,2013,50(4):479-488.
[17] Hardie D G.The AMP-activated protein kinase pathway——new players upstream and downstream[J].J Cell Sci,2004,117(Pt 23):5479-5487.
[18] Long Y C,Zierath J R.AMP-activated protein kinase signaling in metabolic regulation[J].J Clin Invest,2006,116(7):1776-1783.
[19]Nakamaru K,Matsumoto K,Taguchi T,et al.AICAR,an activator of AMP-activated protein kinase,down-regulates the insulin receptor expression in HepG2 cells[J].Biochem Biophys Res Commun,2005,328(2):449-454.
[20] Rui L,Yuan M,Frantz D,et al.SOCS-1 and SOCS-3 block insulin signaling by ubiquitin-mediated degradation of IRS1 and IRS2[J].J Biol Chem,2002,277(44):42394-42398.
[21] Senn J J,Klover P J,Nowak I A,et al.Suppressor of cytokine signaling-3(SOCS-3),a potential mediator of interleukin-6-dependent insulin resistance in hepatocytes[J].J Biol Chem,2003,278(16):13740-13746.
