nPKC-PKD3信号传导途径介导Prostratin活化HIV-1转录
2014-12-01王会平刘润忠
王会平,刘 敏,刘润忠
(厦门大学生命科学学院,福建 厦门361102)
艾滋病在全球范围内流行多年,目前行之有效的治疗方案称之为高效抗逆转录病毒疗法(HAART),即通常为大众所熟知的“鸡尾酒疗法”[1-2].“鸡尾酒疗法”主要针对艾滋病毒的逆转录酶、蛋白酶以及外壳糖蛋白Gp41,因此它仅对患者体内处于复制周期的活病毒疗效显著,用药后患者血液中活病毒的滴度可降至无法检测到的水平,无法彻底清除患者体内的艾滋病毒;停药后,患者的病情极易出现反复[2-3].近年来人们提出一种新的治疗策略[4],用另外一类化合物刺激潜伏的艾滋病毒使其进入复制周期,再联用“鸡尾酒疗法”清除这些活病毒,以此来避免患者终生用药的负担并最终治愈艾滋病.虽然这种治疗策略理论上存在可行性,但目前人们对于艾滋病毒潜伏和重新活化的理解还很有限,缺乏相应的分子机制模型用于筛选这类活化潜伏病毒的化合物,从而造成临床治疗实践的进展缓慢[5-6].因此,深入探讨艾滋病毒的潜伏以及重新活化的分子机制已经成为当下研究人员所关注的焦点.
在业已发现的、为数不多的能激活潜伏艾滋病毒的化合物中,Prostratin是研究最多的一种,它作为潜在的抗艾滋病药物已进入II期临床试验[6-10].Prostratin是不致癌的佛波酯类化合物,具备此类化合物的共性,即活化细胞内蛋白激酶C(PKC)信号通路[11];该信号通路的核心蛋白PKC也被证实对活化免疫T细胞中潜伏的艾滋病毒起关键性的作用[9].PKC家族包含3个亚型:典型PKC(tPKC,包括α、βI、βII和γ)、新型PKC(nPKC,包括δ、ε、η和θ)以及非典型PKC(aPKC,包括ζ和λ).PKC家族所有成员的碳端都有相同的具催化活性的结构域;氮端的差异则较大,便于结合不同的上游调控蛋白和下游效应蛋白从而执行不同的功能.当胞外信号刺激细胞时,胞内的磷脂酶C(PLC)首先活化并诱导产生第二信使——甘油二酯(DAG),随后PKC活化并将信号传递给下游效应分子诸如蛋白激酶D(PKD)以执行相应的生物学功能[12-13].由于基因的转录活化是激活潜伏艾滋病毒的前提,因此Prostratin是否也是通过活化PKC信号途径激活艾滋病毒的基因转录,进而活化潜伏的艾滋病毒成为亟待解决的问题.
本文选用稳定表达HIV-LTR-Luciferase报告基因的 HeLa细胞(HIV-LTR-Luc细胞)为研究对象,用Prostratin和多种PKC抑制剂联合处理细胞,证实了nPKC亚型参与Prostratin诱导的HIV-1转录活化,并最终通过效应蛋白PKD3激活HIV-1转录的分子信号传导机制.
1 材料与方法
1.1 材 料
PKC抑制剂 Gö6976、Gö6983和BIMI(Gö6850)购自美国Calbiochem公司;Prostratin购自美国LC Laboratories公司;转染试剂PEI购自美国Polysciences公司;荧光素酶底物购自美国Promega公司.持续活化型PKCθ、PKCε和PKCα的表达质粒受赠于美国华盛顿大学 Andrew Matthews Scharenberg教授[14-15];PKD3敲 低 质 粒 (shPKD3)的 靶 序 列 为:5′-GTC CTA AGA CGG GAC TCT C[16].
1.2 方 法
1.2.1 细胞培养和药物处理实验
HIV-LTR-Luc稳定细胞株[17]培养在含10%(质量分数)胎牛血清(FBS)的DMEM完全培养基中.药物处理时细胞密度约为50%~70%,先用PKC抑制剂预处理1h,然后用2μmol/L的Prostratin继续处理6h.药物处理后,收集并裂解细胞用于荧光素酶活性分析.
1.2.2 荧光素酶活性分析
将HIV-LTR-Luc稳定细胞株培养在六孔板里并用相应的药物处理.药物处理后,细胞裂解液按照以前描述过的方案测量荧光素酶活性[18],根据3次不同的实验计算标准误差.
1.2.3 细胞瞬时转染
转染前1d将HIV-LTR-Luc稳定细胞株胞培养在六孔板里,细胞密度约为70%~90%.将2μg待转染的质粒和3μL PEI溶液混匀后加入细胞培养基中,继续培养48h.细胞裂解液按照以前描述过的方案测量荧光素酶活性[18],根据3次不同的实验计算标准误差.
2 实验结果
2.1 Prostratin刺激HIV-LTR-Luc的转录活化
为研究Prostratin激活HIV-1的转录活性进而活化潜伏的艾滋病毒的分子机制,本文选用了HIVLTR-Luc稳定细胞株.该细胞株构建自HeLa细胞,它整合了由HIV-1长末端(LTR)启动子所调控的荧光素酶报告基因,其荧光素酶的表达水平直接反映HIV-1的转录活性[17-18].
首先,用不同浓度的Prostratin处理细胞6h.如图1所示,荧光素酶的表达水平随Prostratin浓度上升而升高,即 HIV-1的转录活性也在不断升高;当Prostratin浓度为5μmol/L时,HIV-1转录水平提高100倍以上.为避免高剂量药物衍生的毒理作用,后续实验中Prostratin的处理浓度限定为2μmol/L.紧接着,在这一浓度条件下,测试了不同处理时间对HIV-1转录活性的影响.发现随着处理时间的延长,HIV-1转录活性逐渐增强;用Prostratin处理细胞6h左右已经能高效地激活HIV-1的转录(图2).由于细胞在转录水平应答外界信号刺激可在较短的时间内实现,而长时间药物处理会带来信号传导过程中的次级应答使得问题变得过于复杂,因此后续实验中药物处理时间限定为6h.
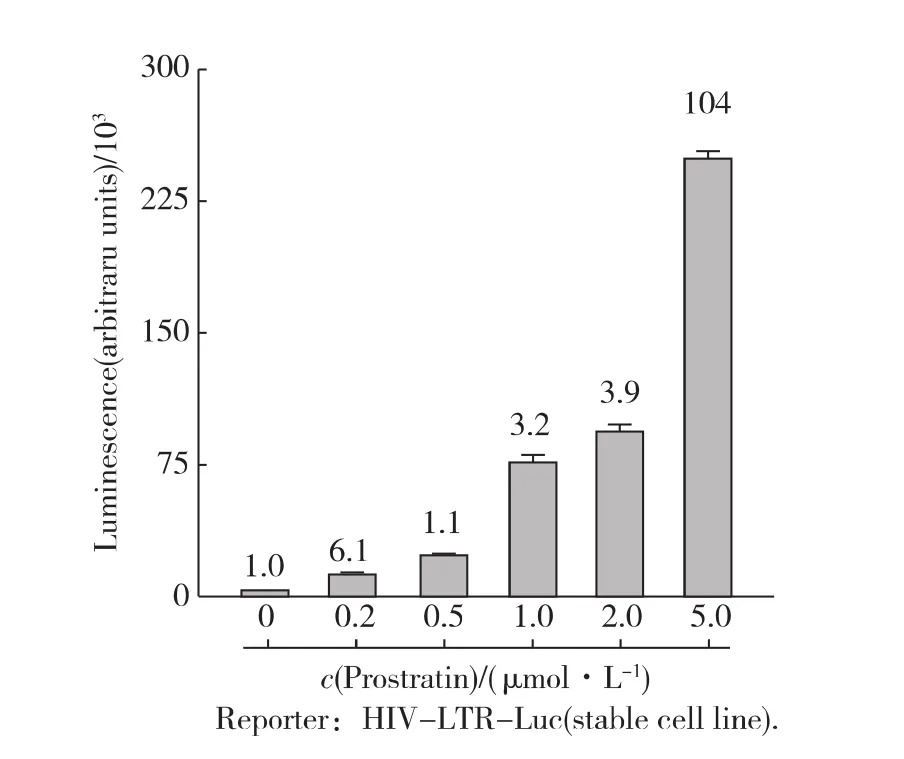
图1 不同浓度的Prostratin处理后HIV-1的转录活性Fig.1 Prostratin activated gene expression from stably integrated HIV-LTR-luciferase reporter in a dose-dependent manner
2.2 Prostratin通过nPKC活化HIV-1的转录
此前其他实验室在Jurkat免疫T细胞中证实蛋白PKC参与Prostratin活化潜伏艾滋病毒的过程[9],那么Prostratin激活HIV-1转录是否有蛋白PKC的参与呢?首先,我们采用3种不同的蛋白PKC的抑制剂预处理细胞再偶联Prostratin刺激来观察HIV-1的转录活性.如图3所示,广谱的PKC抑制剂Gö6983和BIM I均能削弱Prostratin刺激引起的HIV-1的转录活化,而另1种PKC抑制剂Gö6976却没有这个作用.仔细分析这3种PKC抑制剂的特异性,发现Gö6983和 BIM I主 要 抑 制 tPKC 和 nPKC[19],而Gö6976只能抑制tPKC;这意味着nPKC可能参与Prostratin刺激的HIV-1的转录活化.接下来为进一步证实这个推论,在HIV-LTR-Luc细胞中瞬时过表达了持续活化型的PKCθ、PKCε和PKCα.如图4所示,其中2种nPKC均能直接激活HIV-1的转录活性,而tPKC则无此功能.因此,nPKC直接介导了Prostratin刺激引起的HIV-1的转录活化.
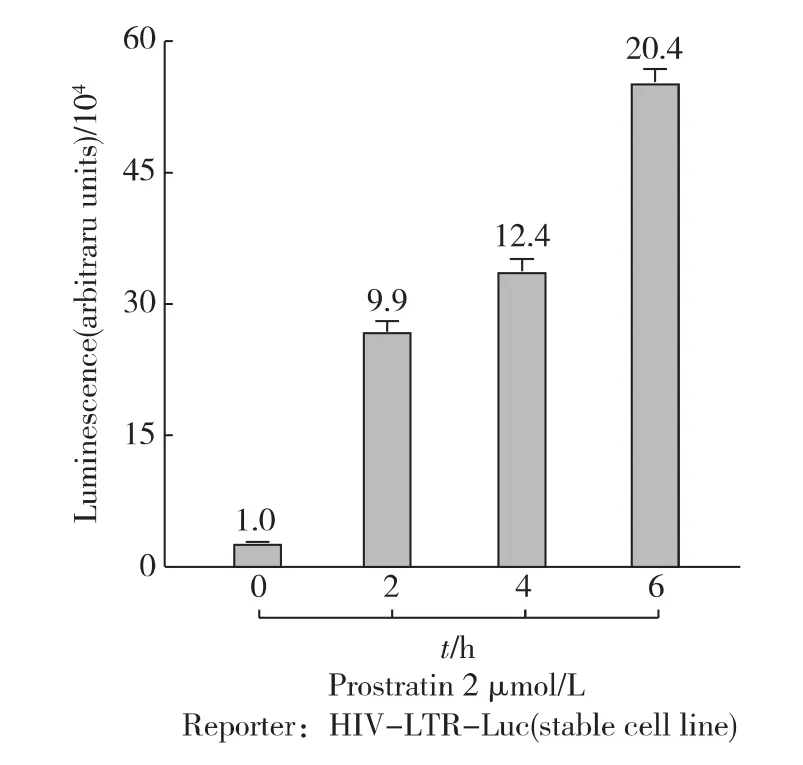
图2 Prostratin处理不同时间后HIV-1的转录活性Fig.2 Time course of Prostratin-stimulated HIV-LTR-Luc expression
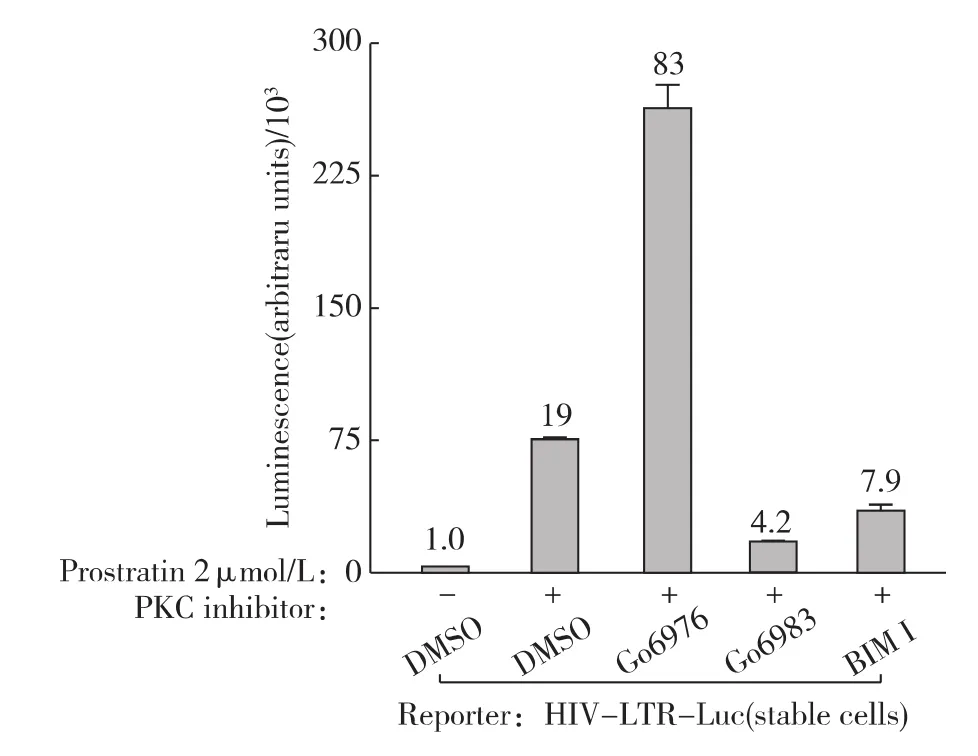
图3 PKC抑制剂阻断Prostratin活化的HIV-1转录Fig.3 Effect of PKC inhibitors on Prostratin-activated HIV-1expression
2.3 敲低效应蛋白PKD3拮抗Prostratin刺激活化的HIV-1转录
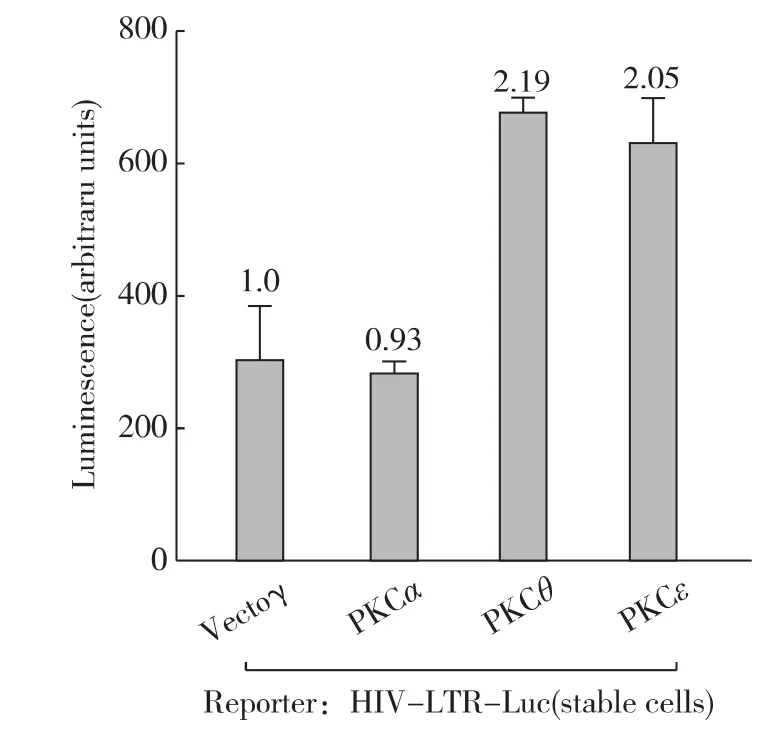
图4 3种PKC对HIV-1转录活性的影响Fig.4 Effect of overexpression of selected PKC isoforms on HIV-1expression
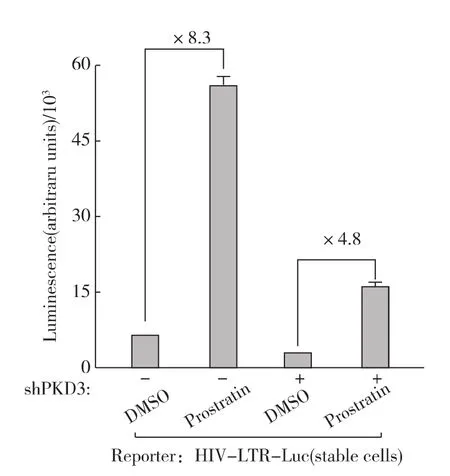
图5 敲低PKD3削弱Prostratin活化的HIV-1转录Fig.5 The effect of shRNA knock-down on Prostratin-activated HIV-1expression
下游效应蛋白是信号传导过程中特定功能的执行者.我们之前的实验证实,PKC信号途径的效应蛋白PKD最终影响HIV-1的转录活性[16].PKD家族共有3个成员,前期的实验表明PKD3而非PKD1、PKD2介导 HIV-1的转录活化[16].因此,我们先用特异的shRNA敲低PKD3,然后再用Prostratin处理细胞观察HIV-1的转录活性.PKD3被敲低以后(内源性PKD3减少约50%)[16],Prostratin刺激所引起的HIV-1转录活化倍数也相应的减少一半左右(图5).这进一步证明,Prostratin处理激活了nPKC-PKD3信号传导途径从而活化HIV-1的转录.
3 讨 论
尽管Prostratin在临床上的个别应用已取得了一定的疗效[20-21],但具体的药用机理仍不清楚,这显著延缓了临床广泛的使用[6].本文从分析HIV-1转录活性入手,以HIV证实nPKC-PKD3信号传导途径参与Prostratin刺激引起的HIV-1转录活性增强.本文所发现的信号传导机制,为提速Prostratin大范围应用于临床治疗提供了可靠的基础理论依据,同时也为日后构建新的抗艾滋病药物筛选模型以及药物作用靶点提供了新的线索.
在本研究前,研究人员以携带潜伏HIV-1的免疫细胞为模型,初步将蛋白PKC与活化潜伏的艾滋病毒的现象相联系[9].然而,事实上该潜伏HIV-1细胞模型与真实的艾滋病毒潜伏过程存在明显的区别[22].首先,真实的艾滋病毒潜伏过程中,93%的HIV-1基因组会整合在宿主处于高度转录活化状态的基因的内含子区,因此可能是转录过程中相伴的RNA剪辑导致RNA聚合酶II直接滑过HIV-1的基因从而引起 HIV-1基因未被转录[23];而潜伏 HIV-1细胞模型中,HIV-1基因更多整合在异染色体区,由于染色体空间结构未被打开,该区的基因处于转录抑制状态[24].其次,真实的艾滋病毒潜伏多发生在免疫T细胞记忆细胞中,此类细胞处于细胞周期的静息期,不生长也不分裂[25-26];而潜伏 HIV-1细胞模型为常规的免疫T细胞,处于正常的细胞增殖周期,细胞快速生长并进行有丝分裂[24].因此,为规避细胞模型与真实过程之间的差异,同时将复杂的多因素协同实现的艾滋病毒潜伏过程简化为简单的实验模型,选取了专门为研究HIV-1转录活性而设计的 HIV-LTR-Luc细胞模型.因为潜伏HIV-1活化的源头就是潜伏的HIV-1退出静息状态,开始第1轮HIV-1基因的转录.当最初的转录以及翻译完成后,新生的病毒蛋白如Tat会强烈刺激后续的转录过程,从而最终促使艾滋病迅猛复发.
在过去10余年的研究中,我们采用HIV-LTRLuc细胞模型已经成功诠释过处于复制周期中的活病毒的转录机制,即凭借病毒蛋白Tat绑架宿主转录系统中的核心分子正性转录延伸因子b(P-TEFb),并进一步利用P-TEFb能刺激基因转录延伸的性能,方便HIV-1可以顺利合成完整的全基因产物[27-29].对于潜伏的艾滋病毒而言,由于第1轮转录都没有启动,活病毒转录所倚重的病毒蛋白Tat还没有产生,潜伏的HIV-1只能更多依赖于转录因子 NFκB[9].转录因子NFκB会募集Brd4-P-TEFb蛋白复合体(由蛋白Brd4与P-TEFb相互作用形成的蛋白复合体)到HIV-1启动子区的NFκB结合位点附近,通过P-TEFb激活RNA聚合酶II完成第1轮HIV-1基因的转录.有报道指出PKD可以调控NFκB.活化的PKD通过磷酸化激活IKK复合体,活化了的IKK会促进NFκB抑制蛋白IκB的泛素化降解,从而通过去抑制作用激活转录因子NFκB.因此当Prostratin刺激所产生的应答信号传递到效应蛋白PKD3以后,PKD3作为PKC信号传导途径与NFκB信号传导途径的整合点,最终改变了潜伏HIV-1的转录活性.
[1]Lewin S R,Evans V A,Elliott J H,et al.Finding a cure for HIV:will it ever be achievable[J].J Int AIDS Soc,2011,14:4.
[2]Stevens M,De Clercq E,Balzarini J.The regulation of HIV-1transcription:molecular targets for chemotherapeutic intervention[J].Med Res Rev,2006,26(5):595-625.
[3]Siliciano R F.Scientific rationale for antiretroviral therapy in 2005:viral reservoirs and resistance evolution[J].Top HIV Med,2005,13(3):96-100.
[4]Archin N M,Margolis D M.Emerging strategies to deplete the HIV reservoir[J].Curr Opin Infect Dis,2014,27(1):29-35.
[5]Han Y,Wind-Rotolo M,Yang H C,et al.Experimental approaches to the study of HIV-1latency[J].Nat Rev Microbiol,2007,5(2):95-106.
[6]Liu M,Hsu J,Chan C,et al.The ubiquitin ligase Siah1 controls ELL2stability and formation of super elongation complexes to modulate gene transcription[J].Mol Cell,2012,46(3):325-334.
[7]Korin Y D,Brooks D G,Brown S,et al.Effects of prostratin on T-cell activation and human immunodeficiency virus latency[J].J Virol,2002,76(16):8118-8123.
[8]Kulkosky J,Culnan D M,Roman J,et al.Prostratin:activation of latent HIV-1expression suggests a potential inductive adjuvant therapy for HAART[J].Blood,2001,98(10):3006-3015.
[9]Williams S A,Chen L F,Kwon H,et al.Prostratin antagonizes HIV latency by activating NF-kappaB[J].J Biol Chem,2004,279(40):42008-42017.
[10]Beans E J,Fournogerakis D,Gauntlett C,et al.Highly potent,synthetically accessible prostratin analogs induce latent HIV expressionin vitro and ex vivo[J].Proc Natl Acad Sci USA,2013,110(29):11698-11703.
[11]Gulakowski R J,McMahon J B,Buckheit R W,Jr,et al.Antireplicative and anticytopathic activities of prostratin,a non-tumor-promoting phorbol ester,against human immunodeficiency virus(HIV)[J].Antiviral Res,1997,33(2):87-97.
[12]Steinberg S F.Structural basis of protein kinase C isoform function[J].Physiol Rev,2008,88(4):1341-1378.
[13]Zugaza J L,Sinnett-Smith J,Van Lint J,et al.Protein kinase D (PKD)activation in intact cells through a protein kinase C-dependent signal transduction pathway[J].EMBO J,1996,15(22):6220-6230.
[14]Matthews S A,Dayalu R,Thompson L J,et al.Regulation of protein kinase Cnu by the B-cell antigen receptor[J].J Biol Chem,2003,278(11):9086-9091.
[15]Matthews S A,Liu P,Spitaler M,et al.Essential role for protein kinase D family kinases in the regulation of class II histone deacetylases in B lymphocytes[J].Mol Cell Biol,2006,26(4):1569-1577.
[16]Zhu Y,Ding F,Juventus A J,et al.PKD3is required for prostratin-activated HIV-1transcription,in IT in Medicine and Education (ITME)[C]∥IT in Medicine and Education (ITME),2011International Symposium on[S.l.]:IEEE,2011:606-610.
[17]Chen R,Liu M,Li H,et al.PP2Band PP1alpha cooperatively disrupt 7SK snRNP to release P-TEFb for transcription in response to Ca2+signaling[J].Genes Dev,2008,22(10):1356-1368.
[18]Yang Z,Zhu Q,Luo K,et al.The 7SK small nuclear RNA inhibits the CDK9/cyclin T1kinase to control transcription[J].Nature,2001,414(6861):317-322.
[19]Way K J,Chou E,King G L.Identification of PKC-isoformspecific biological actions using pharmacological approaches[J].Trends Pharmacol Sci,2000,21(5):181-187.
[20]Reuse S,Calao M,Kabeya K,et al.Synergistic activation of HIV-1expression by deacetylase inhibitors and prostratin:implications for treatment of latent infection[J].PLoS One,2009,4(6):e6093.
[21]Burnett J C,Lim K I,Calafi A,et al.Combinatorial latency reactivation for HIV-1subtypes and variants[J].J Virol,2010,84(12):5958-5974.
[22]Ruelas D S,Greene W C.An integrated overview of HIV-1latency[J].Cell,2013,155(3):519-529.
[23]Han Y,Lassen K,Monie D,et al.Resting CD4+T cells from human immunodeficiency virus type 1(HIV-1)-infected individuals carry integrated HIV-1genomes within actively transcribed host genes[J].J Virol,2004,78(12):6122-6133.
[24]Jordan A,Bisgrove D,Verdin E.HIV reproducibly establishes a latent infection after acute infection of T cells in vitro[J].EMBO J,2003,22(8):1868-1877.
[25]Chun T W,Finzi D,Margolick J,et al.In vivo fate of HIV-1-infected T cells:quantitative analysis of the transition to stable latency[J].Nat Med,1995,1(12):1284-1290.
[26]Chun T W,Carruth L,Finzi D,et al.Quantification of latent tissue reservoirs and total body viral load in HIV-1 infection[J].Nature,1997,387(6629):183-188.
[27]Zhu Y,Pe′ery T,Peng J,et al.Transcription elongation factor P-TEFb is required for HIV-1tat transactivation in vitro[J].Genes Dev,1997,11(20):2622-2632.
[28]Mancebo H S,Lee G,Flygare J,et al.P-TEFb kinase is required for HIV Tat transcriptional activation in vivo and in vitro[J].Genes Dev,1997,11(20):2633-2644.
[29]Zhou Q,Chen D,Pierstorff E,et al.Transcription elongation factor P-TEFb mediates Tat activation of HIV-1 transcription at multiple stages[J].EMBO J,1998,17(13):3681-3691.
