抗炎合剂治疗脓毒症患者应激性高血糖临床观察*
2014-11-30卜建宏李越华闫国良何文姬
卜建宏 李越华△ 闫国良 何文姬
(1.上海市中医医院,上海 200071;2.上海市普陀区人民医院,上海 200069)
应激性高血糖是脓毒症患者预后不良的一个独立危险因素。应激性高血糖水平与危重病情呈正相关,随着血糖的升高,感染性并发症的风险显著增加,机械通气时间、院内感染的发生率、入住监护病房的时间及病死率均上升。笔者既往研究发现抗炎合剂对治疗脓毒症有效,本研究应用抗炎合剂加味治疗脓毒症应激性高血糖取得了较好的疗效。现报告如下。
1 资料与方法
1.1 病例选择 西医诊断标准参照中华医学会急诊医学分会危重病专家委员会及中国中西医结合学会急救医学专业委员会2007年标准[1]。中医证候标准亦参照2007年草案中毒热内盛证候并结合临床实践,拟主症为高热、神昏、脉数;次症为疼痛、腹胀、纳呆等。入选患者必须满足上述3项主症,可兼有次要证候,经2名高年资主治职称及以上中医师同时判定符合者。排除标准:(1)既往有糖尿病史;(2)入院后查糖化血红蛋白高于6.5%;(3)年龄小于18周岁或大于80周岁;(4)血流动力学极度不稳定不宜行鼻饲及口服药物治疗患者;(5)不符合热毒内盛证者。
1.2 临床资料 选择笔者所在医院ICU及急诊科2011年7月至2013年6月符合脓毒症并应激性高血糖诊断标准以及符合热毒内盛者74例,将患者按随机数字表法分为治疗组39例和对照组35例。治疗组男性21例,女性18例;年龄(61.38±8.43)岁;APACHEⅡ评分(19.25±3.56)分,空腹血糖(14.73±3.86) mmol/L。对照组男性17例,女性25例;年龄(60.91±9.18)岁;APACHEⅡ评分(18.44±4.89)分,空腹血糖(14.16±4.12)mmol/L。两组患者临床资料差异无统计意义(P>0.05)。
1.3 治疗方法 两组基础治疗均给予脓毒症常规集束化治疗及积极抗感染治疗,并配合肠内营养或混合营养。控制血糖方法:两组患者均将100 U胰岛素溶入0.9%氯化钠注射液100 mL中,使用微量泵持续以4~6 U/h速度泵入,每2~4 h测定血糖1次,对照组血糖严格控制在4.6~6.0 mmol/L范围,治疗组血糖控制在6.0~9.0 mmol/L 范围,在血糖<8.0 mmol/L,可改用间断皮下注射方式控制血糖。同时治疗组加用抗炎合剂(由上海市中医医院制剂室提供),药物组成:生大黄、黄连、黄芩、厚朴、败酱草。上方浓煎取汁液100 mL,分2次口服或鼻饲,并观察两组疗效。
1.4 观察指标 两组患者均于入组当天及第8日分别测定肿瘤坏死因子(TNF-α)、C 反应蛋白(CRP)、空腹血糖、空腹C肽并计算胰岛素敏感指数,同时测定APACHEⅡ评分及中医证候评分,统计低血糖发生率,随访28 d死亡率。中医证候评分及疗效判定方法:治疗前后根据消失、轻、中、重度,主症证候分别计为0、2、4、6 分, 次症证候分别记为 0、1、2、3 分。证候疗效率=(治疗前的证候积分-治疗后的证候积分)/治疗前的中医证候积分×100%。
1.5 疗效标准 参照《中药新药临床研究指导原则》[2]。临床控制:治疗后证候疗效率≥95%。显效:治疗后证候疗效率≥70%且<95%。有效:治疗后证候疗效率为≥30%且<70%。无效:治疗后证候疗效率<30%。
1.6 统计学处理 应用SPSS17.0统计软件。计量资料以()表示,并对数据采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组临床综合疗效比较 见表1。结果示经过7 d治疗后,治疗组中医证候总有效率优于对照组 (P<0.05)。
2.2 两组治疗后空腹血糖、空腹胰岛素、胰岛素敏感指数、低血糖发生率及随访28 d死亡率比较 见表2。结果示治疗后治疗组空腹血糖高于对照组 (P<0.05),但低血糖的发生率却显著低于对照组(P<0.01);胰岛素敏感性改善治疗组优于对照组(P<0.05),两组28 d病死率相当。
2.3 两组治疗前后炎症因子水平比较 见表3。结果示经治疗后,治疗组TNF-α、CRP水平均低于对照组(P<0.01)。
表2 两组脓毒症患者治疗后相关指标比较()
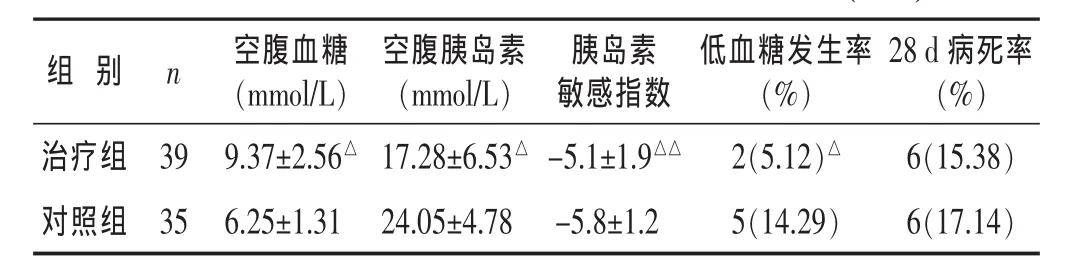
表2 两组脓毒症患者治疗后相关指标比较()
表3 两组脓毒症患者治疗前后炎症因子水平比较(mg/L,)
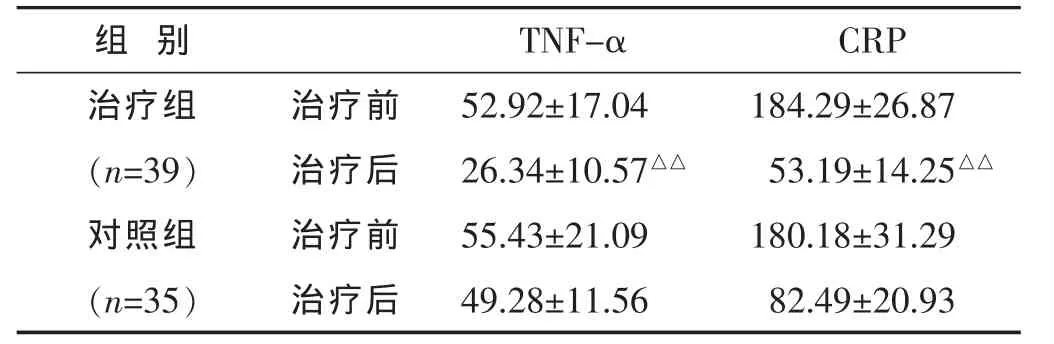
表3 两组脓毒症患者治疗前后炎症因子水平比较(mg/L,)
3 讨 论
脓毒症并发应激性高血糖是脓毒症的常见并发症之一,其产生的机制主要与脓毒症炎症因子瀑布样释放相关。脓毒症大量炎症因子的产生,影响了胰岛素受体或造成胰岛素受体信号转导通路缺陷相关,造成脓毒症胰岛素抵抗;炎症因子还可以促使肾上腺皮质激素、胰高血糖素等升血糖激素的分泌,引起高分解代谢状态,并造成了代谢紊乱,这两种因素均可导致应激性高血糖。而高血糖又可加剧患者炎症反应程度,加重感染程度和增加脏器功能衰竭的发生,同时高血糖还可刺激血管内皮细胞,内皮细胞过度活化可导致微血管收缩,血流淤滞,加重组织缺氧和脏器功能受损[3]。TNF-α在脓毒症炎症因子瀑布样释放中起关键作用,同时TNF-α在脓毒症的胰岛素抵抗中亦起到重要作用:TNF-α可通过增加胰岛素受体丝氨酸或苏氨酸磷酸化而降低其酪氨酸磷酸化,使其不能与胰岛素受体正常结合,从而抑制胰岛素受体的激酶活性[4],诱导了胰岛素抵抗。TNF-α还可刺激脂肪分解释放脂肪酸[5-6],使血糖升高。CRP浓度升高,亦抑制胰岛素受体—络氨酸激酶活性而加重胰岛素抵抗(IR)[7]。在脓毒症应激性血糖升高患者中,炎症因子大量释放可导致血糖升高,而应激性高血糖亦可刺激血中炎症细胞因子分泌增加,两者互为因果,形成脓毒症恶性循环。本次研究发现通过积极干预脓毒症炎症因子释放水平,可显著改善脓毒症IR,从而对脓毒症预后产生较好影响。
目前对脓毒症血糖控制水平存在争议,既往认为采用胰岛素强化疗法严格控制血糖有利于脓毒症患者的治疗[7],但最近发现强化胰岛素治疗,发生低血糖等不良反应增多,同时对患者中长期生存率无明显益处[9-10]。但在对脓毒症应激性高血糖治疗中发现,胰岛素可抑制NF-κB的调节途径,从而减少TNF-α等多种炎性因子的浓度及炎性反应水平。胰岛素还可通过促进内皮型一氧化氮合酶(eNOS)的合成分泌,抑制过多的诱生型一氧化氮合酶(iNOS)的产生,从而保护患者内皮细胞功能,对预防多脏器功能衰竭的发生有一定的作用[11]。因此,对脓毒症应激性高血糖控制水平,还可能需要进一步探索。本研究发现,应用强化胰岛素治疗,确可在一定程度降低炎症因子水平,但显著增加了低血糖发生率。而28 d生存率,强化胰岛素治疗组似乎有不利影响。而试验组配合中药抗炎合剂,控制血糖在6.0~9.0 mmol/L范围,不但明显减少低血糖发生率,同时更显著减少了脓毒症应激性高血糖炎症因子分泌及胰岛素抵抗,对长期生存率也有较好的益处。
脓毒症属于中医学“外感热病”范畴[12],早期以实证为主,重要证候为热毒炽盛,从而可耗伤脏气,致气滞血瘀,瘀毒互结,腑气不通,最终可导致阴阳离绝。抗炎合剂组方为大黄、黄连、黄芩、厚朴、败酱草,三黄合用可清上中下三焦热毒,大黄并有通腑泻下之功,配合厚朴,败酱草,共奏行气清热解毒之效。现代药理研究也证实,以大黄为主的类方可降低炎性介质CRP含量,并能有效抑制TNF-α、IL-6等促炎因子的致炎作用,从而减轻脓毒症时过度分泌,有利于免疫平衡的恢复[13],黄芩、黄连、厚朴、败酱草主要成分亦均有抗菌消炎作用[14-15]。
本研究表明,自制制剂抗炎合剂配合胰岛素非强化治疗脓毒症应激性血糖升高,能更好地抑制炎症细胞因子地分泌,增加外周组织对胰岛素的敏感性,改善了胰岛素抵抗,在胰岛素适度控制应激性高血糖条件下,打破炎症因子分泌与血糖升高这一恶性循环,并减少了低血糖不良事件的发生率,从而可改善脓毒症患者的预后。
[1]中华医学会急诊医学分会危重病专家委员会,中国中西医结合学会急救医学专业委员会.脓毒症的定义、诊断标准、中医证候诊断要点及说明(草案)[J].中华急诊医学杂志,2007,16(8):797-799.
[2]中华人民共和国卫生部.中药新药临床研究指导原则 (试行)[M].北京:中国医药科技出版社,2002:78-81.
[3]Krinsley JS.Effect of intensive glucose management protocol on the mortality of critically ill adult patients[J].Mayo Clinproc,2004,79(8):992-1000.
[4]Fontana L,Eagon JC,Trujillo ME,et al.Visceral fat adipokine secretion is associated with syste ic inflammation in obese humans[J].Diabetes,2007,56(4):1010-1013.
[5]Tilg H,Moschen AR.Inflammatory mechanisms in the regulation of insulin resistance[J].Mol Med,2008,14(3-4):222-231.
[6]Jager J,Grémeaux T,Cormont M,et al.Interleukin-1beta-induced insulin resistance in adipocytes through down-regulation of insulin receptor substrate-1 expression[J].Endocrinology,2007,148(1):241-251.
[7]Jia I,Denaraj S.Inflammation and atheroseclerosis:the value of the high-sensitivity C-reactive protein assay as a risk marker[J].Am J Clin Pathol,2001,116(Suppl)S:S108-115.
[8]Van den Berghe G,Wilmer A,Hermans G,et al.Intensive insulin therapy in the medical ICU[J].N Engl J Med,2006,354(4):449-461.
[9]Griesdale DE,de Souza RJ,van Dam RM,et al.Intensive insulin therapy and mortality among critically ill patients:a meta-analysis including NICE-SUGAR study data[J].CMAJ,2009,180(12):821-827.
[10]Marik PE,Preiser JC.Toward understanding tight glycemic control in the ICU: a systematic review and metaanalysis[J].Chest,2010,137(16):544-551.
[11]Viardot A,Grey ST,Mackay F,et al.Potential anti-inflammatory role of insulin via the preferential polarization of effector T cells toward a T helper 2 phenotype[J].Endocrinology,2007,148(1):346-353.
[12]杜立建,张伟.脓毒症的中医药研究进展[J].四川中医,2013,31(4):148-152.
[13]万幸,刘倩娴,王培训.大承气汤对全身性炎症反应干预作用的实验研究[J].广州中医药大学学报,2003,20(2):153-156.
[14]李彩虹,周克元.黄连活性成分的作用及机制研究[J].时珍国医国药,2010,21(2):466-468
[15]杨庆春,张文忠,肖海,等.白花败酱提取物的耐缺氧作用[J].中国临床康复,2006,10(19):177-178.
