CDX2基因修饰的脐带间充质干细胞向杯状细胞分化的可行性研究
2014-11-29李毅李欣孙涛
李毅,李欣,孙涛
1.第二军医大学 海军临床医学院;2.海军总医院 消化内科;北京 100048
溃疡性结肠炎是一种发病机制涉及遗传易感性、环境因素、免疫异常、肠道菌群改变等多方面的肠道慢性非特异性炎症,其确切病因尚未完全阐明,并且治疗上也仍有局限性。溃疡性结肠炎患者在病理上表现为结肠杯状细胞数量减少、肠隐窝破坏、病变部位黏膜粘液层变薄、肠道菌群发生改变[1-2]。这使得肠道内细菌更易直接损伤肠黏膜,肠道抗原更易造成黏膜免疫炎症反应。通过增加杯状细胞数目、增强杯状细胞分泌粘蛋白能力,有利于肠道黏膜屏障恢复及肠道保护。尾型同源盒2(caudal type homeobox 2,CDX2)基因是肠道上皮特异性基因,同时也是胚胎发育过程中促进限制内胚层向后肠发育的关键基因[3]。CDX2 还能特异性结合肠道黏液蛋白(mucin-2,MUC2)基因的启动子,促进MUC2 的表达。另一方面,脐带间充质干细胞(umbilical cord mesenchymal stem cells,UC-MSC)除具有多向分化能力外,已证明其可通过归巢效应到达肠道炎症部位。所以利用CDX2修饰UC-MSC,使之向杯状细胞分化或大量表达MUC2,对治疗溃疡性结肠炎具有现实意义。
1 材料与方法
1.1 材料
脐带组织来源于海军总医院妇产科。重组质粒CDX2-IRES-EGFP 由上海吉凯基因公司构建;TRIzol total RNA 试剂盒、无血清替代物KSR 购于Invitrogen 公司;PCR 反应试剂盒购于TaKaRa 公司;质粒大量提取试剂盒购于QIGENE 公司;DMEM 培养基及小牛血清购于Hyclone 公司;Activin A 与Wnt3a 购于PeproTech 公司;DNA 凝胶回收试剂盒购于Promega 公司;Xfect Adult Stem Cell 转染试剂购于Clontech公司。
1.2 UC-MSC的培养与鉴定
经孕妇知情同意,取剖宫产手术中足月产新生儿脐带30 cm 左右,在超净台中分离脐带血管与外膜间的胶冻样组织,将其剪成1 mm3大小,于37℃、5% CO2条件下原代培养10 d,待大量细胞从组织爬出后去除组织,用0.25%胰蛋白酶消化瓶底5 min,1000 r/min 离心5 min,将爬出细胞集中到4 个25 cm2培养瓶中继续培养,每2~3 d 换一次液,待细胞长到80%~90%融合时进行传代;取第3 代稳定增殖的UC-MSC,用胰蛋白酶消化5 min,1000 r/min 离心5 min 后用PBS 清洗2 次,细胞计数后悬浮于PBS溶液中,使细胞浓度为1.0×106/mL,分别加入鼠抗人单克隆抗体PE-CD45、PE-CD105、PE-CD73、PEHLA-DR、FITC-CD90、FITC-CD34 及PE-IgG2a、PE-IgG1K、FITC-IgG1K 同型对照抗体,常温避光孵育30 min,PBS洗涤2次后立即行流式细胞检测。
1.3 UC-MSC向内胚层方向诱导
在DMEM/F12 培养基中加入100 ng/mL 重组人Activin A、50 ng/mL Wnt3a、10% KSR、100 U/mL青霉素、100μg/mL 链霉素,配成诱导培养基,将第2代细胞按1∶2 传代后,对其中一半数量的细胞采用诱导培养基持续培养5 d,另一半细胞仍以完全培养基培养。
1.4 RT-PCR 检测Sox17 与GATA4 在UC-MSC 中的表达
针对Sox17 及GATA4 设计引物行RT-PCR。Sox17 正向引物为5'-GTGGACCGCACGGAATTTG-3',反向引物为5'-GGAGATTCACACCGGAGTCA-3';MUC2 正向引物为5'-CGACACCCCAATCTCGA TATG-3',反向引物为5'-GTTGCACAGATAGTGAC CCGT-3'。反应条件:94℃ 5 min 预变性,然后以94℃30 s、60℃30 s、72℃l min 行36个循环,72℃延伸10 min,4℃保存。反应体系包括10×PCR 缓冲液2.5μL、dNTP 混合液1μL、正反向引物各0.25μL、TaKaRa Ex Taq HS 0.25μL、cDNA 1μL、ddH2O 19.75μL。
1.5 UC-MSC的转染
将经过诱导和未经诱导的第3代UC-MSC 以2×105接种到6 孔板中,其中单转组、空转组、对照组接种未经诱导的UC-MSC,单诱组、诱转租接种经过诱导的UC-MSC,每组3 孔,每孔加入2 mL 无抗生素的DMEM 完全培养基,待细胞长到60%~70%融合时对空转组、单转组、诱转组进行转染,转染操作按照Xfect Adult Stem Cell 转染试剂盒操作说明进行,37℃孵育4 h,然后吸出所有培养基并换之以2 mL新鲜培养基。
1.6 转染后细胞的荧光显微镜观察
分别于转染后24、48 h 在荧光显微镜下观察各组转染情况,随机计数5个视野的总细胞数和具有绿色荧光的细胞数。
1.7 RT-PCR 检 测CDX2 与MUC2 在UC-MSC 中 的表达
针对CDX2 及MUC2 设计引物行RT-PCR。CDX2 正向引物为5'-GACGTGAGCATGTACCCTA GC-3',反向引物为5'-GCGTAGCCATTCCAGTCCT-3';MUC2 正向引物为5'-ATGACAACGGACGAC A CAGAA-3',反向引物为5'-TCAGCGTTTGAGTTTC CAGAG-3'。反应条件:94℃5 min 预变性,然后以94℃ 30 s、60℃ 30 s、72℃ 1 min 行36 个循环,72℃延伸10 min,4℃保存。反应体系包括10×PCR缓冲液2.5μL、dNTP 混合液1μL、正反向引物各0.25μL、TaKaRa Ex Taq HS 0.25μL、cDNA 1μL、ddH2O 19.75μL。
1.8 UC-MSC 的内胚层诱导在CDX2 促进UC-MSC表达MUC2中的作用评价
用相对增长率R表示当CDX2 增加相同倍数时MUC2的表达增长率。
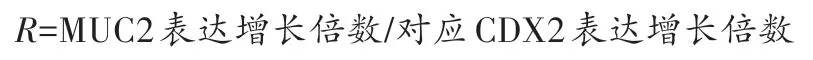
1.9 统计学分析
2 结果
2.1 UC-MSC流式细胞术检测
经流式细胞术检测,培养至第3 代的细胞CD105、CD90、CD73 均呈阳性表达,阳性率分别为97.4%、99.0%、97.8%,而HLA-DR、CD34、CD45 阳性率分别为0.7%、0.5%、0.3%(图1),所得细胞免疫表型符合间充质干细胞免疫表型特点。
2.2 内胚层细胞标志物Sox17、GATA4 的mRNA 表达
用重组人Activin A、重组人Wnt3a 诱导培养5 d,对诱导细胞行RT-PCR,结果Sox17 的mRNA 表达量升高54 倍(P<0.05),GATA4 升高27 倍,两者变化均有统计学意义(P<0.05)。凝胶电泳(图2)显示,诱导组标志基因Sox17、GATA4 的条带均比未诱导组明显。
2.3 荧光镜检转染后细胞荧光表达情况
单转组、空转组、诱转组在48 h 后均见绿色荧光蛋白表达,其中空转组荧光强度较强,可见荧光细胞较多,转染效率约70%;单转组与诱转组荧光强度较弱,转染效率分别约为30%和40%。对照组、单诱组细胞生长状态较好,荧光镜下未见绿色荧光表达。5 组细胞形态均为长梭形或不规则形,排列呈漩涡状,未见圆形杯状细胞或类杯状细胞。见图3。
2.4 RT-PCR检测CDX2与MUC2的mRNA表达
瞬时转染后48 h,对5 组细胞行RT-PCR,结果如图4,与对照组相比,单转组UC-MSC 表达CDX2水平升高113.3 倍,MUC2 表达升高30.2 倍;诱转组UC-MSC 表达CDX2 水平升高196.7 倍,MUC2表达升高98.8 倍,空转组、单诱组CDX2 与MUC2 无显著改变。凝胶电泳(图5)提示诱转组条带最清晰,其次是单转组、空转组与单诱组,对照组未见明显条带。
2.5 单转组与诱转组MUC2增长情况比较
单转组MUC2 相对增长率R=26.7%,诱转组MUC2 相对增长率R=50.2%。经两独立样本t检验,MUC2相对于CDX2的增长率,诱转组显著高于单转组(P<0.05)。说明在CDX2 增长倍数相同的情况下,经过诱导的UC-MSC 表达的MUC2 量更多,且具有统计学意义。

图1 UC-MSC的流式细胞检测结果
3 讨论
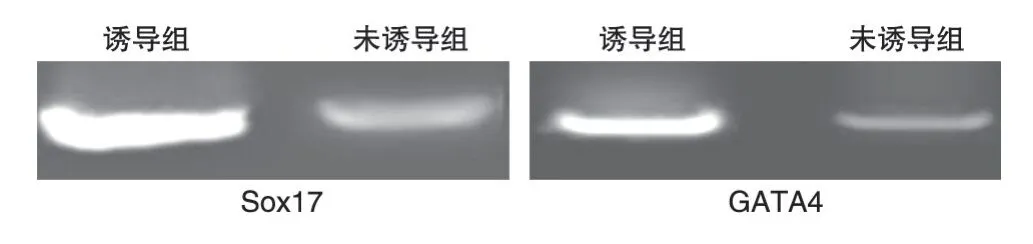
图2 Sox17与GATA4的PCR产物凝胶电泳
CDX2是一种在肠道黏膜特异性表达的基因,它也是胚胎发育过程中促进内胚层向后肠发育的关键基因,在胚胎发育过程中多种途径促进内胚层向后肠分化最终都集中到对CDX2 的控制[3-4]。从胚胎发育的第8周开始,胎儿的胃肠道即可检测出CDX2表达,在人体正常上皮细胞中,CDX2 可表达于内胚层来源的肠道上皮及胰腺导管和腺泡上皮,但CDX2在食管和正常胃黏膜上皮中不表达。除消化系统外,其他各系统正常上皮内也检测不到CDX2[5]。CDX2 在肺、食管、胃激活后组织会向肠上皮组织化生[6]。CDX2 修饰的食管上皮细胞还可以表达肠道粘蛋白MUC2,这也是Barrett 食管中能见到杯状细胞的原因。其主要机制可能是:①CDX2通过促进无调同源物-1(atonal homolog-1,ATOH1)表达上升促进MUC2 的表达[7];②CDX2 直接与MUC2 的启动子相互作用,启动MUC2 表达[8]。由于CDX2 是肠道上皮细胞分化关键基因,同时又有直接激活粘蛋白MUC2 的作用,所以我们选择CDX2 作为UC-MSC 的修饰基因。本实验中UC-MSC 在诱导培养5 d 后,RT-PCR 结果显示Sox17 表达升高54 倍,GATA4 表达升高27 倍。说明诱导培养促进了UC-MSC 向内胚层细胞的分化。实验中,单转组、诱转组、空转组均进行了转染,荧光显微镜下均能看到荧光蛋白表达,但单转组与诱转组荧光较弱,空转组荧光较强。其原因可能是:①UC-MSC 对转染试剂的敏感性低,转染效率受到限制;②由于转染试剂毒性影响了细胞活力,对质粒蛋白表达有较大影响;③诱转组与单转组实质上是CDX2与绿色荧光蛋白(EGFP)通过内部核糖体进入位点(IRES)实现的双基因共表达,在总体转染效率受限的情况下,IRES 片段下游的EGFP表达效率还会下降60%以上,进一步减弱了视野下荧光蛋白的荧光量。RT-PCR 结果显示,单纯转染组CDX2 表达量上升了113 倍,MUC2 上升了30倍,这进一步说明CDX2 对杯状细胞标志蛋白即粘蛋白MUC2 表达的直接促进作用,同时证明了经CDX2 修饰的UC-MSC 有向成熟杯状细胞分化的可能性,而且在细胞治疗领域,经CDX2 修饰的UCMSC 可作为修复UC 患者黏液层的可选细胞。另一方面,单诱组CDX2 与MUC2 表达无明显改变,说明Activin A 与Wnt3a 诱导培养对内源性CDX2 与MUC2 的增加无影响,CDX2 的表达是MUC2 表达的必需因素。诱转组CDX2 与MUC2 表达分别升高了197 与99 倍,说明可能经过Wnt3a 与Activin A 诱导后,UC-MSC 对转染的敏感性提高,CDX2 表达随之上升。值得注意的是,MUC2随CDX2上升的过程并非等比例,经诱导处理的UC-MSC 的MUC2 相对增长率显著高于单纯转染CDX2 的UC-MSC。这说明在过表达CDX2 的前提下,对UC-MSC 的诱导培养也是促进MUC2 上升的因素,也就是说,对UC-MSC向内胚层细胞的诱导有利于MUC2 的表达。其机制可能是MUC2 的表达除受CDX2 的直接调控外还受其他基因控制,而把UC-MSC 向内胚层诱导后,能促进MUC2 表达的其他调控基因表达也增强,从而进一步增加MUC2 的表达。本实验虽然增加了UCMSC 表达杯状细胞标志物MUC2,但并未观察到典型的杯状细胞形态,转染48 h 的细胞仍以长梭形或多边形为主,考虑原因主要是:①虽然经过诱导及基因修饰,MUC2 的表达显著上升,但由于MUC2 基础水平较低,所以仍达不到杯状细胞产生所需的MUC2量;②实验仅对MUC2的变化在mRNA 水平进行探讨,缺少蛋白水平,所以并不能证明MUC2 蛋白的产生确实升高。因此,要想得到典型的杯状细胞,还须优化实验条件。本实验结果说明,在UC-MSC中过表达CDX2 能够增加杯状细胞标志物粘蛋白MUC2 的表达,而事先诱导UC-MSC 向内胚层细胞分化,能进一步增加MUC2 的表达,但要得到典型杯状细胞或更大量的MUC2还须优化实验条件。
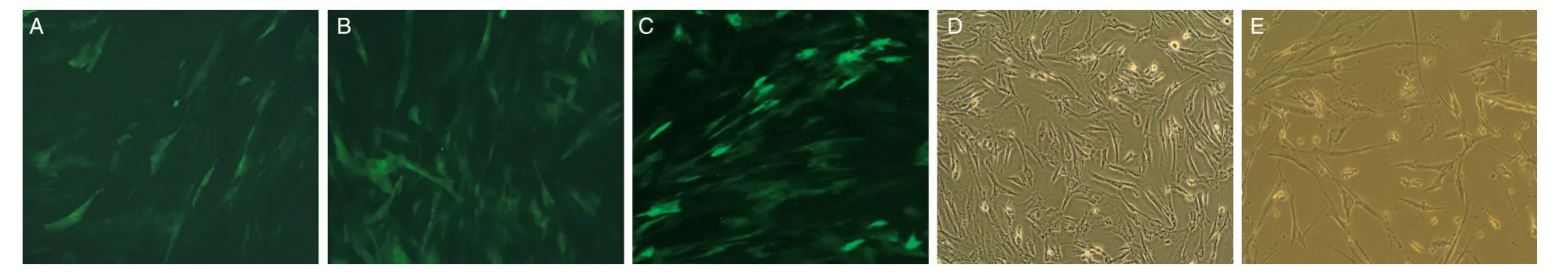
图3 荧光镜检转染后细胞荧光表达情况(100×)

图4 各组细胞CDX2与MUC2的mRNA表达情况

图5 CDX2与MUC2的PCR产物凝胶电泳
[1]Coskun M,Troelsen J T,Nielsen O H.The role of CDX2 in intestinal homeostasis and inflammation[J].Biochim Biophys Acta,2011,1812(3):283-289.
[2]Gersemann M,Becker S,Kubler I,et al.Differences in goblet cell differentiation between Crohn's disease and ulcerative colitis[J].Differentiation,2009,77(1):84-94.
[3]Zorn A M,Wells J M.Vertebrate endoderm development and organ formation[J].Annu Rev Cell Dev Biol,2009,25:221-251.
[4]Gao N,White P,Kaestner K H.Establishment of intestinal identity and epithelial-mesenchymal signaling by Cdx2[J].Dev Cell,2009,16(4):588-599.
[5]Werling R W,Yaziji H,Bacchi C E,et al.CDX2,a highly sensitive and specific marker of adenocarcinomas of intestinal origin:an immunohistochemical survey of 476 primary and metastatic carcinomas[J].Am J Surg Pathol,2003,27(3):303-310.
[6]Grapin-Botton A.Antero-posterior patterning of the vertebrate digestive tract:40 years after Nicole Le Douarin's PhD thesis[J].Int J Dev Biol,2005,49(2-3):335-347.
[7]Noah T K,Donahue B,Shroyer N F.Intestinal development and differentiation[J].Exp Cell Res,2011,317(19):2702-2710.
[8]Yamamoto H,Bai Y Q,Yuasa Y.Homeodomain protein CDX2 regulates goblet-specific MUC2 gene expression[J].Biochem Biophys Res Commun,2003,300(4):813-818.
