N-乙酰半胱氨酸减轻香烟烟雾提取物所致的A549细胞损伤
2014-11-27张强弩焦宗宪常嘉琛
张强弩,焦宗宪,常嘉琛
(兰州大学 基础医学院 病理学研究所, 甘肃 兰州 730000)
研究论文
N-乙酰半胱氨酸减轻香烟烟雾提取物所致的A549细胞损伤
张强弩,焦宗宪*,常嘉琛
(兰州大学 基础医学院 病理学研究所, 甘肃 兰州 730000)
目的研究N-乙酰半胱氨酸(NAC)对香烟烟雾提取物(CSE)暴露后的A549细胞的影响。方法MTT法测定不同处理后A549细胞的存活率;用PI单染和AnnexinV-FITC/PI双染检测细胞的周期变化和凋亡变化;用荧光探针H2DCFDA检测细胞内活性氧簇(ROS)变化;用实时荧光定量PCR和Western blot 技术检测胰岛素样生长因子结合蛋白-3(IGFBP-3)的表达变化。结果CSE致A549细胞存活的A值为0.55±0.04,显著低于对照组的0.78±0.03(Plt;0.05),NAC处理使A值显著上升至0.67±0.04(Plt;0.05),并消除了G1期阻滞,降低细胞凋亡率等。IGFBP-3的表达在CSE刺激后,有所升高,在接受NAC保护后,其表达水平有所降低(Plt;0.05)。结论NAC可以抑制香烟烟雾提取物造成的A549细胞损伤,IGFBP-3可能在香烟烟雾提取导致细胞损伤的机制中发挥作用。
IGFBP-3;香烟烟雾提取物;肺泡上皮细胞;N-乙酰半胱氨酸
香烟烟雾可以引发氧化应激,对肺泡上皮细胞造成损伤[1],此过程涉及细胞增殖障碍但其具体机制尚未清楚[2]。胰岛素样生长因子结合蛋白(insulin-like growth factor binding protein,IGFBP)与细胞的增殖密切相关[3]。高氧暴露后,IGFBP的表达发生变化[4]。氧化应激造成细胞损伤的机制也可能与IGFBP有关。IGFBP-3是IGFBP家族的重要的成员,故本研究用香烟烟雾提取物(cigarette smoke extract,CSE)对A549细胞进行刺激,然后分析IGFBP-3表达水平的变化,以期找到两者的联系。N-乙酰半胱氨酸(N-acetyl cysteine,NAC)是一种效果明确的抗氧化剂[5]。但具体来讲,NAC是否可以从细胞周期阻滞,降细胞凋亡等方面,改善CSE导致的肺泡上皮细胞细胞损伤,还有待验证。因此本研究假设NAC可以从多角度对抗CSE来源的氧化应激对细胞造成的损伤,同时会影响IGFBP-3在损伤中的表达水平。
1 材料与方法
1.1 主要实验材料
A549细胞系(中国科学院上海生命科学研究所)。DMEM培养基和胎牛血清(赛默飞世尔生物化学制品有限公司)MTT试剂,Annexin V-FITC 凋亡检测试剂盒和DCFH-DA荧光探针(Sigma公司)RIPA裂解液和BCA蛋白定量分析盒(北京普利莱生物技术公司),小鼠抗人IGFBP-3多克隆抗体和小鼠抗人ACTB多克隆抗体(Abcam公司)RNAiso Plus Kit,PrimeScript® RTreagent Kit和SYBR® Premix EX TaqⅡ[宝生物工程(大连)有限公司)]。Dy-Light 800 红外二抗(KPL实验技术公司)
1.2 细胞培养及分组
使用含10%胎牛血清的DMEM培养基,将A549细胞置于37 ℃,含5% CO2的细胞培养箱中培养。细胞消化采用含0.02% EDTA的0.25%胰蛋白酶。选取对数期细胞进行实验。细胞分为对照组,单纯CSE处理组和CSE+NAC处理组,详细分组如下所述,每组设5个平行样本。
1.3 香烟烟雾提取物的制备
使用本研究组自行开发设计的CSE系统制备CSE,将3支香烟产生的主流烟雾溶于20 mL无血清DMEM培养基中,保证充分吸收。调整此溶液的pH至7.5,使用0.22 μm孔径的滤器过滤除菌。设定此溶液为浓度100% CSE,在随后实验中用DMEM培养基稀释使用,保证该CSE在制备30 min内使用。
1.4 MTT法分析细胞存活率
制备细胞悬液,以1.5×105/mL接种入96孔板,每孔150 μL。于37 ℃,含5% CO2的细胞培养箱中培养,细胞贴壁后,无血清DMEM处理16 h。随后细胞分为9组,1组为对照组,不做药物处理。其中4组直接暴露于:5%、10%、20%和30% CSE。另外4组加入1 mmol/L NAC后再暴露于上述浓度的CSE中。每组设5个平行孔,另外设调零孔。加入MTT后用Biotek elx800酶标仪,测定各孔在490 nm处的吸光度。
1.5 细胞周期分析
根据MTT分析的结果,选用20% CSE做后续研究较为适宜。将A549细胞以2×106个/孔种植于6孔板,培养24 h,待细胞贴壁后,将细胞分为3组:对照组,20% CSE处理组,20% CSE+1 mmol/L NAC组。继续培养24 h后,收集细胞。使用预冷的冰PBS洗涤细胞,然后使用70%预冷乙醇,4 ℃固定12 h。接着,使用PBS再次洗涤细胞,加入50 mg/L碘化丙啶(PI)500 μL,4 ℃避光染色30 min。随后,使用流式细胞仪(BD FASCCalibur system)分析细胞周期。
1.6 细胞凋亡
细胞的分组处理同上。处理完成后收集细胞,使用预冷冰PBS洗涤细胞,离心后使用Annexin V-FITC凋亡检测试剂盒中提供的重悬缓冲液500 μL重悬浮细胞。依次加入5 μL Annexin V以及10 μL PI,常温避光静置10 min后,使用流式细胞仪分析细胞凋亡率。
1.7 细胞内ROS水平的测定
细胞的处理和分组方法同上,收集处理后的细胞,使用无血清DMEM洗涤细胞,接着加入10 μmol/L DCFH-DA探针,在37 ℃孵育30 min。使用荧光分光光度计(RT-970)检测细胞内荧光水平。激发波长设为485 nm,发射波长设为533 nm。
1.8 实时荧光定量PCR 检测IGFBP-3 的mRNA水平变化
细胞分组处理同上,处理后使用RNA iso裂解试剂提取每孔细胞的RNA。使用核酸蛋白仪验证提取产物的浓度和纯度。反转录体系为:5×PrimeScript 缓冲液2.0 μL,PrimeScript Enzyme Mix Ⅰ 0.5 μL,Oligo引物0.5 μL,随机引物0.5 μL,RNA模板1.0 μL,无酶灭菌水5.5 μL。反应条件为:1)37 ℃ 15 min; 2)85 ℃ 5 s。使用SYBR Premix Ex Taq Ⅱ试剂盒对上述合成的cDNA进行PCR扩增。
IGFBP-3 的上游引物为:5′-CAGCCAGCGCGCT ACAAGTTGACTA-3′,ACTB下游下游引物为:5′-CT GGGACTCAGCACATTGAGGA-3′,β-actin的上游引物为:5′-TGGCACCCAGCACAATGAA-3′,下游引物为:5′-CTAAGTCATAGTCCGCCTAGAAGCA-3′。反应体系:SYBR Premix EX Taq Ⅱ 10.0 μL,上游引物和下游引物各0.8 μL,DNA模板2.0 μL,灭菌蒸馏水6.4 μL。反应步骤为:1)95 ℃ 持续30 s,循环1次; 2)95 ℃ 3 s,60 ℃ 30 s,循环40次。反应在MJ research公司的PTC-200 PCR仪中进行。使用Rotor gene 6软件查看分析反应结果,使用2-△△CT法分各样本的IGFBP-3的相对表达情况。
1.9 Western blot检测IGFBP-3的蛋白水平变化
分组处理同前, RIPA蛋白裂解液(500 μL/孔)提取蛋白,用BCA蛋白定量分析盒定量,确保每孔上样量为30 μg。使用12%的聚丙烯酰胺凝胶进行电泳,电压为120 V,时间为2 h。随后在冰浴中进行转膜,使用PVDF膜,转膜条件为恒流250 mA,时间为1.5 h。转膜结束后,使用5%脱脂奶粉室温封闭1 h。分别使用小鼠抗人IGFBP-3抗体(1∶500)与小鼠抗人β-actin抗体(1∶1 000)4 ℃孵育12 h。接着使用PBST洗涤3次,除去未结合的一抗。使用Dy-Light 800红外标记的二抗避光孵育膜2 h,随后使用PBST洗涤3次,除去多余二抗,利用Odyssey远红外呈像系统分析蛋白条带。
1.10 统计学分析

2 结果
2.1 NAC可以抵抗香烟烟雾提取物造成的细胞损伤
CSE呈剂量依赖关系对A549造成杀伤,减低细胞的存活率。加入1 mmol/L NAC后,与单纯CSE刺激相比,细胞存活率有所上升(Plt;0.05)(图1)。

*Plt;0.05 compared with group without NAC treatment 图1 CSE和NAC对A549细胞存活率的影响Fig 1 Cell viability in A549 cells after treatment with CSE and NAC
2.2 细胞周期
对照组的G1期百分比为42.35%±2.41%,G2期百分比为17.25%±0.66%(n=3).对于20%CSE处理组来说,G1期百分比为66.59%±6.95%,G2期百分比为6.19%±4.90%。同时20% CSE+NAC组的G1期百分比为53.14±9.34%,G2期百分比为12.38%±3.92%。各组间相比(Plt;0.05)(图2)。
2.3 细胞凋亡分析
对细胞进行凋亡分析发现,20% CSE处理后,细胞的总凋亡率为35.83%±2.56%(右上象限+右下象限)显著高于照组的总调亡率4.08%±1.89%(Plt;0.05,n=3)。加入NAC后,细胞总调亡率降至28.51%±2.26%(Plt;0.05)(图3)。
2.4 细胞内ROS水平分析
20% CSE组的ROS水平有所上升,加入NAC后,ROS水平下降,各组间(Plt;0.05,n=3)(图4)

图2 CSE和NAC处理后细胞周期的变化Fig 2 Cell cycle analysis by flow cytometric after CSE and NAC treatment
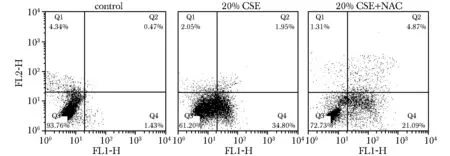
图3 CSE和NAC处理后的细胞凋亡率Fig 3 Values for cell cycle and cell apoptosis by flow cytometric analysis after CSE and NAC treatment
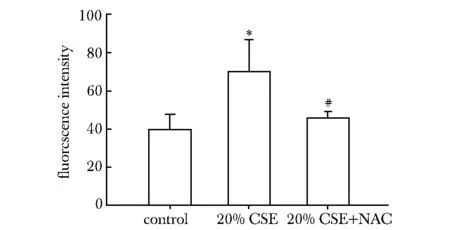
*Plt;0.05 compared with normal control group; #Plt;0.05 compared with 20% CSE group图4 CSE和NAC处理后细胞内的ROS水平Fig 4 Intracellular ROS level change after treated with CSE and NAC
2.5 IGFBP-3表达水平的变化
CSE刺激细胞后, IGFBP-3表达水平显著高于对照组(Plt;0.05),加入NAC后,IGFBP-3的表达水平有所回降但仍高于对照组(Plt;0.05)(图5,6)。

*Plt;0.05 compared with normal control group; #Plt;0.05 compared with 20% CSE group图5 CSE和NAC处理后IGFBP-3 mRNA水平的相对倍数变化Fig 5 Relative fold changes of IGFBP-3 mRNA after CSE or SFN treatment

*Plt;0.05 compared with normal control group; #Plt;0.05 compared with 20% CSE group图6 CSE和NAC处理后IGFBP-3蛋白表达水平的变化Fig 6 IGFBP-3 protein expression after treated with CSE and NAC
3 讨论
香烟烟雾损伤肺泡的机制之一就是引起氧化应激,进而阻碍细胞增殖,引发凋亡或者坏死。本研究发现,CSE可以诱导A549细胞的凋亡,造成G1期阻滞,提高细胞内的活性氧簇(reactive oxygen species,ROS),从而导致A549细胞存活率降低,出现增殖障碍。而使用NAC处理细胞后, 细胞凋亡与周期阻滞等不良后果明显得到缓解。结果提示,NAC的确可以抵抗CSE对肺泡上皮细胞的损伤,所以NAC也许可以作为治疗预防慢性阻塞性肺病(chronic obstructive pulmonary disease, COPD)的药物。但是,香烟烟雾对肺组织的损伤不仅限于对肺泡上皮细胞的杀伤,除了抗氧化,抑制凋亡,NAC是否其他方面的保护作用也值得进一步研究。比如有结果表明,香烟烟雾还可以引起肺组织的纤维化[6],NAC是否可以缓解香烟烟雾造成的纤维化,还不得而知,可在未来实验中再行研究。研究中使用CSE刺激A549细胞,发现A549出现了生长抑制和凋亡等现象,同时伴有IGFBP-3表达的增高。在使用NAC预处理细胞后,经过同样浓度的CSE处理,细胞的凋亡不再那么明显,同时也没有观察到IGFBP-3的高表达。这个结果暗示,IGFBP-3可能在CSE诱导的细胞损伤中起着促进凋亡的作用。
IGFBP-3 促进细胞凋亡的机制涉及依赖IGF-1途径以及非依赖IGF-1途径。前者认为,IGFBP-3可以与IGF-1特异性结合,这样与IGF-1受体结合的IGF-1被减少,活性被抑制,细胞由于缺少IGF-1,因而生长受限,出现凋亡[7]。后者认为IGFBP-3发挥凋亡作用还与其他一些凋亡调控因子有关。如有研究表明,IGFBP-3可以抑制NF-κB的活性,后者具有抑制凋亡的作用[8]。IGFBP-3也与MAPK通路有关[9],有研究表明,IGFBP-3可以加强TGF-β1诱导的MAPK通路成员P38的活化,从增加细胞凋亡[10]。除此之外,IGFBP-3和很多其他的凋亡调控因子相关,比如BAX,BAD等[11]。在香烟烟雾的刺激中,IGFBP-3是如何发挥作用的还有待进一步的研究。现有研究只发现香烟烟雾造成的细胞损伤伴随有IGFBP-3的表达增高,后续研究可使用siRNA干扰技术,降低IGFBP-3的表达,再使用CSE进行刺激,然后观察细胞的损伤是否有所减轻从而进一步揭示香烟烟雾引发细胞凋亡的机制。
[1] Muro S. Cigarette smoking is the most important causal factor for developing chronic obstructive pulmonary disease (COPD) [J]. Nihon rinsho Japanese journal of clinical medicine, 2011, 69:1735-1740.
[2] Wixted WE, Kitson C, Colebrook JC,etal. A model to identify novel targets involved in oxidative stress-induced apoptosis in human lung epithelial cells by RNA interference [J]. Toxicol Vitro, 2010, 24:310-318.
[3] Kalluri HSG, Dempsey RJ. IGFBP-3 inhibits the proliferation of neural progenitor cells [J]. Neurochem Res, 2011, 36:406-411.
[4] Narasaraju TA, Chen HF, Weng TT,etal. Expression profile of IGF system during lung injury and recovery in rats exposed to hyperoxia: a possible role of IGF-1 in alveolar epithelial cell proliferation and differentiation [J]. J Cell Biochem, 2006, 97:984-998.
[5] Jiao Z, Qu Z, Ge X,etal. Protective role of tretinoin and N-acetyl-L-cysteine from antiproliferative action of cigarette smoke extract on alveolar epithelial cells [J]. Pharmazie, 2007, 62:539-543.
[6] Liu Y, Gao W, Zhang D. Effects of cigarette smoke extract on A549 cells and human lung fibroblasts treated with transforming growth factor-β1 in a coculture system [J]. Clin Exp Med, 2009, 10:159-167.
[7] 孔海波, 扈玉华, 徐东刚. IGFBP-3的功能及其对凋亡相关信号通路的作用 [J]. 医学研究杂志, 2011, 40:17-22.
[8] Williams AC, Smartt H, H-Zadeh AM,etal. Insulin-like growth factor binding protein 3 (IGFBP-3) potentiates TRAIL-induced apoptosis of human colorectal carcinoma cells through inhibition of NF-kappa B [J]. Cell Death Differ, 2007, 14:137-145.
[9] O’Han MK, Baxter RC, Schedlich LJ. Effects of endogenous insulin-like growth factor binding protein-3 on cell cycle regulation in breast cancer cells [J]. Growth Factors, 2009, 27:394-408.
[10] Peters I, Tossidou I, Achenbach J,etal. IGF-binding protein-3 modulates TGF-beta/BMP-signaling in glomerular podocytes [J]. J Am Soc Nephrol, 2006, 17:1644-1656.
[11] Butt AJ, Firth SM, King MA,etal. Insulin-like growth factor-binding protein-3 modulates expression of Bax and Bcl-2 and potentiates p53-independent radiation-induced apoptosis in human breast cancer cells [J]. J Biol Chem, 2000, 275:39174-39181.
NAC relieves the A549 cells injury induced by cigarette smoke extract
ZHANG Qiang-nu, JIAO Zong-xian*,CHANG Jia-chen
(Institute of Pathology,School of Basic Medical Sciences,Lanzhou University,Lanzhou 730000,China)
ObjectiveTo study the protective role of N-acetylsteine in the A549 cell injury caused by cigarette smoke exact and the expression change of insulin-like growth factor binding protein -3 in this process.MethodsMTT assay was used to evaluate cell viability. Cell cycle and apoptotic cell proportion in each group detected respectively by PI and AnnexinV-FITC/PI double-labelled flow cytometry. Intracellular reactive oxygen species (ROS) was estimated by fluorescent indicator H2DCFDA. DAPI was used to observe the nuclear morphology. Furthermore, using real-time quantitative RT-PCR as well as western blot methods,the expression level of IGFBP-3 was detected.ResultsCompared with control group(0.78±0.03), CSE inhibit cell proliferation significantly(0.55±0.04). NAC can reduce cell injury caused by CSE including restoring the viability of A549 cells(0.67±0.04), attenuating G1block of cell cycle and significantly reducing the proportion of apoptotic cells and so on. High expression of insulin-like growth factor binding protein-3 (IGFBP-3) in A549 cells treated with CSE was found at both transcriptional and protein levels, and concomitant with the restoration of cell growth after treatment with NAC, down regulation of IGFBP-3 was observed.ConclusionsIt is concluded that NAC can antagonize CSE-induced growth arrest of alveolar epithelial cells and that down regulated IGFBP-3, which probably play an important role in this process.
IGFBP-3; cigarette smoke extract; alveolar epithelial cells; NAC
2013-01-21
2013-05-19
兰州大学中央高校基本科研业务费专项资金(lzujbky-2009-92,lzujbky-2013-223)
*通信作者(correspondingauthor):jiaozongx@lzu.edu.cn
1001-6325(2014)01-0072-06
R 365
A
