自体及健康人CIK细胞治疗临床恶性肿瘤的比较
2014-11-27董晨辉王爱民
李 壮,董晨辉,徐 祥,何 静,黄 宏,郭 韡,邢 伟,王爱民*
(第三军医大学 第三附属医院 野战外科研究所 1.关节四肢外科; 2.干细胞移植amp;细胞治疗中心;3.第一研究室 创伤、烧伤与复合伤国家重点实验室, 重庆 400042)
自体及健康人CIK细胞治疗临床恶性肿瘤的比较
李 壮1,董晨辉1,徐 祥2,何 静2,黄 宏3,郭 韡3,邢 伟3,王爱民1*
(第三军医大学 第三附属医院 野战外科研究所 1.关节四肢外科; 2.干细胞移植amp;细胞治疗中心;3.第一研究室 创伤、烧伤与复合伤国家重点实验室, 重庆 400042)
目的比较恶性肿瘤患者和健康人来源的细胞因子诱导的杀伤细胞(CIK cells)体外抗瘤效应和临床疗效。方法恶性肿瘤患者(n=12)和健康人(n=12)外周血单个核细胞(PBMC)经IFN-γ、CD3 Ab、IL-1和IL-2体外诱导获得CIK,锥虫蓝染色检测体外增殖,CCK-8检测抑瘤活性,流式细胞术检测细胞表型,PCR分析CIK在患者外周血的代谢,最后比较近期疗效。结果健康人CIK较患者CIK体外增殖快、CD3+CD56+比例高且抑瘤效应强(Plt;0.01),能在患者外周血中存在5~8 周并有效改善其免疫机能,两者近期疗效无显著差异。结论健康人CIK治疗恶性肿瘤高效可行,有着广阔的临床应用前景。
细胞因子诱导的杀伤细胞;恶性肿瘤;T淋巴细胞亚群
细胞因子诱导的杀伤细胞(cytokine-induced killer cells, CIK cells)由单个核细胞经IFN-γ、CD3 Ab、IL-1和IL-2体外诱导得到,兼有NK细胞非MHC限制性杀瘤和T淋巴细胞的高抗瘤活性,临床用于多种恶性肿瘤的治疗[1-2]。目前,CIK主要由患者外周血单个核细胞(peripheral blood mononuclear cell,PBMC)诱导获得,关于健康人CIK细胞的临床应用鲜有报道。本研究通过与恶性肿瘤患者CIK比较,以初步探讨健康人CIK的临床应用价值。
1 材料与方法
1.1 病例资料
收集第三军医大学第三附属医院2012 年4 月至2013 年4 月行CIK治疗的24 例恶性肿瘤患者,男性10 例,女性14 例,平均年龄(60.2±14.3)岁,其中肺癌8 例,肝癌、胰腺癌、肾癌、卵巢癌和宫颈癌各2例,牙龈癌、胃癌、食道癌、结肠癌、前列腺癌和骨肉瘤各1 例,KPS评分gt;60 分,预期生存gt;3 个月,临床常规治疗均结束4 周以上。根据CIK来源分为自体CIK及健康人CIK治疗组,各12 例患者,后者包括8 名接受男性亲属CIK治疗的女性患者。所有患者或其法定代理人签署知情同意书。
1.2 主要试剂
RPMI 1640培养基(Gibco公司),INF-γ(上海克隆高科公司),CD3 Ab(Ebioscience公司),IL-1(Schering Plough公司),IL-2(北京四环生物公司),荧光素标记的抗体及IgG同型对照(Beckman Coulter公司),CCK-8(南京凯基生物公司),DP1801试剂盒(北京百泰克生物公司)。人结肠癌细胞系HCT116和人肝癌细胞系HepG2由第三军医大学野战外科研究所提供。
1.3 主要方法
1.3.1 CIK细胞的体外诱导培养:培养方法参照文献[3],当14 d CIK扩增达治疗量且质检合格后离心收集细胞,以100 mL含1% 人血白蛋白的0.9%氯化钠注射液重悬后静脉输注。每疗程分3 次输注,细胞总数gt;1010个。
1.3.2 CIK细胞增殖活性及表型的分析:3、7和14 d时锥虫蓝染色计数活细胞,并取适量细胞经流式细胞术检测表型。
1.3.3 CIK细胞体外抑瘤活性测定:以健康人PBMC、患者和健康人CIK为效应细胞,HCT116和HepG2为靶细胞,效靶比为5∶1、10∶1、20∶1和40∶1,作用24 h后加入CCK-8,测量450 nm波长处A值。计算抑瘤率%=[1-(实验组A值-效应细胞A值)/靶细胞A值]×100 %。
1.3.4 患者接受CIK治疗前后T淋巴细胞亚群变化:采集患者治疗前及治疗4、8和12 周后100 μL外周血,加荧光素标记的抗体及同型对照经流式细胞仪检测,以12 例平均年龄(61.2±13.6)岁健康人作为对照。
1.3.5 常规PCR检测男性CIK输注后女性患者外周血中SRY基因变化:8 例女性患者接受男性亲属CIK细胞治疗前后采集100 μL外周血,以DP1801试剂盒提取DNA,设置正常男女对照。Y染色体性别决定基因(sex determining region on Y,SRY)引物序列(254 bp):上游:5′-CATGAACGCATTCATCGTG TGGTC-3′,下游:5′-CTGCGGGAAGCAAACTGCAA TTCTT-3′,GAPDH(532 bp)作为内参基因。反应体系含100 ng DNA,1 μL引物,反应条件:94 ℃预变性2 min,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,35个循环,72 ℃ 10 min,取10 μL产物行琼脂糖凝胶电泳。
1.3.6 临床疗效分析:参照文献[4]进行,将患者治疗60 d后KPS评分、疼痛强度和体质量变化作为主要指标,评估临床收益反应(clinical benefit response,CBR)。
1.4 统计学分析
2 结果
2.1 CIK细胞的体外增殖和表型检测
3 d起健康人CIK增殖和CD3+CD56+升高明显快于患者细胞(Plt;0.01)(表1,2)。
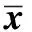
表1 CIK细胞体外增殖倍数Table 1 Proliferation of CIK cells(±s, multiples, n=12)
*Plt;0.01 compared with autologous CIK.

表2 CIK培育过程中CD3+CD56+变化Table 2 Changes of CD3+CD56+ subset during culturing of CIK cells(±s, %, n=12)
*Plt;0.01 compared with autologous CIK.
2.2 CIK细胞体外抑瘤活性检测
CIK对HCT116或HepG2的抑制活性与效靶比成正比,各个相应效靶比健康人CIK抑瘤活性均强于自体CIK,PBMC效应相对较弱(Plt;0.01)(图1)。
2.3 患者治疗前后外周血淋巴细胞亚群变化
与对照组相比,患者治疗前CD3+、CD4+和NK降低,CD8+升高,CD4+/CD8+降低,CIK代偿性升高。治疗后以上指标均有改善,健康人CIK治疗组CD3+、CD4+改善更明显,至12周左右降至治疗前水平(表3)。
2.4PCR检测异体CIK细胞治疗后SRY在外周血中的变化
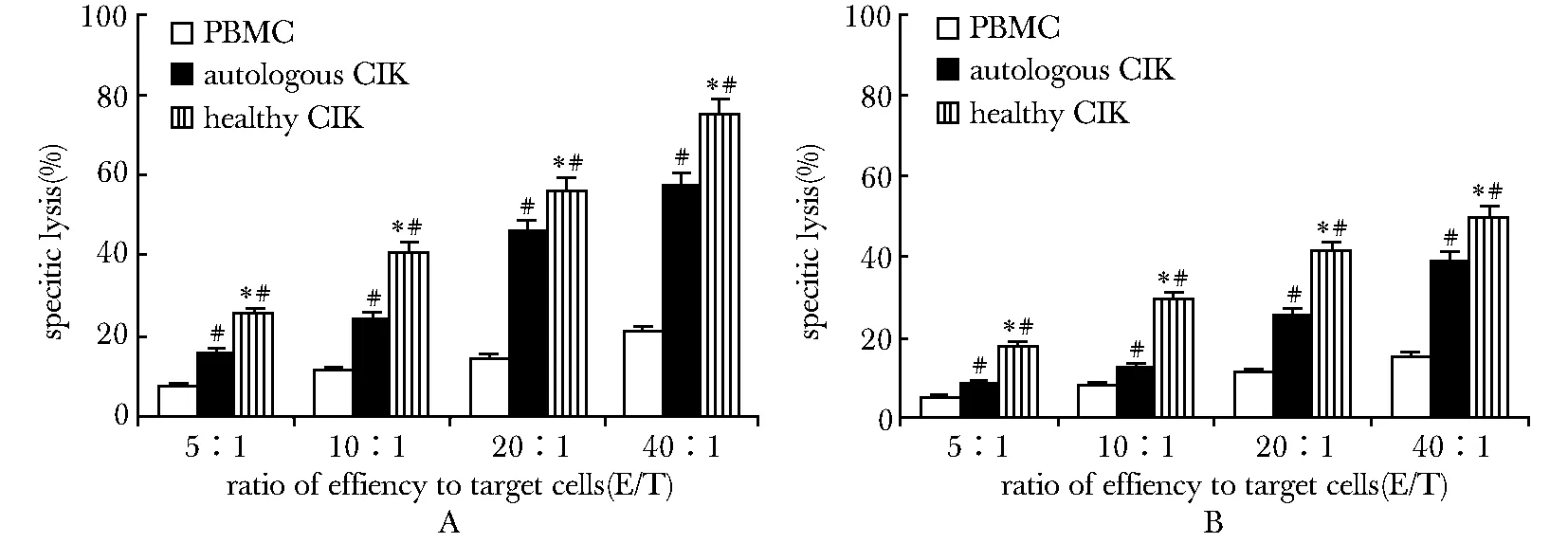
治疗前8 例患者血中均未检出SRY基因,治疗后254 bp处可见目的条带。其中在输注后5、7和8周各有1例、5例和2例可检出SRY(图2)。
*Plt;0.01 compared with autologous CIK; #Plt;0.01 compared with PBMC图1 PBMC、自体及健康人CIK对HCT116(A)和HepG2(B)抑制效应的比较Fig 1 Comparison of cytotoxicity against HCT116(A) and HepG2(B) of PBMC, autologous or healthy

表3 患者接受自体或健康人CIK细胞治疗前后外周血T淋巴细胞亚群变化Table 3 Analysis of T lymphocyte subset of patients treated with autologous or healthy CIK (±s, %, n=12)
*Plt;0.01 compared with autologous CIK;#Plt;0.01 compared with healthy control.
M.DL2000;C1.female control;C2.male control;P.before infusion;0 day~9 weeks.after infusion图2 常规PCR检测女性患者接受男性CIK治疗前后外周血中SRY基因Fig 2 Detecting SRY in peripheral blood of female patients treated with male-derived CIK by PCR
2.5 临床疗效评价及不良反应
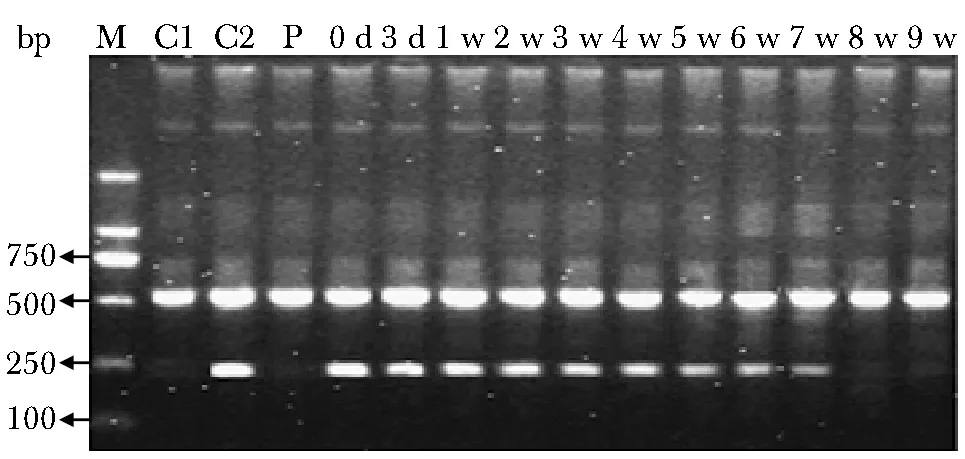
60 d时两组患者KPS评分、疼痛和体质量改善及CBR均无显著差异(表4)。3 例自体CIK治疗和5例健康人CIK治疗的患者在回输时出现低热、寒战,24 h内自行恢复正常,1例健康人CIK治疗的患者在2周后出现双侧胫前皮肤瘙痒,对症处理后缓解。所有患者无心悸、胸闷、呕吐和腹泻等不适。
表4 自体及健康人CIK细胞治疗组疗效比较Table 4 Comparison of therapeutic effect betweenautologous and healthy CIK(%,n=12)
3 讨论
手术和化放疗仍是目前临床治疗恶性肿瘤的主要方法,但手术无法彻底清除肿瘤细胞,而放化疗杀伤肿瘤细胞的同时也损伤正常细胞,进一步破坏机体免疫甚至降低生存质量。作为配合临床常规治疗的重要手段,CIK细胞具有体外扩增速度快、杀瘤活性高、杀瘤谱广和毒副作用小的特点,被认为是肿瘤过继免疫治疗的新希望[5]。但晚期恶性肿瘤患者免疫功能常有不同程度抑制,外周血白细胞数量和活性降低,抽血分离PBMC可能会加重贫血和诱发感染。此外,由于细胞状态受损及“肿瘤免疫编辑”[6],自体CIK治疗恶性实体肿瘤的有效性仅30%左右[7],因此健康人CIK细胞是否可以作为一种安全有效的治疗手段应用于临床也就成为关注的焦点[8]。
动物实验证实异体CIK细胞在受者体内可持续存在约90 d,同时保持其抗肿瘤效应而不引起明显的不良反应[9],在本研究中,相较于恶性肿瘤患者CIK,健康人CIK细胞体外增殖速度快、CD3+CD56+比例高且抑瘤效应强,输注后能有效改善患者的免疫功能,在得到与自体CIK类似疗效的同时并未明显地增加不良反应。尽管由于样本量少和观察周期短等原因,本研究中未发现健康人CIK具有更好的疗效,此外有关自体CIK细胞在患者体内的代谢还有待进一步研究,但应用健康人CIK细胞能够避免抽血等对患者的损伤,缩短患者等待治疗的时间以争取治疗时机,从而为晚期恶性肿瘤特别是伴明显免疫机能受损的患者提供了一个实施CIK治疗的新方法,有着广阔的临床应用前景。
[1] Linn YC, Niam M, Chu S. The anti-tumour activity of allogeneic cytokine-induced killer cells in patients who relapse after allogeneic transplant for haematological malignancies [J]. Bone marrow transplant, 2012, 47: 957-966.
[2] Zhang J, Zhu L, Wei J,etal. The effects of cytokine-induced killer cells for the treatment of patients with solid tumors: a clinical retrospective study [J]. J Cancer Res Clin Oncol, 2012, 138: 1057-1062.
[3] Schmidt-Wolf IG, Negrin RS, Kiem HP,etal. Use of a SCID mouse/human lymphoma model to evaluate cytokine-induced killer cells with potent antitumor cell activity [J]. J Exp Med, 1991, 7: 139-149.
[4] McKenna S, Eatock M. The medical management of pancreatic cancer: a review [J]. Oncologist, 2003, 8: 149-160.
[5] Alice P, Gianmaria B, Daniela P,etal. Dual-functional capability of CD3+CD56+CIK cells, a T-cell subset that acquires NK function and retains TCR-mediated specific cytotoxicity [J]. Blood, 2011, 12: 3301-3310.
[6] Dunn GP, Bruce AT, Ikeda H,etal. Cancer immunoediting: from immumosurveillance to tumor escape [J]. Nat Immumol, 2002, 3: 991-998.
[7] 郝一文,和予馨, 周文玲. 自体外周血单个核细胞制备CIK细胞治疗恶性实体肿瘤应用价值研究 [J]. 中国输血杂志, 2011, 24: 746-749.
[8] Linn YC, Niam M, Chu S. The anti-tumour activity of allogeneic cytokine-induced killer cells in patients who relapse after allogeneic transplant for haematological malignancies [J]. Bone Marrow Transplant, 2012, 47: 957-966.
[9] Ryosei N, Jeanette B, Andreas B,etal.Invivotrafficking and survival of cytokine-induced killer cells resulting in minimal GVHD with retention of antitumor activity [J]. Blood, 2008, 1126: 2563-2574.
Comparison of clinic application in malignant tumor immunotherapy between autologous and healthy CIK cells
LI Zhuang1, DONG Chen-hui1, XU Xiang2, HE Jing2, HUANG Hong3, GUO Wei3,XING Wei3, WANG Ai-min1*
(1.Dept. of Joint and Orthopedic Surgery; 2.Stem Cell Transplantation amp; Cell Treatment Center; 3.State Key Laboratory of Trauma, Burns and Combined Injury, Dept. of Institute of Surgery Research, the Third Affilited Hospital of Third Military Medical University, Chongqing 400042,China)
ObjectiveTo compare the clinical anti-tumor effect of cytokine-induced killer cells(CIK) derived from patients with malignancies or healthy doners.MethodsPeripheral blood mononuclear cells(PBMC) of patients(n=12) or healthy doners(n=12) were cultured in presence of IFN-γ, CD3 Ab, IL-1 and IL-2. The proliferation was counted by Trypan blue test, theinvitroanti-tumor cytotoxicity was analysed by CCK-8 assay, the phenotypes were analyzed by flow cytometry, the duration of healthy CIK was determined by PCR, the clinical effects were compared.ResultsCompared with autologous CIK, healthy CIK showed higher proliferative ability and enhancedinvitroanti-tumor cytotoxicity(Plt;0.05), and led to an efficient recovery of immunologic function of recipients. 5~8 weeks after infusion, healthy CIK was also detected in recipients’ peripheral blood. More importantly, healthy CIK showed equivalent therapeutic effect and minimal adverse reactions.ConclusionsApplication of healthy CIK cells in the treatment of malignancies is probably feasible.
cytokine-induced killer cells; malignancy; T lymphocyte subset
2013-08-09
2013-10-30
国家自然科学基金(81372027)
*通信作者(correspondingauthor): trauma2@163.com
1001-6325(2014)04-0475-05
研究论文
R 73-36; R 730.51; R 394.2
A
