抗TLR2抗体抑制小鼠金黄色葡萄球菌肺炎炎症反应①
2014-11-27温顺航李昌崇苏小燕张慧玲吴沪军
温顺航 林 立 李昌崇 苏小燕 张慧玲 吴沪军
(温州医科大学附属育英儿童医院呼吸科,温州 325000)
金黄色葡萄球菌(Staphylococcus aureus,SA)是肺炎的常见病原菌之一,常引起肺脓肿、胸腔积液等严重炎症反应并发症,但其具体机制尚不清楚。Toll样受体2(Toll-like receptor 2,TLR2)是识别SA病原相关分子模式(Pathogen-associated molecular patterns,PAMP)的最重要模式识别受体(Pattern recognition receptor,PRR),调节细胞因子、趋化因子的产生和炎症细胞招募及激活等炎症反应[1]。已有报道[2],在败血症模型中抗TLR2抗体可以阻断TLR2介导的炎症反应,但其在小鼠SA肺炎炎症反应方面的研究未见报道。本研究采用抗TLR2抗体阻断TLR2介导的炎性通路,观察其对小鼠SA肺炎炎症反应的影响。
1 材料与方法
1.1 动物及材料 60只SPF级5~7周C57BL/6J小鼠购自上海史莱克实验动物有限公司,体重16~20 g,随机分为:对照组、SA肺炎组和抗TLR2抗体组,再根据观察时间不同,各分为3 d和8 d亚组,共6小组,每组10只。抗TLR2抗体(T2.5,ab16894)及免疫组化TLR2一抗(ab24194)购自英国abcom公司;角质细胞源细胞因子(KC)、IL-10 ELISA试剂盒为PeproTech公司生产;TSA培养基、脑心浸液肉汤和无内毒素的PBS购自美国Gibco公司。
1.2 细菌及菌液制备 SA(ATCC25923)菌株来源于温州医科大学附属育英儿童医院检验科,本实验室保存。SA划线接种到TSA平板,并在37℃条件下培养过夜,挑取菌落接种到脑心浸液肉汤,37℃培养6 h以达到细菌生长曲线对数期。离心机3 500 r/min离心细菌菌液15 min,弃上清,无内毒素的PBS洗涤SA两次并重悬,用麦氏比浊仪测定SA菌液浓度,调整浓度至1×1010CFU/ml,倍比稀释后,取3个连续梯度稀释菌液10 μl划至TSA平板,37℃培养24 h后,确定菌液活菌浓度。
1.3 小鼠肺炎模型[3]小鼠滴鼻接种前1 d,抗TLR2抗体组小鼠尾静脉注射抗TLR2抗体(2 μg/只,用无菌生理盐水稀释至100 μl)[4],正常组和SA肺炎组尾静脉注射无菌生理盐水100 μl。滴鼻接种当天4%水合氯醛麻醉小鼠,将SA菌液50 μl(约含5×108CFU),接种于SA肺炎组及抗TLR2抗体组小鼠鼻尖处,而对照组为无菌PBS 50 μl滴鼻,鼠本能性吸入,保持小鼠直立放置1 min,以利于细菌迁移到肺泡。
1.4 血清获取及处理 水合氯醛快速麻醉小鼠,摘除右侧眼球,采血0.8~1 ml,离心,取上清置-70℃冻存待测。
1.5 支气管肺泡灌洗液(Bronchoalveolar lavage fluid,BALF)获取及处理 取血后,铺巾,颈部及胸部备皮,消毒,无菌条件行颈部手术分离气管进行插管,以1 ml无菌PBS分3次灌洗,其回收率可达到60%~80%。摇匀回收的BALF,取100 μl BALF倍比稀释后,分别涂布于3块TSA平板,至37℃培养箱培养24 h后,计菌落数,并革兰染色及生化鉴定。剩余BALF离心,取上清置-70℃冻存待测。100 μl生理盐水重悬管底细胞后,用血细胞计数板计数白细胞。再次离心沉渣瑞氏染色进行细胞分类。
1.6 组织病理学观察[5]实验结束时,麻醉后处死小鼠,取左肺于4%多聚甲醛溶液充分固定,常规脱水、透明、包埋,制作4 μm连续切片,苏木精-伊红(HE)染色后于显微镜下观察并评分。肺炎严重程度评分:0=无;1=轻度;2=中度;3=重度;4=极重度,肺炎范围评分:0=无;1=小范围;2=较大范围;3=广泛,将严重程度评分与范围评分相加来评价肺炎病理程度。
1.7 酶联免疫吸附测定(Enzyme-linked immunosorbent assay,ELISA) 取出冻存的BALF、血清,采用ELISA双抗体夹心法,按照试剂盒说明书进行操作,计算出标准曲线回归方程后,将样品光密度值带入标准曲线,得出KC、IL-10的含量(pg/ml)。
1.8 免疫组化 采用二步法,一抗为兔抗小鼠TLR2多克隆抗体(ab24192),稀释浓度为1∶1 000,按试剂盒说明进行操作。
1.9 统计学方法 采用SPSS 19.0统计软件包进行统计分析,计量资料,如正态分布,以表示,两组间均数比较采用t检验;多组间均数比较采用方差分析,组间两两比较,方差齐性应用LSD-t法,方差不齐采用Games-Howell法;非正态资料,采用秩和检验,计数资料采用χ2检验。P<0.05认为有显著性差异。
2 结果
2.1 生存率及体重 正常对照组小鼠均存活,SA肺炎组和抗TLR2抗体组间生存率比较无显著差异(同为P=1.0,图1A)。体重比为小鼠滴鼻接种造模后每天体重与造模当天(即第0天)体重比值,SA肺炎组和抗TLR2抗体组(3 d或8 d亚组)小鼠滴鼻接种后体重较正常组低(各天P<0.05);比较SA肺炎组与抗TLR2抗体组小鼠间体重比,各天均无明显统计学差异。见图1B。
2.2 BALF载菌量 小鼠BALF分离培养,观察菌落特点,并做革兰染色和生化鉴定,分离出非金黄色葡萄球菌,疑为操作污染,不列入统计范围。正常组、SA肺炎组及抗TLR2抗体组,第3天n分别为7、6、6,第 8 天 n 分别为 8、7、7。正常组小鼠未分离到SA,比较SA肺炎组与抗TLR2抗体组小鼠BALF载菌量,在感染后第3天,抗TLR2抗体组较SA肺炎组增高(P<0.05,图2A);在感染后第8天,3组间差异无统计学意义。
2.3 BALF白细胞计数及中性粒细胞比值 第3天,SA肺炎组小鼠BALF中白细胞计数较正常组高(P<0.01),抗 TLR2抗体组较正常组高(P<0.01),但较SA肺炎组低(P<0.05,图2B)。感染后第8天,抗TLR2抗体组分别和正常组、SA肺炎组比较,均无统计学差异(分别P=0.281和P=0.191,图2B)。中性粒细胞比值,在感染后第3天,SA肺炎组(53.14±8.57)、抗 TLR2 抗体组(38.13±9.17)与正常组(12.50±3.66)比较差异有统计学意义(P<0.01),抗TLR2抗体组较SA肺炎组低(P<0.01),感染后第8天,BALF中性粒细胞百分值SA肺炎组(20.57±4.50)较正常组(13.80±3.52)高(P<0.05),见图2C。
2.4 BALF中KC、IL-10水平 SA感染后第3天,SA肺炎组和抗TLR2抗体组小鼠BALF中KC浓度较正常组表达明显升高(P<0.01和P<0.05),但抗TLR2抗体组明显低于SA感染组(P<0.01)。SA肺炎组小鼠和抗TLR2抗体组小鼠BALF中IL-10浓度较正常组表达升高(P<0.01和P<0.01),但SA肺炎组小鼠和抗TLR2抗体组相比无统计学差异(P=0.389)。在SA感染后第8天,3组间 KC和IL-10在BALF中均无统计学差异,见表1。
2.5 血清中KC、IL-10水平 SA肺炎组和抗TLR2抗体组小鼠血清中KC浓度较正常组表达明显升高(P<0.01和P<0.01),抗TLR2抗体组低于SA感染组(P<0.05)。SA肺炎组和抗TLR2抗体组小鼠血清中IL-10浓度较正常组表达升高(P<0.01和P<0.01),但SA肺炎组小鼠血清中IL-10和抗TLR2抗体组相比无统计学差异(P=0.479)。在SA感染后第8天,3组间KC和IL-10在BALF及血清中均无统计学差异,见表2。
2.6 组织病理学 正常组小鼠气管、肺泡腔内无炎性分泌物及出血,肺泡结构完整(图3A);在第3天,SA肺炎组小鼠肺部可见支气管管腔充满炎性渗出物,肺泡正常结构消失,肺泡腔可见以嗜中性粒细胞为主的炎性细胞浸润(图3B);抗TLR2抗体组小鼠支气管管腔、肺泡腔可见出血及少量炎性细胞,肺泡壁充血增厚(图3D、E)。SA肺炎组和抗TLR2抗体组小鼠第8天仍存在炎性病理改变(分别为图3C、F),但明显轻于第3天炎性改变。肺炎的病理评分为严重度评分+扩散范围评分,在滴鼻接种后第3天和第8天,抗TLR2抗体组小鼠HE病理评分均低于SA肺炎组小鼠,差异有统计学意义(P=0.019和P=0.025)。
2.7 免疫组化 免疫组化染色示正常组小鼠TLR2阳性表达细胞主要是气管、支气管上皮细胞(图4A),感染后第3天,SA肺炎组可见TLR2阳性表达的中性粒细胞、巨噬细胞等炎症细胞出现在肺泡腔、支气管腔以及肺间质,气管、支气管上皮细胞TLR2阳性表达(图4B);抗TLR2抗体组可见肺间质少量阳性炎症细胞浸润,气管、支气管上皮阳性表达TLR2(图4C)。感染后第8天,SA肺炎组肺泡腔、支气管腔以及肺间质仍有TLR2阳性细胞(图4D);抗TLR2抗体组肺泡腔、支气管腔以及肺间质有少量TLR2阳性细胞(图4E)。

表1 抗TLR2抗体对SA肺炎小鼠BALF中KC、IL-10水平的影响Tab.1 Effects of anti-TLR2 antibody on expression KC and IL-10 of BALF in SA pneumonia mice

表2 抗TLR2抗体对SA肺炎小鼠血清中KC、IL-10水平的影响Tab.2 Effects of anti-TLR2 antibody on expression KC and IL-10 of serum in SA pneumonia mice

图1 抗TLR2抗体对SA肺炎小鼠生存率及体重比的影响Fig.1 Effects of anti-TLR2 antibody on survival rate and weight ratio in SA pneumonia mice
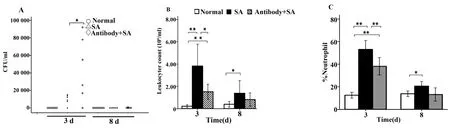
图2 抗TLR2抗体对SA肺炎小鼠肺泡灌洗液CFU计数、白细胞计数及中性粒细胞百分值的影响Fig.2 Effects of anti-TLR2 antibody on bronchoalveolar lavage fluid CFU count,leukocytes count and neutrophil percentage in SA pneumonia mice

图3 抗TLR2抗体对SA肺炎小鼠肺组织炎症反应及病理评分的影响(HE染色)Fig.3 Effects of anti-TLR2 antibody on pulmonary inflammation response and pathological scores in SA pneumonia mice(HE staining)

图4 各组小鼠肺组织TLR2免疫组化染色结果Fig.4 Expression of TLR2 in pulmonary of SA pneumonia mice,analyzed by immunohistochemical staining
3 讨论
SA能产生多种胞壁成分、毒素及侵袭性酶,包括肽聚糖、脂蛋白、溶血素、凝固酶等,肺部感染时常引起强烈的炎症反应,可致肺组织损伤,甚至出现肺脓肿及脓胸[6]。急性炎性反应表现为血管内白细胞透过血管壁进入感染部位以消灭病原体,同时释放大量炎症因子,过强炎性反应可造成周围组织损伤[7]。中性粒细胞是抵抗化脓性细菌入侵的重要免疫细胞,分泌弹性蛋白酶和活性氧是组织炎性损伤的重要因素[8]。因此,适当减少中性粒细胞浸润,可减轻炎症反应损伤,加快机体恢复。TLR2和TLR1或TLR6形成异二聚体,可识别SA的重要抗原成分脂磷壁酸和脂蛋白,激活下游的NF-κB和MAPK信号通路,启动炎症反应[9]。TLR2主要表达于单核吞噬细胞、中性粒细胞及上皮细胞等。本实验通过免疫组化证实:TLR2在中性粒细胞、气管及支气管上皮细胞高表达。Zivkovic等[5]通过滴鼻接种SA外毒素,发现野生型C57BL/6小鼠肺部有中性粒细胞浸润,细胞因子如 IL-1β、TNF-α及 KC等升高,而TLR2基因敲除小鼠(TLR2-/-)无上述炎症反应表现,说明TLR2可能在介导SA炎症反应方面起着重要作用。SA结构成分激活气管、支气管上皮细胞TLR2信号通路,招募中性粒细胞涌入肺组织,并激活中性粒细胞上的TLR2信号通路,启动炎症因子的级联效应及炎性风暴。
抗体作为药物具有特异性强、持续性久和疗效显著等特点,在抗肿瘤、器官移植、自身免疫性疾病及感染性疾病治疗中发挥重要作用[10,11],具有广阔应用前景。本研究采用抗TLR2抗体结合呼吸道上皮细胞及中性粒细胞等细胞膜上的TLR2,阻止其与SA的多种PAMP结合,从而抑制炎症反应和减轻炎性损伤。本实验观察到,在滴鼻接种3 d后,抗TLR2抗体组小鼠较SA肺炎组BALF及血清中的炎性因子KC明显降低,但对抑制性炎性因子IL-10表达无显著影响,同时肺部HE病理评分明显降低,但死亡率无明显统计学差异,提示抗TLR2抗体不能降低SA肺炎小鼠死亡率,但可明显减轻肺部的炎性反应。Meng等报道[2],抗TLR2抗体能阻止配体与细胞TLR2结合,腹腔注射抗TLR2抗体能提高枯草杆菌败血症小鼠生存率并抑制TNF-α、KC及IL-6等炎性反应。有研究报道,抗TLR2抗体能阻断博来霉素导致的肺部炎症反应及纤维化,也说明其在抑制肺部炎症反应方面有着重要作用[12]。
本实验发现,在滴鼻接种3 d后,抗TLR2抗体组小鼠较SA肺炎组BALF载菌量高,存活率及体重恢复情况无明显差异,可能与肺部招募免疫细胞较少、SA清除减慢有关,HE病理改变以肺间隔水肿、出血,支气管腔出血为主要表现,考虑与SA分泌溶血素、苯酚可溶解的调控蛋白(Phenol-soluble modulins,PSMs)及葡萄球菌蛋白 A等有关。Robertson等[13]报道:抗中性粒细胞单克隆抗体耗尽小鼠中性粒细胞,在SA肺部感染后,小鼠SA清除能力和生存率明显降低,说明中性粒细胞在SA肺部清除中起着重要作用。α-溶血素和PSMs是SA重要致病毒素,具有细胞毒性及溶血活性,攻击肺组织上皮、血管壁细胞及中性粒细胞等,可致肺部水肿及出血[3,14]。在滴鼻接种 8 d后,抗 TLR2 抗体组和 SA肺炎组小鼠BALF载菌量与正常对照组比较无统计学差异,提示肺炎小鼠肺部细菌基本被清除。抗TLR2抗体组和SA肺炎组小鼠BALF白细胞计数及中性粒细胞比值、血清细胞因子KC及IL-10与正常对照组比较,均无统计学差异,抗TLR2抗体组小鼠HE病理评分低于SA肺炎组小鼠,但两组均高于正常组,提示肺炎小鼠肺部炎症较前好转,抗TLR2抗体组肺部炎症病理改变较 SA肺炎组轻,可能与TLR2信号通路受阻断后,肺部炎症浸润减少有关。
综上所述,抗TLR2抗体可阻止SA与TLR2结合,抑制小鼠SA肺炎炎症介质释放,减少炎症细胞浸润,减轻肺部炎症反应。本研究为抗TLR2抗体在抑制SA肺炎炎症反应方面的作用提供理论依据。
[1]Fournier B.The function of TLR2 during staphylococcal diseases[J].FrontCellInfectMicrobiol,2012,doi:10.3389/fcimb.2012.00167.eCollection 2012.
[2]Meng G,Rutz M,Schiemann M,et al.Antagonistic antibody prevents toll-like receptor 2-driven lethal shock-like syndromes[J].J Clin Invest,2004,113(10):1473-1481.
[3]Bubeck Wardenburg J,Patel RJ,Schneewind O.Surface proteins and exotoxins are required for the pathogenesis of staphylococcus aureus pneumonia[J].Infect Immun,2007,75(2):1040-1044.
[4]Yang HZ,Cui B,Liu HZ,et al.Targeting TLR2 attenuates pulmonary inflammation and fibrosis by reversion of suppressive immune microenvironment[J].J Immunol,2009,182(1):692-702.
[5]Zivkovic A,Sharif O,Stich K,et al.TLR2 and CD14 mediate innate immunity and lung inflammation to staphylococcal Panton-Valentine leukocidin in vivo[J].J Immunol,2011,186(3):1608-1617.
[6]Carrillo-Marquez MA,Hulten KG,Hammerman W,et al.Staphylo coccus aureus pneumonia in children in the era of communityacquired methicillin-resistance at Texas Children's Hospital[J].Pediatr Infect Dis J,2011,30(7):545-550.
[7]Si-Tahar M,Touqui L,Chignard M.Innate immunity and inflammation--two facets of the same anti-infectious reaction[J].Clin Exp Immunol,2009,156(2):194-198.
[8]Smith JA.Neutrophils,host defense,and inflammation:A doubleedged sword[J].J Leukoc Biol,1994,56(6):672-686.
[9]Pietrocola G,Arciola CR,Rindi S,et al.Toll-like receptors(TL Rs)in innate immune defense against Staphylococcus aureus[J].Int J Artif Organs,2011,34(9):799-810.
[10]Adler MJ,Dimitrov DS.Therapeutic antibodies against cancer[J].Hematol Oncol Clin North Am,2012,26(3):447-481.
[11]Wesolowski J,Alzogaray V,Reyelt J,et al.Single domain antibod ies:Promising experimental and therapeutic tools in infection and immunity[J].Med Microbiol Immunol,2009,198(3):157-174.
[12]Yang HZ,Cui B,Liu HZ,et al.Targeting TLR2 attenuates pulmonary inflammation and fibrosis by reversion of suppressive immune microenvironment[J].J Immunol,2009,182(1):692-702.
[13]Robertson CM,Perrone EE,McConnell KW,et al.Neutrophil depletion causes a fatal defect in murine pulmonary Staphylococcus aureus clearance[J].J Surg Res,2008,150(2):278-285.
[14]Hongo I,Baba T,Oishi K,et al.Phenol-soluble modulin alpha 3 enhances the human neutrophil lysis mediated by Panton-Valentine leukocidin[J].J Infect Dis,2009,200(5):715-723.
