黄曲霉毒素M1人工抗原的制备及鉴定①
2014-11-27蔡齐超侯玉泽邓瑞广胡骁飞张小帆王方雨
蔡齐超 侯玉泽 邓瑞广 胡骁飞 王 耀 张小帆 王方雨
(河南科技大学食品与生物工程学院,洛阳 471003)
黄曲霉毒素M1(Aflatoxin M1,AFM1)是目前发现最稳定的一种真菌毒素,具有二呋喃环结构,在365 nm的紫外线下可发出蓝紫色的荧光[1,2]。AFM1的毒性很大,是氰化钾的5倍,砒霜的40倍[3,4]。国际癌症研究机构也一再提升AFM1的致癌等级,已从1993年的二类致癌物质提升为2002年的一类致癌物[2,5]。由于黄曲霉毒素M1大多见于婴幼儿奶粉及其他乳制品中,而且目前缺乏行之有效的防治措施和去毒方法,因此世界各国均制定了严格的毒素残留标准[6,7]。中国和俄罗斯要求在乳及乳制品中,黄曲霉毒素M1的最高限量为0.5 μg/kg;而日本和欧盟的要求更高,其最高限量为0.05 μg/kg[8]。目前检测 AFM1 残留的方法很多,主要包括薄层层析法(TLC)、高效液相色谱串联质谱法(HPLC-MS)和酶联免疫吸附法(ELISA)等[9-15]。由于TLC只能定性不能定量,而且所需时间长;HPLC操作复杂,仪器昂贵,并且对检测样品性质要求较高,所以它们都不适于现场大规模的检测。而免疫学快速检测方法因其特异性高、敏感性好、快速简便、对样品要求低等优点,在小分子抗原检测中具有非常广阔的前景。抗体是免疫学检测不可或缺的生物性原材料,人工抗原是抗体制备的前提,因此,成功合成AFM1人工抗原就显得尤为重要,这为AFM1单克隆抗体制备及AFM1免疫学快速检测试剂的研制奠定了坚实的基础。
1 材料与方法
1.1 材料
1.1.1 溶液 溶液PBS(Phosphate buffered saline,0.01 mol/L磷酸盐缓冲液),洗液 PBST(PBS∶Tween20=2×103∶1),包被液 CBS(Carbonate buffered saline,0.05 mol/L NaHCO3/Na2CO3缓冲液),封闭液(PBST∶猪血清=20∶1),TMD 底物缓冲液,终止液(2 mol/L H2SO4)。
1.1.2 试剂 黄曲霉毒素 M1(Aflatoxin M1,AFM1),Sigma产品,纯度≥98.0%;1-(3-二甲氨基丙基)-3-乙基碳二亚胺(EDC),Thermo scientific公司产品;BSA和 OVA,弗氏完全佐剂(Freund’s complete adjuvant,FCA)和弗氏不完全佐剂(Freund’s incomplete adjuvant,FIA),Pierce 产品;羊抗兔酶标二抗(GaRIgG-HRP),华美生物工程有限公司;试验用双蒸水(ddw)由本实验室制备;其他所用试剂均为市售AR(分析纯)级。
1.1.3 仪器 U-3000紫外扫描仪(UV),日本岛津公司;3K-18高速冷冻离心机,德国Sigma公司;Bio-Rad-550型酶标仪,美国Bio-Rad公司;HI9321酸度计,美国 HANNA公司;AE260电子天平,德国METTLER公司;ZF-7三用紫外分析仪,巩义予华仪器有限责任公司;XMTD-8222电热恒温水浴锅,上海一恒科技有限公司;JM-250电泳仪,大连捷迈科贸有限公司;超纯水仪,Millipore产品。
1.1.4 试验动物 购自郑州大学医学院实验动物中心的6周龄雌性BALB/c小鼠,均为SPF级,由河南省动物免疫学重点实验室饲养。
1.2 方法
1.2.1 人工抗原的合成
1.2.1.1 AFM1肟(AFM1O)的制备 将2 mg的AFM1和4 mg的氨氧基乙酸半盐酸盐(CMO)溶于2 ml吡啶甲醇水的混合液中(吡啶∶甲醇∶双蒸水=1∶4∶1),控温(120℃)回流,薄层色谱法监测反应进程。待反应完全,用旋转蒸发仪将溶剂旋干,加入2 ml ddw溶解,用2 mol/L的H2SO4调节pH=4,再用5 ml乙酸乙酯萃取2~3次,合并有机相,并用 ddw洗涤2次,再次旋干液体,得到的黄色油状物质即是AFM1O。
1.2.1.2 完全抗原的制备 AFM1-BSA的制备:用0.4 ml N,N-二甲基甲酰胺(DMF)溶解 AFM1O,取0.2 ml再加入0.3 ml ddw配成N,N-二甲基甲酰胺和水(DMF∶H2O=2∶3)的混合溶液,加入 1 mg EDC,室温避光活化4 h后,再补加1 mg EDC,此为A液。称3.35 mg BSA,用0.13 mol/L的 NaHCO3溶液(2.76 ml)制成10%BSA活化溶液,此为B液。将B液逐滴加入到A液中,避光搅拌24 h。在4℃下用PBS搅拌透析3 d,每天换液4次,离心去沉淀获得纯化的AFM1-BSA[16,17]。AFM1O-OVA 的 制备:方法同上,用 OVA(2.13 mg)取代 BSA,得到AFM1O-OVA,反应方程如图1。
1.2.2 薄层层析法鉴定 将肟化物用少量二甲基甲酰胺(DMF)溶解,以10 ml氯仿和甲醇的混合液(氯仿∶甲醇=9∶1)为展开剂,用铅笔在硅胶板上画两道线,用毛细管在一条线上点样,插入盛有展开剂的容器中,点样线在下但高于液面。在展开剂层析到另一条线时,取出硅胶板,在暗室中,用365 nm的紫外分析仪照射,观察并记录亮斑反应方程如图2。
1.2.3 紫外扫描鉴定 用PBS配制AFM1、BSA和OVA标准溶液,调节合成抗原的浓度与标准溶液相一致,用紫外扫描仪测定,在波长220~440 nm范围内得到最大吸收峰及特征值。
1.2.4 SDS-PAGE凝胶电泳鉴定 按照文献[18]介绍的方法配制所需电泳溶液。基于所分离蛋白比较单一,且分子量相当大,选择电泳条件:浓缩胶浓度为5%,分离胶浓度为12%,浓缩胶电压90 V,分离胶电压100 V,上样量为20 μl,考马斯亮蓝染色4 h后,置脱色液中脱色,为加快进程,可更换2~3次脱色液。
1.2.5 免疫学方法(ELISA)鉴定
1.2.5.1 动物免疫 取高压PBS溶解AFM1-BSA至50 μg/ml,与等量弗氏完全佐剂(首免用完全佐剂,之后用不完全佐剂)混合,用乳化器充分乳化后,免疫小鼠。小鼠背部皮下6点注射,免疫剂量为0.2 ml/只,共免4次,免疫间隔为21 d。三免后10 d 断尾采血 10 μl至 990 μl PBS 中,4 000 r/min 离心取上清,4℃保存备用。
1.2.5.2 包被板的制备 首先,AFM1-OVA包被,包被浓度和包被量分别为 5 μg/ml和 50 μl/孔,37℃温育2 h,PBST洗板5次;然后,用5%猪血清封闭220 μl/孔,37℃温育1 h,PBST 洗5 次,晾干后4℃保存。
1.2.5.3 多抗血清(pAb)效价测定 采用间接ELISA方法测定多抗血清效价。第一步,用5%猪血清铺底50 μl/孔,在第一行加小鼠血清 50 μl/孔,倍比稀释到倒数第二行,设阴性对照(NC,即用未免疫AFM1-BSA的小鼠血清)和空白对照(BC),37℃温育15 min,洗5次;第二步,加GaMIgG-HRP,用5%猪血清1∶1 000 倍稀释,50 μl/孔,37 ℃温育 30 min,洗 6次;第三步,加TMB显色50 μl/孔,室温反应10 min;第四步,加 2 mol/L H2SO4终止反应 50 μl/孔,读OD450;第五步,结果判断:以待测孔 OD450值≥NC OD450值的2.1 倍(P/N≥2.1),判为阳性[19]。
1.2.5.4 多抗血清(pAb)抑制价测定 采用阻断ELISA鉴定pAb抑制价。方法与1.2.5.3基本相同,只是第一步略有不同,改为用5%猪血清铺底50 μl/孔,加 OD450为 1.0左右的小鼠血清50 μl和不同浓度的 AFM1标准品作抑制剂,设NC和 BC,37℃温育15 min,PBST洗5次。最后计算抑制率(B/B0,B0为 AFM1浓度为0时的OD450,B为不同浓度 AFM1的 OD450)。以 B/B0为纵坐标,以AFM1浓度的对数值为横坐标,绘制抑制曲线,根据曲线趋势推导回归方程,计算小鼠多抗血清对AFM1的50%抑制浓度(IC50),以 IC50衡量其敏感度[20]。
2 结果
2.1 TLC鉴定肟化物 由图3可知,迁移距离较远的是 AFM1标准品,迁移距离较近的为肟化物AFM1O。AFM1与CMO的反应完全时间很难确定,但是TLC能够确定肟化反应的进程,所以采用TLC可以确定AFM1与CMO反应完全的时间。在查阅的文献中,回流反应的时间有很多,有回流2 h、2.5 h、3.5 h、4 h和5 h。本实验用TLC确定反应进程,自回流2 h后开始检测。图3A是还未开始反应时的TLC检测,点样AFM1标品和混合液。图3B是在肟化反应2 h时TLC检测,点样AFM1标品和混合液。图3C是肟化反应2.5 h时TLC检测,点样AFM1标品和混合液。
2.2 UV鉴定人工抗原 用U-3000紫外扫描仪对AFM1、BSA、AFM1-BSA 在 220~440 nm 波长范围进行扫描。由图4可看到BSA在280nm处有吸收峰,AFM1在262 nm处有吸收峰,而偶联物AFM1-BSA在274 nm处出现最大吸收峰,与BSA和AFM1的最大吸收峰均不重合,证明偶联成功。

图1 AFM1O的制备Fig.1 Preparation of AFM1O

图2 AFM1人工抗原和检测抗原的制备Fig.2 Preparation of AFM1 artificial antigen and coated antigen
2.3 SDS-PAGE鉴定人工抗原 由图5可知,AFM1-BSA的泳动速度小于BSA,而且有较明显的扩散现象,说明BSA的分子量小于AFM1-BSA,证明AFM1与BSA偶联成功。
2.4 ELISA鉴定人工抗原
2.4.1 ELISA测定pAb效价 由表1可知,免疫的3只小鼠血清抗体效价均达到了1×10-4,其中1号小鼠最高,达到1∶1.28×104,说明用 AFM1-BSA 免疫小鼠能够获得较好的免疫效果。
2.4.2 阻断ELISA测定pAb敏感性 选取抑制最好的3号小鼠做标准抑制曲线。由图6可知,3号小鼠的标准抑制曲线的线性回归方程为y=-0.246 5x+1.130 1,相关系数 R2=0.970 4,IC50=359.9 ng/ml,表明3号小鼠的血清对AFM1具有较高的敏感性。说明免疫抗原和检测抗原均偶联成功。

表1 3只小鼠pAb间接ELISA效价测定结果Tab.1 Titers of polyclonal antibodies of three BALB/c mice detected by indirect ELISA

图3 AFM1和AFM1O的薄层色谱图Fig.3 TLC of AFM1 and AFM1-BSA

图4 BSA、AFM1和AFM1-BSA的紫外扫描光谱Fig.4 UV scanning spectrum of BSA,AFM1 and AFM1-BSA
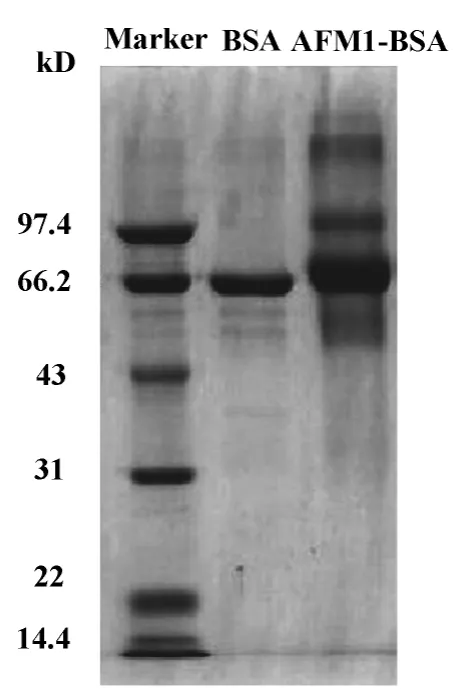
图5 AFM1-BSA偶联物的SDS-PAGE鉴定Fig.5 Identification of AFM1-BSA conjugation by SDSPAGE

图6 阻断ELISA检测3号小鼠AFM1 IC50Fig.6 IC50inhibitive curve of mice 3 AFM1 polyclonal antiserum by competitive ELISA
3 讨论
3.1 AFM1抗原偶联方法 AFM1是小分子物质,属于半抗原,即只有反应原性,无免疫原性,因此只有将其与具有免疫性的大分子载体蛋白偶联后,才能形成完全抗原。由于AFM1分子构象中并没含有羧基等易与载体蛋白相结合的基团,故本实验采用肟化法在AFM1分子构象上添加一个羧基,以便接下来用碳化二亚胺法(EDC)分别制备出免疫抗原和检测抗原。
3.2 TLC确定肟化完全 本文采用TLC法来确定肟化反应的进程。AFM1和CMO回流反应,反应完全时间很难确定。本实验将AFM1和CMO在双头烧瓶进行回流,这可方便取液检测。TLC确定反应进程,自回流2 h后开始检测,每隔0.5 h TLC检测,在2.5 h时已经完全反应。用TLC确定了反应物完全肟化,不仅缩短了试验时间,提高了效率,而且还减少了加热时间过长引起的许多副反应的发生。
3.3 AFM1偶联物的鉴定 鉴定免疫抗原和检测抗原的方法一般有紫外扫描光谱法、SDS-PAGE电泳法和 ELISA法。通过紫外扫描,可知偶联物AFM1-BSA和AFM1-OVA的最大特征吸收峰与BSA、OVA的最大吸收峰及AFM1的最大吸收峰均不重合,证明AFM1-BSA和AFM1-OVA合成成功。因为AFM1-BSA和AFM1-OVA与BSA和OVA的分子质量不同,采用SDS-PAGE凝胶电泳跑蛋白胶,它们的泳动速率也会不同,AFM1-BSA和BSA、AFM1-OVA和OVA能明显错开,所以证明AFM1-BSA和AFM1-OVA合成成功。ELISA法是将制备的免疫原免疫小鼠,均获得良好效价,做敏感性实验时,3号小鼠的IC50达到了359.9 ng/ml,这也证明小分子AFM1偶联载体蛋白成功。
本实验合成并鉴定了AFM1的人工抗原,获得敏感性好、特异性强的多克隆抗体,为进一步筛选AFM1单克隆抗体和研制AFM1快速检测试剂盒或试纸条打下了良好的基础。
[1]Carlson M,Bargeron C,Benson R,et al.An automated,handheld biosensor for aflatoxin[J].Biosensors & Bioelectronics,2000,14(10):841-848.
[2]Abbes S,Salah-Abbes JB,Bouraoui Y,et al.Natural occurrence of aflatoxins(B1 and M1)in feed,plasma and raw milk of lactating dairy cows in Beja,Tunisia,using ELISA[J].Food Additi Contam:Part B,2012,5(1):11-15.
[3]Prandini A,Tansini G,Sigolo S,et al.On the occurrence of aflatoxin M1 in milk and dairy products[J].Food Chem Toxicol,2009,47(5):984-991.
[4]El KA,Atoui A,Yaghi J.Analysis of aflatoxin M1 in milk and yogurt and AFM1 reduction by lactic acid bacteria used in Lebanese industry[J].Food Control,2011,22(10):1695-1699.
[5]Alborzi S,Rashidi M,Aataneh B.Aflatoxin M1 contamination in pasteurized milk in Shiraz(south of Iran) [J].Food Control,2006,17(7):582-584.
[6]江 涛,俞 琼,李 敏,等.抗黄曲霉毒素M1抗体制备及检测方法建立[J].中国公共卫生,2007,23(1):43-45.
[7]褚庆华,徐超一,刘 岩,等.免疫亲和柱一荧光分析法测定鲜乳和乳粉中的黄曲霉毒素 M1[J].检验检疫科学,2003,13(2):41-43.
[8]Rastogi S,Dwivedi PD,Khanna S K,et al.Detection of aflatoxin M1 contamination in milk and infant milk products from Indian markets by ELISA[J].Food Control,2004,15(4):287-290.
[9]Kamkar A.A study on the occurrence of aflatoxin M1 in Iranian Feta cheese[J].Food Control,2006,17(10):768-775.
[10]Rodriguza VM,Calonge DM,Ordonez ED.ELISA and HPLC determination of the occurrence of aflatoxin M1 in raw cow's milk[J].Food Addit Contam,2003,20(3):276-280.
[11]Kim E,Shon D,Ryu D,et al.Occurrence of aflatoxin M1 in Korean dairy products determined by ELISA and HPLC[J].Food Addit Contam,2000,17(1):59-64.
[12]Manetta AC,Di GL,Giammarco M,et al.High-performance liquid chromatography with post-column derivatisation and fluorescence detection for sensitive determination of aflatoxin M1 in milk and cheese[J].J Chromatogr A,2005,1083(1):219-222.
[13]Sarimehmetoglu B,Kuplulu O,Haluk CT.Detection of aflatoxin M1 in cheese samples by ELISA[J].Food Control,2004,15(1):45-49.
[14]Radoi A,Targa M,Marty JL,et al.Enzyme-Linked Immunosorbent Assay(ELISA)based on superparamagnetic nanoparticles for aflatoxin M1 detection[J].Talanta,2008,77(1):138-143.
[15]Pei SC,Zhzng YY,Lee WJ,et al.Detection of aflatoxin M1 in milk products from China by ELISA using monoclonal antibodies[J].Food Control,2009,20(12):1080-1085.
[16]Kemp HA,Morgan MR.Studies on the detrimental effects of bivalent binding in a microtitration plate ELISA and possible remedies[J].J Immunol Meth,1986,94(1),65-72.
[17]陈福生,罗信昌,周 启,等.黄曲霉毒素 B1的免疫检测 I抗原的制备[J].菌物系统,1999,18(3):316-320.
[18]Sambrook J,Fritsc E,Maniatis T.Molecular cloning:a laboratory manual[M].NY:Cold Spring Harbor Laboratory Press,1989:6-9.
[19]Tijssen P.Pratice and theory of enzyme immunoassay[M].Amsterdam:Elsecier,1985:173-210.
[20]刘庆堂,王 磊,职爱民,等.碳二亚胺法制备阿莫西林人工抗原及其鉴定[J].河南农业科学,2012,41(3):142-145.
