糖类抗原19-9单抗制备及DAS-ELISA的建立①
2014-11-27王云龙翟晋豫王继创李玉林葛新杰
王云龙 翟晋豫 王继创 程 蕾 李玉林 葛新杰 毛 烈
(河南师范大学生命科学学院,新乡 453007)
1979 年 Koprowski等[1]以结肠癌细胞 株SW1116作为免疫原,获得了多种特异性的单克隆抗体。其中经单克隆抗体1116-NS19-9特异性识别的抗原被命名为糖类抗原19-9(Carbohydrate antigen 19-9,CA19-9)。CA19-9是一种类黏蛋白形式的糖蛋白。同时也是多种癌症检测的重要参考指标之一[2-4]。研究表明,CA19-9针对胰腺癌、胃癌等有着良好的特异性及敏感性,针对胰腺癌相关检测阳性率可以达到80%[5]。因此,建立CA19-9的检测对于癌症的临床诊断具有重大意义。
作为CA19-9检测试剂盒的重要组成部分,特异性的CA19-9单克隆抗体的制备显得至关重要。但目前国内试剂盒所采用的CA19-9单克隆抗体多为国外公司生产,少数国内生产的单克隆产品在特异性、稳定性等方面尚有许多不足[6],这严重影响了国产试剂盒的品质。本研究旨在探索利用新型免疫佐剂结合半固体培养法克隆化阳性杂交瘤细胞对单克隆抗体制备的意义,并利用制备获得的单抗建立双抗体夹心ELISA(DAS-ELISA)方法,以此提升国产检测试剂盒的性能。
1 材料与方法
1.1 主要材料 CA19-9抗原购于Fitzgerald Industries International公司。33份病患血清来自郑州大学第一附属医院。Quick Antibody免疫佐剂购于北京康碧泉生物科技有限公司。8周龄左右雌性BALB/c小鼠购自郑州大学医学院实验动物中心。SP2/0小鼠骨髓瘤细胞为本实验室保存。PEG4000、HAT、HT、RPMI1640 培养基均购于 Gibco公司。辣根过氧化物酶(HRP)购于Sigma公司。HRP-兔抗鼠IgG由本实验室制备。蛋白质Marker购于上海生工生物公司。小鼠亚型鉴定试剂盒为郑州百基生物科技有限公司产品。CA19-9 ELISA检测试剂盒为德国Roche公司产品。
1.2 方法
1.2.1 抗原免疫 免疫小鼠分为2组:A组将Quick Antibody佐剂与抗原等体积混匀,选取3只BALB/c雌性小鼠作为一组。另取1只小鼠注射等体积PBS溶液作为阴性对照。初次抗原免疫剂量为25 μg/只。2周后进行2次免疫,免疫剂量为25 μg/只。第3周采集尾血进行效价检测。B组:采用弗氏免疫佐剂进行常规免疫,小鼠数目同A组。抗原免疫剂量为100 μg/只。1只对照小鼠注射等体积PBS溶液。共免疫3次,间隔周期为2周。A组免疫方式为肌肉注射,B组采用背部多点结合腹腔注射。7 d后采集小鼠尾血,测定血清效价。
1.2.2 间接ELISA检测法的建立 利用棋盘筛选法进行操作。抗原稀释成 0.25、0.5、0.75、0.1、0.15、0.2 μg/ml浓度,37℃包被 2 h,洗涤,以含 1%BSA的PBST封闭。小鼠血清1 000倍稀释加样,温育30 min。洗涤、拍干。将酶标 IgG稀释至1∶1 000、1∶2 000、1∶4 000、1∶6 000、1∶8 000、1∶10 000倍加入,温育30 min,洗涤、拍干。加入TMB显色,2 mol/L的硫酸终止,测定光吸收(OD)值。以阴性小鼠血清作为对照,设计3个复孔平行,依照P/N值最大确立最佳的抗原包被浓度及对应的酶标稀释浓度。
1.2.3 阻断ELISA法测定抗体的敏感性 CA19-9抗原按照0.5 μg/ml进行包被与封闭。同时将抗原进行倍比稀释,与经检测OD值接近1.0左右的小鼠稀释血清50 μl等体积混合,同时设空白与阴性对照。设计3平行复孔,利用间接法检测计算OD均值。以光吸收值在0.500左右、抗原浓度较低一组的小鼠作为融合备用小鼠。
1.2.4 细胞融合及单克隆抗体筛选 融合前调整SP2/0骨髓瘤细胞至对数生长期,选择CA19-9小鼠血清抗体效价、敏感性高的小鼠作为融合用鼠进行细胞融合操作。收集SP2/0细胞,制备免疫小鼠脾脏细胞悬液。分别计数后,以1∶10的比例混匀,37℃条件下利用50%PEG4000进行促融。融合细胞用浓度为5 μg/ml的 HAT筛选培养基混匀,以2.0×106个 /ml密度铺在含饲养层的96孔板中,37℃、5%CO2条件下培养至第3日半换液,第9日全部换液,利用间接ELISA法检测培养孔中有无抗体分泌。
借鉴本实验室任瑞敏等[7]文献中半固体琼脂克隆化筛选方法,利用RPMI1640配制1.1%的甲基纤维素培养基,并加入2.5 mmol/L L-谷氨酰胺、20%胎牛血清、1∶1 000青霉素-链霉素溶液混匀,取上述检测阳性孔中细胞重悬至该半固体培养基中培养,待有肉眼可见细胞集落出现,利用毛细管克隆化阳性杂交瘤细胞。
1.2.5 小鼠腹水抗体效价检测及亚型鉴定 小鼠腹腔注入阳性杂交瘤细胞收集腹水,利用间接ELISA测定该腹水效价,并采用辛酸硫酸铵法纯化腹水抗体,紫外分光光度法测量OD值,并计算蛋白浓度。利用鼠亚型鉴定试剂盒对单克隆抗体进行亚型鉴定。
1.2.6 筛选配对抗体 采用改良过碘酸钠法将辣根过氧化物酶与单克隆抗体耦联后,以病患血清为待测样本,1 μg/ml包被3种单克隆抗体。加入1∶10稀释定值病患血清后再加入1∶2 000倍稀释的上述酶标抗体形成DAS-检测方法,设计3平行复孔取OD均值,分析配对结果。
1.2.7 DAS-ELISA法的建立与特异性测定 利用棋盘法建立DAS-ELISA,包被抗体浓度分别取0.5、0.75、1、1.25、1.5、2 μg/ml进行包被。酶标抗体分别按照 1∶1 000、1∶2 000、1∶4 000、1∶6 000、1∶8 000、1∶10 000进行稀释,二者依照DAS-ELISA 60 min-60 min-20 min反应模式进行。选取经赋值为1.0左右的阳性稀释血清,以正常人血清在0.10左右为阴性,依据检测结果,以阳性检测结果值接近1.0,阴性对照低为最佳包被与酶标稀释浓度。
利用上步构建的DAS-ELISA法对本实验室已有的CEA、CA12-5、CA15-3高值特异性血清进行检测,判断有无交叉反应。
1.2.8 标准曲线的绘制 利用建立的DAS-ELISA检测方法,选择多浓度水平的定值病患血清作为检测样本,OD值为纵坐标,血清CA19-9抗原浓度为横坐标,绘制标准曲线,判断线性范围。
1.2.9 DAS-ELISA法的应用 利用获取的33份病患血清,通过本实验构建的DAS-ELISA检测方法与国外试剂盒进行对比检测,比较二者相关性。
2 结果
2.1 间接ELISA检测方法的确立 由棋盘法确定了抗原包被浓度为0.5 μg/ml,HRP-羊抗鼠IgG稀释浓度为1∶6 000作为检测的最优组合。
2.2 免疫效果对比及抗血清效价检测 评价效果以阴性OD值2.1倍以上(不足0.05按0.05)判断为能够检测到的效价水平。效价结果表明:A组2、3号小鼠与B组1、3号小鼠的效价度均达到1.28×106,其余2只小鼠的效价为3.2×104。A、B组免疫效果小鼠血清效价检测值近似,说明Quick Antibody佐剂在节省抗原的基础上,也能达到较高的抗体水平,见表1。
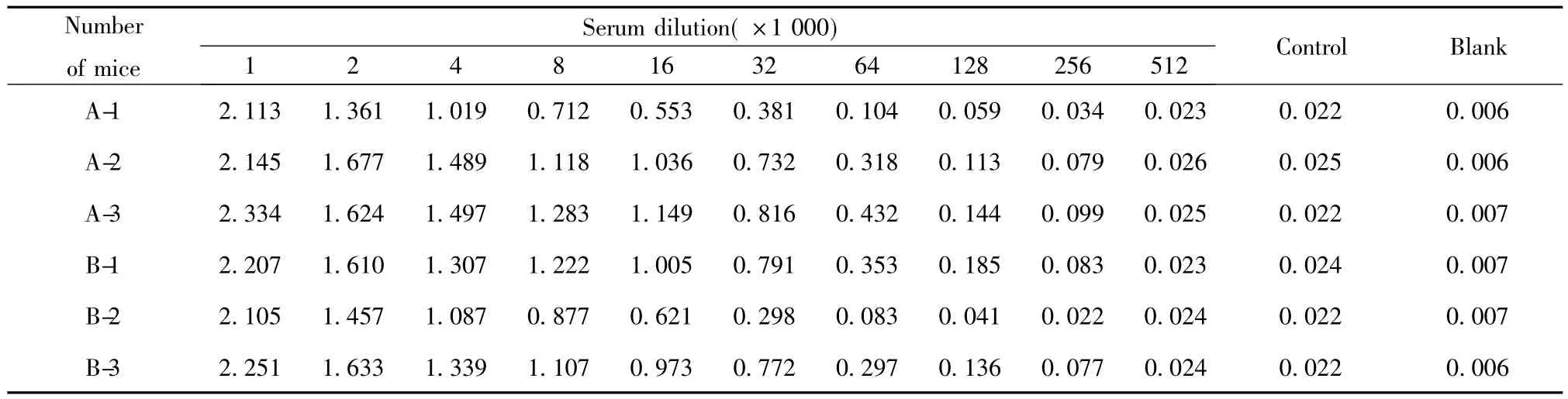
表1 小鼠抗血清效价检测Tab.1 Determination titer of mice antiserum
2.3 多克隆抗体敏感性的检测 多克隆抗体敏感性检测结果如图1所示。结果显示,A组2、3号小鼠和B组1、3号小鼠的IC50值在0.16~ 0.63 μg/ml之间,抑制效果较好,产生多克隆抗体的敏感性值较高,此类小鼠适合作为融合小鼠。
2.4 细胞融合率及筛选得到阳性杂交瘤细胞 细胞融合进行了3次。经观察克隆团形成孔统计数目,分别计算得出细胞融合的融合率为88.3%、83.9%和91.2%。通过对细胞克隆化上清间接ELISA法检测,共获得了7株可分泌抗体的阳性细胞株,2株后期转阴,其余5株细胞株分别命名为ZJY1-2C8、ZJY2-3H9、ZJY2-7F10、ZJY3-4B6、ZJY3-1G9。后经细胞传代稳定性等鉴定,最终确定3株较好 细 胞 株,分 别 为 ZJY1-2C8、ZJY2-7F10、ZJY3-1G9。
2.5 腹水效价检测与单克隆抗体的纯化及浓度测定 经间接ELISA法检测,3株抗体的腹水效价均达到了106左右。经SDS-PAGE电泳,观察到2条大小约为25 kD与55 kD的明显条带(如图2)。单克隆抗体ZJY1-2C8的蛋白浓度约为14.7 mg/ml,ZJY2-7F10约为 17.1 mg/ml,ZJY3-1G9约为 12.8 mg/ml。
2.6 单克隆抗体亚型鉴定 利用小鼠亚型鉴定试剂盒对3株单克隆抗体进行亚型鉴定,结果:3株mAb均为IgG1型单克隆抗体。
2.7 配对抗体的筛选 筛选方法采用DAS-ELISA检测方法,设计正交实验,结果如表2所示。结果显示:以ZJY3-1G9作为包被抗体、ZJY2-7F10作为酶标抗体时,测得的病患血清OD数值最高,说明两者之间所识别的抗原表位不同,且距离稍远,适合进一步实验需要。
2.8 建立DAS-ELISA检测法 利用棋盘法,将ZJY3-1G9作为包被抗体、ZJY2-7F10作为酶标抗体,检测结果如表3。结果分析:当包被在1 μg/ml,酶标稀释浓度为1∶6 000时,阳性值在1.0左右,阴性对照OD值为0.134较低,此包被与酶标为最佳。DAS-ELISA法检测CEA、CA12-5、CA15-3均无交叉反应,证明配对抗体特异性较好。
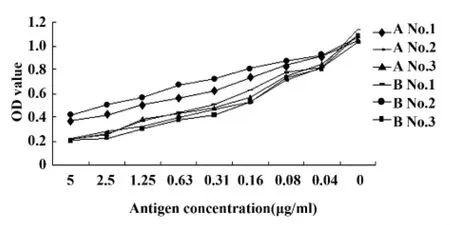
图1 小鼠多克隆抗体敏感性检测结果Fig.1 Detection results from mouse polyclonal antibody reflects on sensitivities

表2 筛选配对抗体结果Tab.2 Results of antibody pairing test

表3 确定包被浓度及酶标抗体稀释浓度Tab.3 Determination coating concentration of mAb and dilution of mAb-HRP
2.9 线性方程及范围 经不同赋值的定值血清利用上步结果检测出一系列OD值并做曲线。由图4可见,抗原浓度在30~300 U/ml范围中呈现线性关系,取此抗原浓度与对应OD值确定回归方程:y=0.006 3x+0.069 7,R2=0.989 5。通过对样品稀释液进行20次重复检测,依据均值±2SD值,确定最低检测线为:26.4 U/ml。
2.10 DAS-ELISA检测方法与国外试剂盒对比验证
利用构建的DAS-ELISA检测法与国外购买的试剂盒同时检测33份病患血清,结果如图3所示。在本实验室条件下建立的DAS-ELISA检测方法与国外试剂盒检测对比结果显示,两者相关性良好,r=0.950 4,回归方程:y=0.911 1x+2.076,R2=0.903 2。
3 讨论

图2 纯化后抗体蛋白SDS-PAGE电泳图Fig.2 Results of SDS-PAGE with purified protein

图3 CA19-9标准曲线Fig.3 Standard curve of CA19-9
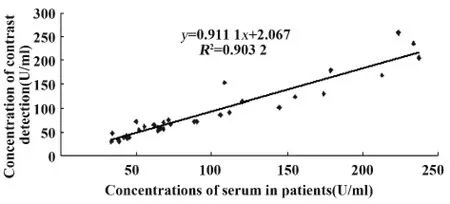
图4 DAS-ELISA检测方法与国外试剂盒对比验证结果Fig.4 Results of DAS-ELISA compared with Kits
众多研究已表明:CA19-9是能够针对胰腺癌、胃癌、宫颈癌等疾病诊断的一项肿瘤标记物[8-10]。目前临床及研究使用的诊断试剂盒多为德国Roche、美国雅培等公司产品,国内生产试剂盒并不多见[11]。卢培等[12]利用两株单克隆抗体配对进行光激化学发光免疫分析方法来探索应用与临床的可行性,燕强奋[6]建立双位点夹心免疫放射分析法来与法国CIS公司对比,相关系数r=0.896。前者虽选用的是国产单克隆抗体,但是未对其品质进行评价。后者选用国外单克隆抗体基本满足了免疫分析要求,但效果并未凸显。因此,获得一对优异的配对抗体对提升CA19-9抗原的检测水平,提升试剂盒品质至关重要。
本实验应用新型免疫佐剂Quick Antibody对比常规免疫佐剂,缩短免疫周期,节省抗原使用量。同时配合使用半固体培养基法缩短获取单克隆抗体时间[7],在较高融合率保证的基础下,最终获得3株较好单克隆抗体,经配对实验,建立完成DAS-ELISA检测方法。在与国外试剂盒的检测对比结果显示相关系数r=0.950 4,具有良好相关性。但因实验待测样本量少,对结果会有一定影响,后期实验主要需大量检测样本评价此方法的各方面性能指标。本实验在提升CA19-9检测试剂盒品质方面具有实际意义。
[1]Koprowski H,Steplewski Z,Mitchell K,et al.Colorectal carcinoma antigens detected by hybridoma antibodies[J].Somatic Cell Genet,1979,5(6):957-971.
[2]华建江,陈 望,姜健等.可溶性B7-H4在早期胃癌中的诊断价值探讨[J].中国免疫学杂志,2012,28(8):745-747.
[3]Humphris JL,Chang DK,Johns AL,et al.The prognostic and predictive value of serum CA19-9 in pancreatic cancer[J].Annals Oncol,2012,23(7):1713-1722.
[4]Viola-Villegas NT,Rice SL,Sean Carlin,et al.Applying PET to broaden the diagnostic utility of the clinically validated CA19-9 serum biomarker for oncology[J].J Nucl Med,2013,54(11):1876-1882.
[5]倪晓光,赵 平,王贵齐.血清肿瘤标志物CA19-9在胰腺癌诊断和预后中的价值[J].临床和实验医学杂志,2008,7(5):14-15.
[6]燕强奋,陈永利,王衍真.CA19-9双位点夹心免疫放射分析法的建立[J].同位素,2007,20(1):16-19.
[7]任瑞敏,王云龙,张怡青,等.利用改良后的脾内免疫和半固体培养基法制备单克隆抗体[J].生物技术通报,2013,8:166-169.
[8]刘玉荣,王 艳,赵雪梅,等.CA199、CA242对胰腺癌的诊断价值探讨[J].中国实用医药,2013,8(14):118-119.
[9]李 曦,李 伟.CA199表达升高在良恶性疾病中的意义[J].中国实用医药,2013,8(24):3-4.
[10]杨馥彦,黄江玲,邱少雄,等.CA125和CA199与CEA联合检测诊断卵巢癌的价值[J].中国校医,2013,27(5):339-340.
[11]罗 玥.CA125、CA199在子宫内膜异位症诊断中的应用价值[J].中国妇幼保健,2013,28:1690-1691.
[12]卢 培,赵卫国,黄秋芳.糖类抗原CA19-9光激化学发光免疫分析方法的建立[J].中国卫生检验杂志,2012,22(2):260-263.