黄芪多糖对布鲁菌S2株感染小鼠免疫功能的调节作用①
2014-11-27王晓曼陈志磊王少毅许振国杨瑞强张树全曹志然
王晓曼 陈志磊 王少毅 许振国 杨瑞强 张树全 曹志然
(河北大学基础医学院免疫学系,保定 071000)
布鲁菌是一种革兰氏阴性菌,能在细胞内繁殖生存引起布鲁菌病(Brucellosis),是反刍动物中常见的一种疾病,在人类中则引起波浪热。据WHO统计全球每年有500 000的新增病例[1]。尽管目前治疗布鲁菌病的药物及方法很多,尤其是我国学者研究出了许多中药方剂,并施以中西医结合治疗的方法,取得了较好治疗效果。但由于布鲁菌属于细胞内感染,抗生素等药物很难进入细胞内将其彻底清除,因此,目前尚无安全有效的治疗措施。
黄芪多糖(Astragalus polysaccharides,APS)是从黄芪中提取的生物活性成分之一,近年来研究发现,APS具有免疫调节、抗病毒、抗炎症、抗辐射、抗肿瘤、抗氧化、抗应激、保肝护肝、双向调节血糖和保护心血管系统等作用[2]。本文通过体内实验研究黄芪多糖对布鲁菌感染的巨噬细胞(Macrophage,MΦ)的调节作用,探讨其在免疫调节方面的作用及作用机制,为中药在布鲁菌病的治疗方面提供新的依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物与菌株 雌性BALB/c小鼠,6~8周龄,由河北医科大学实验动物中心提供,实验动物合格证号(1211063)。布鲁菌 S2株为本实验室保存。
1.1.2 主要仪器和试剂 倒置显微镜(CKX41SF,日本Olympus Corporation);二氧化碳培养箱(HF90,中国香港力康生物医疗科技控股有限公司);全自动酶标仪(ELX-800,美国宝特有限公司);洁净工作台(SW-CJ-2FD,苏州安泰空气技术有限公司);黄芪多糖注射液(齐鲁动物保健品有限公司);RPMI 1640培养基(美国Gibco公司产品);胎牛血清(杭州四季青生物工程材料有限公司产品);TNF-α、IFN-γ、IL-12 ELISA检测试剂盒(美国R&D Systems MIF00公司);胰蛋白胨大豆肉汤培养基、胰蛋白胨大豆琼脂培养基(美国Sigma公司)。
1.2 实验方法
1.2.1 动物分组与处理 6~8周龄雌性BALB/c小鼠120只,随机分为4组,每组30只。实验设为对照组,APS低剂量组、APS中剂量组和APS高剂量组4组。分别给予浓度为0 mg/ml(对照组)、0.4、1.2、3 mg/ml的 ASP 1 ml腹腔注射,1 次/d,连续3 d。第4天 给小鼠腹腔注射密度为1×107L-1的布鲁氏菌1 ml,并继续给予不同浓度APS。
1.2.2 各组小鼠腹腔MΦ对布鲁菌吞噬率和吞噬指数的测定 取5只S2株感染后1 h小鼠,腹腔注射5 ml无菌PBS,轻柔腹壁,眼球放血处死小鼠,分离血清备用。打开腹腔,吸出腹腔液4 ml,1 500 r/min×5 min离心,取部分沉淀细胞涂片(其余细胞用于载菌量测定),瑞氏-吉姆萨染色,油镜下计算吞噬率:吞噬率=(吞噬细菌的MΦ细胞数/MΦ细胞总数)×100%;并计算吞噬指数:吞噬指数=(200个MΦ吞菌总数/200个MΦ)×100%,并拍片。
1.2.3 不同时间点各组小鼠腹腔MΦ和脾脏载菌量的测定 分别取感染后的6、12、24、48、72 h的小鼠5只,眼球放血处死,分离血清备用。按1.2.2方法取腹腔液,贴壁2 h去除未贴壁细胞,调整细胞浓度为2 ×106ml-1,取1 ml细胞加入1 ml Tritonx-100细胞裂解液,15 min后混匀,取10 μl裂解液进行倍比稀释后,均匀涂布于TSA固体培养基上,37℃培养72 h后观察集落形成情况,取菌落形成单位在100~300范围内的培养皿,进行菌落计数并计算细胞内载菌量,结果以CFU/100 cell表示;
同时无菌操作摘除小鼠脾脏,称重,加入2 ml裂解液制成匀浆,15 min后混匀,取10 μl上清,倍比稀释后,均匀涂布于TSA固体培养基上,37℃培养72 h后计数集落数,计算脾脏载菌量,结果以CFU/g表示。
1.2.4 不同时间点小鼠血清中TNF-α、IL-12、IFN-γ的分泌量的检测 均采用ELISA法,按试剂盒说明操作。
1.3 数据的统计学处理 所有数据统计均在计算机SPSS16.0软件包内进行。计量数据均采用描述,采用析因设计资料的方差分析和t检验。检验水准α=0.05,P<0.05表示有显著性差异。
2 结果
2.1 APS可促进小鼠腹腔MΦ对布鲁菌S2株的吞噬作用(表1,图1) 结果表明:在感染后1 h,各浓度的APS组MΦ对S2株的吞噬率和吞噬指数均明显高于对照组,其中以1.2 mg/ml APS的作用最强,且MΦ细胞膜较完整。结果表明APS可促进小鼠腹腔MΦ对布鲁菌的吞噬,且对MΦ有一定保护作用。
2.2 APS可促进小鼠腹腔MΦ对布鲁菌S2株的杀死和清除作用 图2结果显示:在S2株感染后1 h,APS各浓度组MΦ内载菌量显著高于对照组(P<0.05),提示APS可促进MΦ对S2株的吞噬,并呈浓度依赖性;而S2株感染后6 h,APS各浓度组MΦ内载菌量则显著低于对照组(P<0.05)。
表1 不同浓度的APS对MΦ吞噬S2株的影响()Tab.1 Effect of different APS level on MΦ of phagocytosis S2()
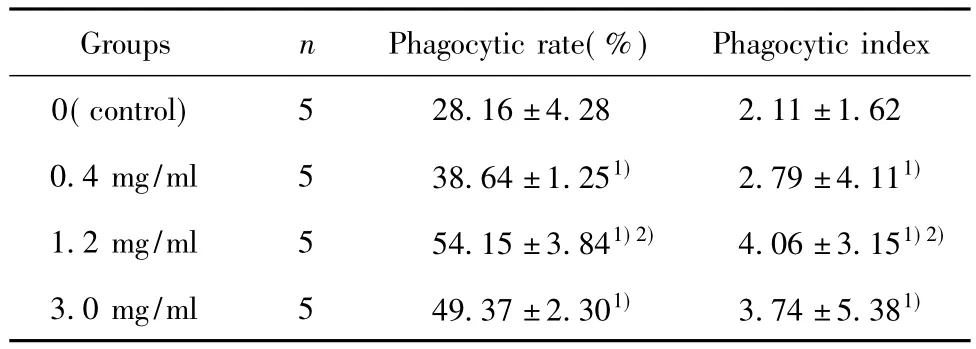
表1 不同浓度的APS对MΦ吞噬S2株的影响()Tab.1 Effect of different APS level on MΦ of phagocytosis S2()
Note:1)P< 0.05,vs control;2)P< 0.05 vs 0.4 mg/ml.
5 28.16±4.28 2.11±1.62 0.4 mg/ml 5 38.64±1.251) 2.79±4.111)1.2 mg/ml 5 54.15±3.841)2) 4.06±3.151)2)3.0 mg/ml 5 49.37±2.301) 3.74±5.381)Phagocytic index 0(control)Groups n Phagocytic rate(%)
2.3 APS可促进小鼠脾脏对布鲁菌S2株的清除作用 图3结果表明:在感染后的6 h,APS各剂量组脾脏内的活菌数均高于对照组(P<0.05),而随着病程的进展在感染后12 h开始,APS各剂量组脾脏内的载菌量均低于对照组(P<0.05),表明APS可增强脾脏清除布鲁菌的功能。
2.4 APS可促进小鼠体内TNF-α的分泌 表2结果表明:布鲁菌感染后1 h,小鼠血清中即可检测到大量的TNF-α分泌,而各浓度的APS在感染后的不同时间点均可促进小鼠血清中TNF-α的分泌(P<0.05)。

图1 不同浓度的APS对MΦ吞噬S2株的影响Fig.1 Effect of different APS level on MΦ of phagoc-ytosis S2
2.5 APS可促进小鼠体内IL-12的分泌 表3结果表明:在布鲁菌感染后1 h,小鼠血清中即可检测到IL-12分泌,而各浓度的APS在感染后的不同时间点血清中IL-12的水平均高于对照组(P<0.05)。
2.6 APS可促进小鼠体内IFN-γ的分泌 表4结果显示:APS各浓度组,在感染后6 h开始血清中IFN-γ的浓度与对照组相比明显增高(P<0.05),在24 h达高峰。

图2 各组不同时间点MΦ的载菌量Fig.2 Bacterial load of MΦ at different time points
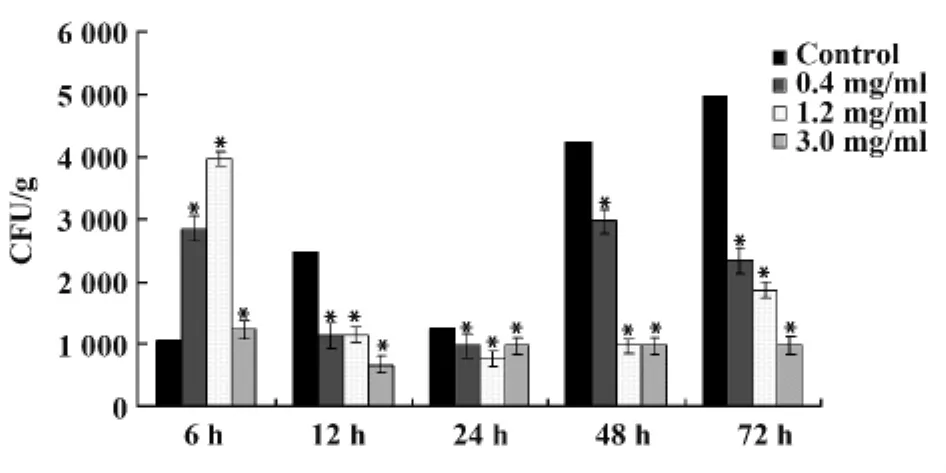
图3 各组不同时间点脾内载菌量的变化Fig.3 Bacterial load of spleen at different time points
表2 不同时间点血清中TNF-α含量变化(n=5,,pg/ml)Tab.2 TNF-α levels of serum at different time points of groups(n=5,,pg/ml)

表2 不同时间点血清中TNF-α含量变化(n=5,,pg/ml)Tab.2 TNF-α levels of serum at different time points of groups(n=5,,pg/ml)
Note:vs control,1)P < 0.05.
8 245.66±1.54 274.58±1.26 250.48±1.57 0.4 mg/ml 453.14±5.971) 715.42±6.411) 879.47±6.781) 769.54±0.491) 766.55±1.541) 748.12±5.541)1.2 mg/ml 475.44±1.991) 704.93±0.171) 988.47±3.151) 884.24±1.661) 894.11±1.251) 796.45±0.171)3 mg/ml 458.54±1.251) 755.85±2.781) 1130.54±2.171) 1004.74±0.411) 997.45±7.261) 876.54±6.181)1 h 6 h 12 h 24 h 48 h 72 h Control 231.93±1.17 314.93±2.24 297.97±3.1 Group TNF-α
表3 不同时间点血清中IL-12的含量变化(n=5,,pg/ml)Tab.3 IL-12 levels of serum at different time points of groups(n=5,,pg/ml)

表3 不同时间点血清中IL-12的含量变化(n=5,,pg/ml)Tab.3 IL-12 levels of serum at different time points of groups(n=5,,pg/ml)
Note:vs control,1)P < 0.05.
IL-12 1±3.74 9.15±3.13 8.47±5.46 0.4 mg/ml 9.23±3.77 10.08±9.14 25.49±2.431) 43.82±2.431) 54.93±7.111) 44.84±4.141)1.2 mg/ml 9.75±1.21 8.39±6.77 64.12±3.541) 71.91±6.611) 57.02±1.251) 41.48±1.091)3 mg/ml 9.45±336 10.91±1.16 41.08±1.321) 50.99±1.711) 37.19±4.121) 25.07±2.931)1 h 6 h 12 h 24 h 48 h 72 h Control 8.201±1.09 9.76±2.13 8.96±6.46 10.1 Groups
表4 不同时间点血清中IFN-γ含量变化(n=5,,pg/ml)Tab.4 IFN-γ levels of serum at different time points of groups(n=5,,pg/ml)

表4 不同时间点血清中IFN-γ含量变化(n=5,,pg/ml)Tab.4 IFN-γ levels of serum at different time points of groups(n=5,,pg/ml)
Note:vs control,1)P < 0.05.
.55±3.91 39.82±4.01 31.03±1.45 0.4 mg/ml 20.38±0.24 111.96±1.281) 108.06±3.071) 145.12±4.241) 83.09±1.971) 90.14±3.661)1.2 mg/ml 22.84±3.67 82.11±2.541) 68.55±4.191) 109.05±0.581) 67.01±4.421) 57.99±3.161)3 mg/ml 23.15±0.65 58.73±1.951) 61.86±3.521) 62.09±4.971) 58.08±1.561) 57.09±5.271)1 h 6 h 12 h 24 h 48 h 72 h Control 21.02±4.28 20.11±3.02 29.09±1.23 33 Groups IFN-γ
3 讨论
布鲁菌病是由布鲁菌引起的多器官损伤的慢性感染性疾病。布鲁菌为兼性细胞内寄生菌,MΦ是其侵袭的主要靶细胞[3],研究表明布鲁菌可产生多种毒力因子从而来逃避MΦ的杀伤作用,在MΦ内形成有利于其生存和繁殖的微环境[4,5],并引起感染MΦ的凋亡[6];布鲁菌的某些成分如LPS、Ⅳ型分泌系统及脂蛋白等可通过多种机制抑制机体的固有免疫和适应性免疫应答,逃避机体的免疫监视,从而导致慢性持续性感染的形成,并造成多器官损伤[7,8]。
目前WHO推荐的布鲁菌病的治疗方案为:多西环素联合利福平或链霉素的联合治疗方案[9]。虽取得一定疗效,但由于布鲁菌为细胞内寄生菌,抗生素不能进入被感染的细胞内,从而无法达到有效的细胞内治疗浓度,故此治疗方案易出现病情反复,使本病难以根治,临床治疗常以缓解临床症状为目的。
中医中药疗法具有疗效确切,运用灵活、易被患者接受等优点,蕴有极大的潜力,已成为我国防治研究布鲁菌病的重要组成成分。许多中药中提取出中药多糖成分,如党参多糖、黄芪多糖、猪芩多糖、淫羊藿多糖和紫菜多糖等,具有无细胞毒性的特点,是一种重要的生物效应调节剂。
黄芪多糖(APS)是黄芪的主要有效成分之一,已有研究表明APS作为生物免疫调节剂,主要通过以下机制发挥作用:①激活MΦ、NK和补体系统,诱导多种细胞因子,如 IFN-γ、TNF-α等,增强机体的固有免疫;②促进CD8+T淋巴细胞分化为有杀伤活性的Tc细胞,增强细胞免疫;③提高B淋巴细胞的数量与活性,增强体液免疫;④调节神经-内分泌-免疫系统网络;⑤促进细胞中RNA、DNA和蛋白质的合成,提高细胞内环核苷酸(cGMP、cAMP)的含量,调节信号传导途径[10-13]。但目前有关APS在抗布鲁菌感染中的作用未见报道。本文通过预先给小鼠腹腔注射不同剂量的APS,然后再进行布鲁菌S2株的腹腔感染,结果发现在感染后1 h APS各剂量组腹腔MΦ的吞噬率、吞噬指数和MΦ内的载菌量均高于对照组,其主要作用机制为APS促进了MΦ对布鲁菌的吞噬功能,故在感染后1 h MΦ的吞噬率和吞噬细胞内的细菌数量均明显高于对照组;从感染后6 h开始APS组MΦ内的载菌量则又明显低于对照组,且随感染时间的延长细胞内的载菌量随之减少,其机制主要为:① APS激活了MΦ并增强了其杀伤活性,杀死了吞入细胞内的大部分细菌;②APS促进部分吞噬了布鲁菌的MΦ迁移至脾脏,由脾内MΦ进一步清除。另外,本实验结果显示:在各实验组感染后24 h对照组的载菌量较12 h时又有所增高,其原因可能是部分布鲁菌能够通过某种机制逃脱了吞噬细胞的杀菌作用,从而得以在细胞内继续生存、繁殖,这也是造成布鲁菌持续感染的重要原因之一,但各APS组的载菌量仍低于对照组,进一步说明了ASP可促进MΦ的吞噬杀菌作用。
由于腹腔内感染的细菌可以进入脾脏进一步被脾内的MΦ清除,因此本文进一步观察了感染后不同时间点脾脏载菌量的变化,结果表明感染后6 h APS组脾内的载菌量高于对照组,其主要机制一是促进了脾脏MΦ对布鲁菌的吞噬,再有就是APS促进了吞噬布鲁菌后腹腔MΦ向脾内的迁移;在感染后12 h开始APS组小鼠脾内的载菌量又显著低于对照组,提示APS可促进脾脏MΦ对布鲁菌的杀死和清除作用。本实验中在感染后的48 h各实验组的载菌量又有所增加,其主要原因与细胞内存活的布鲁菌的繁殖有关,但APS各剂量组的载菌量均低于对照组。
研究表明MΦ的抗布鲁菌感染作用除直接吞噬杀死病原体外,还可通过释放 TNF-α、IL-1、IL-6、IL-12等多种细胞因子,激活树突状细胞;并可提呈抗原、诱导T细胞应答等参与抗感染免疫[6]。TNF-α为机体应激反应产生最早的炎症介质,是启动炎症反应的关键细胞因子[14];MΦ产生的IL-12能诱导T细胞和NK细胞增殖,并诱导其产生IFN-γ,IFN-γ可以显著促进MΦ FcγR的表达,从而提高MΦ的吞噬能力。为了进一步研究APS的免疫调节效应和机制,本文检测了感染后不同时间点小鼠血清中部分细胞因子水平的变化,结果发现在感染后1 h APS组小鼠血清中TNF-α的分泌明显高于对照组;APS组IL-12的分泌在感染后6 h开始明显高于对照组,在48 h达高峰,72 h又开始下降;IFN-γ的分泌则在感染后6 h APS组与对照组出现明显的差异,24 h达高峰,48 h后开始下降。该实验结果提示APS可促进TNF-α和IL-12的分泌,但分泌的时相存在差异。IFN-γ是Th1分化的重要标志性细胞因子,本研究结果提示APS促进了Th1的分化,增强了机体抗布鲁菌的细胞免疫应答。
综上,APS可能通过促进小鼠MΦ对布鲁菌的吞噬和杀伤,并促进TNF-α、IL-12及IFN-γ的分泌,从而在抗布鲁菌感染中发挥重要作用。
[1]Pappas G,Memish ZA.Brucellosis in Middle East:A persistent medical,socioeconomic and political issue [J].J Chemother,2007,19(1):243-248.
[2]吴 梅,谭 睿.黄芪多糖研究进展[J].川北医学院学报,2013,28(1):17-21.
[3]Barrionuevo P,Cassataro J,Delpino MV,et al.Brucella abortus inhibits major histocompatibility complex class II expression and antigen processing through interleukin-6 secretion via Toll-like receptor 2 [J].Infect Immunol,2008,76(1):250-262.
[4]Roop RM ,Gaines JM,Anderson ES,et al.Survival of the fittest:how Brucella strains adapt to their intracellular niche in the host[J].Med Microbiol Immunol,2009,198(4):221-238.
[5]Rambow-Larsen AA,Petersen EM,Gourley CR,et al.Brucella regulators:self-control in a hostile environment[J].Trends Microbiol,2009,17(8):371-377.
[6]王 蓓,戎瑞雪,张雷芳,等.布鲁菌S2株诱导小鼠腹腔巨噬细胞凋亡及免疫激活的研究[J].中国免疫学杂志,2013,29(8),800-804.
[7]Zwerdling A,Delpino MV,Barrionuevo P,et al.Brucella lipoproteins mimic dendritic cell maturation induced by Brucella abortus[J].Microbes Infect,2008,10(12-13):1346-1354.
[8]Diacovich L,Gorvel JP.Bacterial manipulation of innate immunity to promote infection [J].Nat Rev Microbiol,2010,8(2):117-128.
[9]Alavi SM,Alavi L.Treatment of brucellosis:a systematic review of studies in recent twenty years[J].Caspian J Intern Med,2013,4(2):636-641.
[10]邓 旻,陈志明,朱仕兵,等.黄芪多糖诱导脐血单个核细胞向树突状细胞分化的免疫机制研究[J].中华中医药学刊,2011,29(7):1561-1564.
[11]朱 杰,肖 震,沈月爽,等.黄芪多糖通过NF-κB诱导巨噬细胞产生NO和TNF-α[J].中华微生物学和免疫学杂志,2010,30(6):511-515.
[12]邵 珊,王贵平,李春玲,等.黄芪多糖和白花蛇舌草多糖对猪繁殖与呼吸综合征灭活疫苗免疫猪T细胞亚群及抗体水平的影响[J].中国兽医学报,2011,31(8):1196-1199.
[13]刘庆阳,姚咏明.黄芪多糖对分泌白细胞介素12树突细胞亚群的免疫调控效应与机制[J].中华烧伤杂志,2011,27(2):95-99.
[14]Park S,Choi YS,Park SH,et al.Lon mutant of brucella abortus induces tumor necrosis factor-alpha in murine J774.A1 macrophage[J].Osong Public Health Res Perspect,2013,4(6):301-307.