氟西汀在实验性自身免疫性脑脊髓炎中的保护作用研究①
2014-11-27王贵泉张美妮山西医科大学第一医院神经内科太原030001
张 宇 王贵泉 张美妮(山西医科大学第一医院神经内科,太原 030001)
多发性硬化(Multiple sclerosis,MS)是具有轴突损害的一类脱髓鞘性疾病,实验性自身免疫性脑脊髓炎(Experimental autoimmune encephalomyelitis,EAE)为其经典的动物模型。很多研究者更多研究小胶质细胞,认为其在MS发病中起主要作用,而近年来,星形胶质细胞在免疫性疾病中的病理生理作用得到了更多关注。活化的星形胶质细胞产生各种促炎细胞因子和趋化因子,作为直接或间接的免疫介质或炎症介质参与MS病理改变。LCN2是一种脂质运载蛋白,以自分泌和旁分泌的方式由星形胶质细胞分泌,LCN2与星形胶质细胞膜上的受体结合,激活JAK2,使STAT3发生磷酸化,促进CXCL10的生成和星形胶质细胞的活化[1],最终导致脱髓鞘和轴索损害。氟西汀是一种选择性5-羟色胺再摄取抑制剂(Selective serotonin reuptake inhibitors,SSRI),本研究通过观察LCN2、CXCL10在 EAE中的变化,探讨氟西汀的可能保护作用。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组 近交系清洁级8~10周大小健康雌性C57BL/6小鼠80只,体质量18~20 g,购自北京维通利华实验动物技术有限公司。实验小鼠随机分为对照组(健康小鼠)、EAE组、接受紫外线照射模型组(干预组)及氟西汀组。每组均20只。
1.1.2 主要药品与试剂 完全弗氏佐剂(CFA)、髓鞘少突胶质细胞糖蛋白(Myelin oligodendrocyte glycoprotein-35-55,MOG35-55)、兔多克隆抗-LCN2 抗体、生物素化山羊抗兔IgG均购自武汉博士德公司;百日咳毒素购自美国Sigma公司;氟西汀(百忧解)生产厂为Patheon France,分包装厂为礼来苏州制药有限公司。
1.2 方法
1.2.1 紫外线照射[2]紫外线照射2 d前剪除各组小鼠头背部毛发,剪除面积约3 cm×3 cm。紫外线照射波长在280~320 nm。紫外线光源距小鼠头背部无毛发区约20 cm,照射时间为30 s。照射仪器采用Waldmann公司生产的峰值为311 nm窄谱中波紫外线光疗仪(TL01),照射剂量为2 J/cm2,累积照射剂量为60 J/cm2。为了更充分的接受紫外线照射,每只小鼠被放进带有8个隔断的笼子里分别进行照射。对照组和EAE组小鼠仅剪除头背部毛发,不进行紫外线照射。
1.2.2 动物模型的建立、治疗及神经功能评分 紫外线照射后1 h[3],EAE组、干预组及氟西汀组建立EAE动物模型,对照组为健康小鼠。EAE模型制作过程:用生理盐水将MOG35-55稀释成终浓度为3 mg/ml,然后将稀释液与等体积的完全弗氏佐剂混合,用玻璃注射器抽吸成油包水状,制成诱导乳剂。按0.2 ml/只给予模型组及干预组C57BL/6小鼠背部中央偏头侧皮下4点注射诱导乳剂,于免疫后第0天、第2天分别进行腹腔注射百日咳毒素400 ng。致敏当天记为第0天[4]。对照组用生理盐水+CFA代替诱导乳剂。
于模型动物免疫第1天开始并连续给予氟西汀组小鼠氟西汀(10 mg/kg)灌胃;EAE组、对照组和干预组同样于该组动物免疫第1天开始连续给予生理盐水(0.2 ml/d)灌胃,均持续至实验结束。每天称体质量,观察动物行为,并进行神经功能评分。
临床症状评分分5级:正常或无任何神经缺损症状,计为0分;尾部肌张力消失,可见轻度步态笨拙,计为1分;尾部无力,双后肢肌张力低,计为2分;尾部无力,双后肢瘫痪,但给予刺激后可挪动,计为3分;瘫痪累及前肢,伴尿便失禁,计为4分;濒死状态或死亡,计为5分。症状介于两标准之间以±0.5分计。动物出现临床症状即可以认为发病。照射紫外线过程中2只死亡小鼠退出实验。小鼠数量不足按相同方法补足。
1.2.3 组织学观察(1)取材:连续观察60 d后,各组随机抽取6只小鼠脑组织放入4%(质量浓度)多聚甲醛中固定、石蜡包埋、切片。(2)采用HE染色及免疫组织化学染色(具体步骤参见说明书),在Aperio ScanScope扫描仪下分别观察各组脑组织中炎性细胞浸润程度和阳性细胞的分布并计数。免疫组化一抗为兔多克隆抗-LCN2抗体,二抗为生物素化山羊抗兔IgG。一抗稀释浓度为1∶100。
1.2.4 标本采集和CXCL10水平的检测 各组于观察结束后均随机抽取10只小鼠全血,静置30 min后离心(科大创新股份有限公司中佳分公司生产的KDC-40低速离心机,转速:3 000 r/min,离心10 min),留取每只小鼠血清标本约0.3 ml,保存于-80℃冰箱备用。用酶联免疫吸附法测定各组小鼠血清CXCL10水平,操作严格按照试剂盒说明进行。
1.3 统计学处理 采用SPSS17.0软件进行分析。计量资料均采用表示。组间比较采用单因素方差分析,组间两两比较采用LSD法,率的比较采用χ2检验,相关性分析采用Pearson相关系数分析。以P<0.05为差异有统计学意义。
2 结果
2.1 临床症状 EAE组小鼠在免疫后第13~15天发病,免疫后第20~23天发病达高峰,免疫后第28~30天进入慢性期。氟西汀组小鼠临床症状较同期EAE组小鼠明显改善。干预组平均发病时间(22.59±1.121)d,氟西汀组为(42.55±1.508)d,短于氟西汀组(P<0.05);随观察时间延长,小鼠临床症状逐渐加重,氟西汀组发病高峰期神经功能评分(2.273±1.272)低于干预组(3.176±1.015)及EAE组(4.200±0.447)(P<0.05),干预组低于EAE组(P<0.05)。EAE组小鼠全部发病,氟西汀组小鼠发病率(55%)明显低于干预组(85%)和EAE组(100%),差异有统计学意义(P<0.05),见图1。

图1 实验小鼠神经功能评分变化Fig.1 Variance of nerve function grades of experimental mice
2.2 脑组织病理表现
2.2.1 Aperio ScanScope扫描仪下观察HE染色EAE组小鼠脑组织伴有明显的炎性细胞浸润现象,在脑组织主要集中在软膜下和脑室周围白质。EAE组小鼠脑组织中可见血管袖套现象和明显的脑膜炎表现,以单核细胞浸润为主;干预组、氟西汀组中炎性细胞浸润现象明显减少,炎性细胞浸润呈散在性,血管袖套现象消失。随观察时间延长,慢性期小鼠脑组织中可见显著的白质疏松,巨噬细胞和多形核细胞浸润,见图2。

图2 实验小鼠脑中病理表现Fig.2 Representation of brain in experimental mice
2.2.2 脑组织中LCN2的表达情况 各组均有阳性细胞存在,EAE组白质空泡形成、疏松明显,EAE组(57.33±3.670)、氟西汀组(48.00±5.899)和干预组(49.33±5.785)阳性细胞数平均秩次明显高于对照组(13.00±3.742),且具有统计学意义(P<0.05)。氟西汀组和干预组阳性细胞数较EAE组明显减少(P<0.05)。氟西汀组阳性细胞数较干预组无明显变化(P>0.05),见图3。
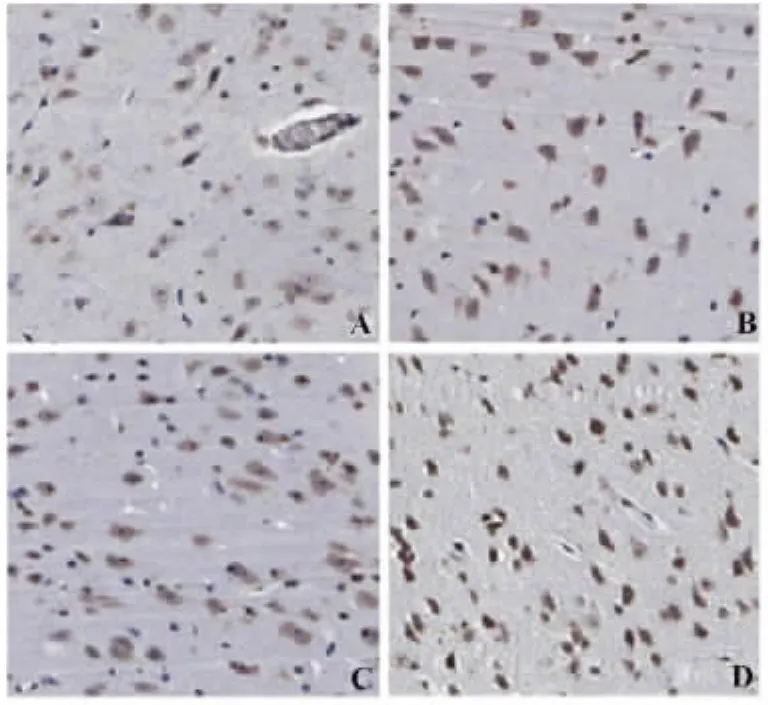
图3 实验小鼠脑组织中LCN2的表达Fig.3 Expression of LCN2 in brain of experimental mice
2.3 C57BL/6小鼠血清CXCL10含量测定 CXCL10含量EAE组高于氟西汀组,氟西汀组高于对照组(P<0.05),见表1。
2.4 EAE组60 d小鼠脑组织中LCN2阳性细胞数平均秩次和血清CXCL10含量相关性分析 EAE组小鼠脑组织中LCN2阳性细胞数平均秩次和血清CXCL10含量之间的相关系数为0.939,双尾检验的概率值为0.005(P<0.01),结果显示二者存在显著的线性相关,见图4。
表1 实验小鼠外周血清中CXCL10的表达()Tab.1 Expression of CXCL10 in the peripheral blood plasma of experimental mice()

表1 实验小鼠外周血清中CXCL10的表达()Tab.1 Expression of CXCL10 in the peripheral blood plasma of experimental mice()
Note:1)P <0.05,vs control group;2)P <0.05,vs fluoxetine group;P >0.05,vs intervention group;3)P <0.05,vs intervention group.
Groups CXCL10 Fluoxetine group 83.69±12.001)3)Intervention group 95.92±10.601)EAE group 97.74±17.641)2)Control group 69.77±12.46

图4 EAE小鼠脑组织LCN2阳性细胞数与血清CXCL10水平相关性分析Fig.4 Correlation between LCN2 immunopositive cells in brain and CXCL10levelinbloodplasmaof EAE mice
3 讨论
MS的病因和发病机制尚不清楚。免疫炎症反应在EAE的发病中起到重要作用,星形胶质细胞作为脑内的免疫效应细胞,促进CNS发生固有免疫应答和适应性免疫应答[5],参与MS的发病。LCN2是一个疏水性分子的结合蛋白,也称作24P3。Lee等[6]研究证实在 CNS,LCN2以自分泌的方式由星形胶质细胞生成,作用是促进细胞形态学的改变和细胞的迁移。Lee等[1]采用DNA微阵列分析方法进一步研究发现LCN2诱导STAT3肽链的丝氨酸和络氨酸进行磷酸化修饰,促进小鼠脑组织中CXCL10的生成,最终导致CNS炎性反应和损伤。因此,LCN2在MS和EAE的发生发展过程中发挥重要作用。
通过本实验研究发现,EAE小鼠病程上表现为急性发作,而非缓解的慢性过程;但可见动物存在部分临床表现恢复现象,与颜津津等[7]报道一致。在HE染色中,EAE小鼠脑组织中伴有大量的炎性细胞浸润,免疫组化结果显示LCN2阳性细胞数较对照组明显升高,且具有统计学意义,表明LCN2表达的增加与EAE的发展有关。EAE组小鼠LCN2阳性细胞数与 CXCL10水平的相关性分析,证实LCN2、CXCL10不仅参与EAE的发病,而且CXCL10表达的增高与LCN2的分泌有关。
在不同种系小鼠和不同造模方法前提下,紫外线的作用是不同的。故本实验采用紫外线照射小鼠,进一步观察其对C57BL/6小鼠的作用。本实验结果显示,干预组小鼠临床症状较EAE组改善,具有统计学意义。组织病理学结果显示炎性细胞浸润现象减少,LCN2阳性细胞数较EAE组减少,有统计学意义,说明紫外线照射可以在临床症状和组织病理学表现方面减轻EAE的发病。但是血清学指标结果显示干预组与EAE组CXCL10表达水平无统计学意义,推测可能是由于紫外线的照射更多的作用于C57BL/6小鼠外周血中其他更敏感的因子,相对而言对CXCL10的影响不大;还有可能是实验小鼠CNS中CXCL10的表达较外周血中更敏感,在CNS该因子降低的幅度较EAE组更明显,更有可能得出有统计学意义。但是本实验中没有更好的反应出来。
氟西汀是一种选择性5-羟色胺再摄取抑制剂,其可通过增加CNS突触间隙中5-羟色胺的浓度而调节免疫功能,发挥髓鞘保护作用[8],还有可能抑制核因子-κB的激活,减少T细胞的激活和炎性因子表达,如肿瘤坏死因子-α和干扰素-γ,还能通过促进cAMP效应元件的磷酸化的激活,增加脑源性神经营养因子的表达[9-11]。本研究结果显示,氟西汀组临床症状明显改善,发病高峰期神经功能评分较EAE组、干预组降低,且具有统计学意义;HE染色炎性浸润减少,CXCL10水平较EAE组、干预组明显减少,具有统计学意义,免疫组化结果显示氟西汀组与干预组LCN2阳性细胞数无统计学意义,但氟西汀组、干预组均与EAE组有统计学意义,说明氟西汀对EAE的保护作用较紫外线照射更明显,证明氟西汀可缓解 EAE进展,与减少 LCN2的分泌有关。
综上所述,LCN2、CXCL10与EAE发病有关,氟西汀可缓解EAE发生、发展,为临床治疗MS提供了新的思路和实验依据。
[1]Lee S,Kim JH,Seo JW,et al.Lipocalin-2 is a chemokine inducer in the central nervous system:role of CXCL10 in lipocalin-2-Induced cellmigration [J].BiolChem,2011,286(51):43855-43870.
[2]Becklund BR,Severson KS,Vang SV,et al.UV radiation suppresses experimental autoimmune encephalomyelitis independent of vitamin D production[J].Proc Natl Acad Sci USA,2010,107(14):6418-6423.
[3]Amor S,Groome N,Linington C,et al.Identification of epitopes of myelin oligodendrocyte glycoprotein for the induction of experimental allergic encephalomyelitis in SJL and Biozzi AB/H mice[J].Immunol,1994,153(10):4349-4356.
[4]焦卓敏,富羽弘,王维治.实验性自身免疫性脑脊髓炎动物模型的比较[J].中国神经免疫学和神经病学杂志,2005,12(5):258-261.
[5]Nair A,Frederick TJ,Miller SD,et al.Astrocytes in multiple sclerosis:a product of their environment[J].Cell Mol Life Sci,2008,65(17):2702-2720.
[6]Lee S,Park JY,Lee WH,et al.Lipocalin-2 is an autocrine mediator of reactive astrocytosis[J].Neurosci,2009,29(1):234-249.
[7]颜津津,黄国祥,肖 波,等.一种慢性EAE模型的制备方法[J].中南大学学报(医学版),2008,33(8):663-668.
[8]Mossner R,Lesch KP.Role of serotonin in the immune system and in neuroimmune interactions[J].Brain Behav Immun,1998,12(4):249-271.
[9]Lim CM,Kim SW,Park JY,et al.Fluoxetine affords robust neuroprotection in the postischemic brain via its anti-inflammatory effect[J].Neurosci Res,2009,87(4):1037-1045.
[10]Fazzino F,Urbina M,Cedeno N,et al.Fluoxetine treatment to rats modifies serotonin transporter and cAMP in lymphocytes,CD4+and CD8+subpopulations and interleukins 2 and 4[J].Int Immunopharmacol,2009,9(4):463-467.
[11]De Foubert G,Garney SL,Robinson CS,et al.Fluoxetine-induced change in rat brain expression of brain-derived neurotrophic factor varies depending on length of treatment[J].Neuroscience,2004,128(3):597-604.