rapsyn基因外显子区多态性与重症肌无力相关性研究①
2014-11-27金权鑫李芳芳张辛轲康荣学李红花金松竹李英信孟繁平
金权鑫 李芳芳 张辛轲 康荣学 王 荣 李红花 金松竹 李英信 孟繁平
(延边大学医学院免疫学与病原生物学教研部,延吉 133002)
重症肌无力(Mysthenia gravis,MG)是以易疲劳和骨骼肌肌肉收缩无力为临床特点的神经肌肉接头处(Neuromuscular junction,NMJ)的疾病。该病的发病机制和多种因素相关,目前研究较为确定的是由抗体介导的自身免疫性疾病[1]。大多数病例是通过对NMJ骨骼肌乙酰胆碱受体(Acetylcholine receptor,AChR)破坏使其数量降低引起。少部分病例是通过对NMJ肌肉特异性受体酪氨酸激酶(Muscle specific receptor tyrosine kinase,MuSK)产生抗体而破坏MuSK引起的[2]。除抗体因素外,环境因素,遗传因素等均可参与MG的发病和病情的发展。
在NMJ的发育过程中,肌细胞膜上的AChR必须聚集在突触后膜上,才能完成神经肌肉的信号传导。在AChR的聚集过程中,由运动神经末梢释放的聚集蛋白(agrin)与其受体 MuSK结合,通过MuSK触发肌细胞膜下另一种蛋白质突触受体相关蛋白(Receptor-associated protein at the synapse,rapsyn),后者与AChR连接,使AChR聚集在突触后膜上,作为乙酰胆碱的受体,开启离子通道,引发动作电位,完成肌肉收缩[3]。在实验性自身免疫性MG的动物模型(EAMG)中已经证明,rapsyn基因的过度表达可防止AChR抗体介导的AChR丢失[4],在先天性肌无力综合征(CMS)患者中,也发现rapsyn的基因突变可导致AChR聚集障碍而引起肌无力,并发现了共同的突变基因[5]。本实验从MG患者外周血中提取基因组DNA并测定rapsyn 8个外显子的基因序列,分析rapsyn基因单核苷酸多态性(SNPs)与MG的相关性。
1 材料与方法
1.1 试剂 全血基因组DNA小量试剂盒购于美国Axygen公司,PCR反应试剂盒购于美国Promega公司。PCR扩增rapsyn的8个外显子基因引物均由大连宝生物公司合成。
1.2 样本 患者组:MG患者132例,无亲缘关系和家族史,汉族,年龄为3.5~73岁,平均年龄44岁,平均病程42个月,来自青岛大学医学院附属医院神经内科、首都医科大学附属北京友谊医院神经内科、温州医科大学附属医院神经内科和延吉市重症肌无力研究所收治的患者。所有患者均符合MG的诊断标准。根据改良 Osserman临床分型[6],Ⅰ型、Ⅱa型、Ⅱb型、Ⅲ型和Ⅳ型均有。正常对照组:共153例,汉族,年龄为20~56岁,平均年龄45岁,均来自延边大学附属医院体检中心。对照组均要求排除自身免疫性疾病及其他慢性疾病。
1.3 方法
1.3.1 样本采集及基因组DNA的提取 根据知情同意原则,对照组和患者组均使用一次性肝素抗凝的真空采血管抽取5 ml肘静脉血,1 500 r/min离心5 min,收集白细胞,于-20°C冰冻保存。按照全血基因组DNA小量试剂盒说明书进行DNA的提取、纯化。
1.3.2 PCR扩增rapsyn 8个外显子基因 应用引物设计软件primer premier 5.0设计用于扩增rapsyn 8个外显子基因的8对引物,并在NCBI上的primer BLAST确定引物的特异性。PCR扩增rapsyn 8个外显子基因的引物序列及其产物长度如表1所示。PCR反应条件:95℃预变性3 min,进入35个循环(94℃变性 1 min,60℃退火 1 min,71℃延伸 1 min)后,再72℃延伸5 min。取5 μl PCR产物经3%琼脂糖凝胶电泳检查以确定条带位置正确。PCR扩增rapsyn 8个外显子基因的引物序列及其产物大小如表1所示。
1.3.3 PCR产物测序和序列分析 PCR产物由上海申涑生物公司直接测序,测序结果采用NCBIBLAST分析。将PCR产物序列与野生型rapsyn基因序列(GenBank No.Z33905)进行比较,分析rapsyn基因8个外显子区SNPs。运用SHEsis在线软件(http://202.120.7.14/analysis/)进行等位基因、基因型频率计算、Hardy-Weinberg遗传平衡检验,进行病例-对照关联分析。
2 结果
2.1 rapsyn 第 1、2、4、5、6、7、8 外显子基因序列经测序发现MG患者组和正常对照组rapsyn第1、2、4、5、6、7、8 外显子基因序列与野生型 rapsyn 相应基因序列完全相同,没有发现突变位点。

表1 PCR扩增rapsyn 8个外显子基因的引物序列及其产物大小Tab.1 Primer sequences and product sizes of rapsyn exons amplified by PCR

表2 MG患者与正常人rapsyn基因新SNP L222R(T>G)等位基因频率和基因型频率比较[n(%)]Tab.2 Genotype and allele frequencies of new SNP L222R(T>G)of rapsyn gene in patients with myasthenia gravis and healthy individuals[n(%)]
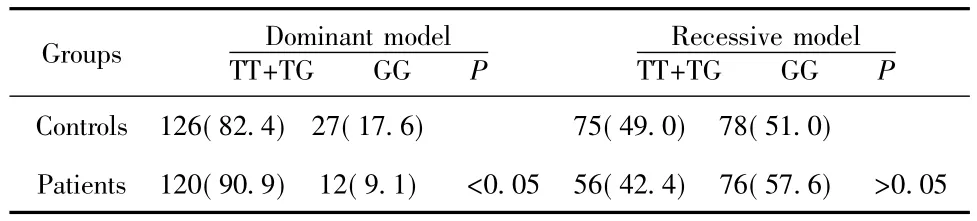
表3 MG患者和正常人rapsyn基因新SNP L222R(T>G)遗传模式分析(%)Tab.3 Analysis of genetic model of new SNP L222R(T>G)of rapsyn gene in patients with myasthenia gravis and healthy individuals(%)
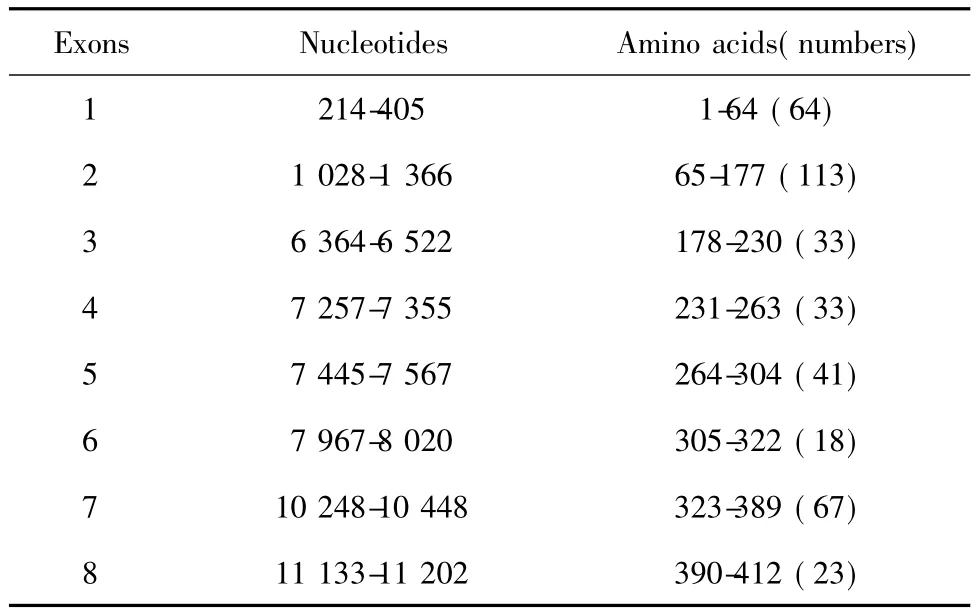
表4 rapsyn基因8个外显子核苷酸和氨基酸位置Tab.4 Places of nucleotides and amino acids in gene of rapsyn exons
2.2 rapsyn第3外显子基因序列 经测序发现MG患者组和正常对照组rapsyn第3外显子基因序列均存在多态位点,第665位碱基T突变成G(T665G),氨基酸序列由相应位置第222位亮氨酸(L)变成精氨酸(R)L222R[CTG>CGG(2)],将测序结果与rapsyn基因dbSNP数据库比对,证明G位点是本次新发现的变异位点,G等位基因频率在MG患者组和对照组分别为33.3%和34.3%(见表2),也满足SNP判断的条件。SNP L222R等位基因频率和基因型频率在病例组和对照组均符合Hardy-Weinberg遗传平衡(P>0.05)。表2统计结果显示,G等位基因频率在患者组和对照组之间无统计学差异(P>0.05),但3种基因型TT、TG、GG在患者组(42.4%V48.5%V9.1%)和对照组(49.0%V33.3%V17.6)存在显著性差异,两组之间差异有统计学意义(P<0.05)。遗传模式分析结果显示,携带GG基因型对照组显著高于患者组(P<0.05),表现为隐性模型特征(见表3)。
3 讨论
rapsyn分子质量为43 kD,由412个氨基酸组成,其 N-端 6~279位氨基酸为 7个 TPR(Tetratricopeptide repeats)区,是直接与MuSK的细胞内功能区结合部位[6],TPR7区后还存在一个CC(Coiled-coil domain)区,是与AChRα亚单位的结合区。因此,rapsyn的7个 TPR区和 CC区在诱导AChR聚集过程中极为重要。rapsyn的基因位于第11号染色体上,由8个外显子编码。其基因序列起始为47459314~47470729,共11 416个碱基,共有8个外显子,7个内含子,其基因结构(NCBI.NC_000011.Reports Homo sapiens chrogi:51511727)如表4所示。
rapsyn与肌肉收缩无力之间的关系的研究最近几年才开展起来,还未见到rapsyn与MG相关性研究的报道。在MG动物模型的研究中发现,rapsyn在大鼠肌肉中的过度表达,可以抵抗AChR抗体对大鼠MG的诱导[4]。在先天性肌无力综合征患者中,如果不是由于AChR各亚单位的基因突变引起的,往往可以检测到rapsyn基因突变,而且最常见的突变是 N88K(位于 TPR3 区)、L14P、G130E[5,7,8]。rapsyn基因突变后表达减少或稳定性降低,诱导AChR聚集能力下降[9]。这使AChR更易遭受免疫因素(如AChR抗体)的攻击,因此,rapsyn基因突变可能与MG的敏感性及疾病临床严重程度相关联,并可以解释为什么有些MG患者实验室检查AChR抗体含量很低,而患者的临床症状却很严重。
完整的rapsyn是由多个基因拼接而成,只有从肌肉组织中才能获得完整的rapsyn cDNA。MG患者由于肌肉组织来源有限,因此从患者外周血白细胞染色体DNA中扩增rapsyn基因的8个外显子。在NCBI SNPs数据库中寻找rapsyn基因资料,发现其8个外显子中共存在91个突变位点。在本实验所测得的132例MG患者中,rapsyn基因的第1、2、4、5、6、7和8外显子均未发现突变位点。在先天性肌无力综合征患者中常见的突变位点N88K(位于第 2 外显子)[5]、L14P(位于第 1 外显子)[7]、G130E(位于第2外显子)[8]在本项检测的患者中也未发现有突变。在正常对照组中也未发现突变位点,表明这些突变位点不是本次检测的中国汉族人群的SNPs。在rapsyn基因的第3外显子中的 L222R[CTG>CGG(2)]或T665G,正常对照组153人有78例发生碱基突变,等位基因G基因频率为34.3%。MG患者组132人有76例发生碱基改变,等位基因G基因频率为33.3%,满足SNP判断的条件。与rapsyn基因dbSNP数据库比对证明,L222R[CTG>CGG(2)]或T665G为本次新发现的SNP。其等位基因频率和基因型频率在患者组和对照组均符合Hardy-Weinberg遗传平衡,证明本次研究选择的样本具有群体代表性。由于TT、TG和GG 3种基因型在患者组和对照组存在显著性差异,即rapsyn基因SNPs与MG存在相关性,为了进一步分析rapsyn基因SNP L222R在疾病发生中的遗传模式,我们进行了显性和隐性遗传模式比较,结果表现为隐性模型特征,提示rapsyn基因SNP L222R中G等位基因可能是MG的保护因子。目前我们正在进行这一突变的氨基酸导致的rapsyn结构改变以及可能引起的功能变化方面的研究,以解释其对MG的保护机制。
遗传因素中易感基因对MG的影响已引起国内外研究者们的关注,近年来研究较多的MG易感的相关基因有雌激素受体(ESR-1)[10]、糖皮质激素受体(GR)[10]、维生素 D 受体(VDR)[12]、蛋白酪氨酸磷酸酶非受体型 22(PTPN22)[13,14]、转化生长因子β(TGF-β)[15,16]等,有些基因已经证明与 MG 相关,有些则不相关。rapsyn基因突变与MG患者发病、病情严重程度及进展之间到底存在何种相关的关系尚不清楚,但是随着技术水平的不断提高与大量实验研究的不断进展,更多的与MG相关性的基因新位点将被发现。
致谢:作者非常感谢青岛大学医学院附属医院神经内科李海峰教授、首都医科大学附属北京友谊医院神经内科谢琰臣教授和温州医科大学附属医院神经内科张旭教授为本实验提供重症肌无力患者血液样本。
[1]Cavalcante P,Cufi P,Mantegazza R,et al.Etiology of myasthenia gravis:innate immunity signature in pathological thymus[J].Autoimmun Rev,2013,12(9):863-874.
[2]Witoonpanich R,Dejthevaporn C,Pulkes T,et al.Prevalence,clinical features and treatment outcomes of patients with myasthenia gravis positive for antibodies to muscle-specific kinase in Thailand[J].J Clin Neurosci,2013,20(5):707-709.
[3]Antolik C,Catino DH,Resneck WG,et al.The tetratricopeptide repeat domain of rapsyn bind directly to cytoplasmic sequences of the muscle-specific kinase[J].Neuroscience,2006,141:87-100.
[4]Losen M,Stassen MH,Martinez-Martinez P,et al.Increased expression of rapsyn in muscles prevents acetylcholine receptor loss in experimental autoimmune myasthenia gravis[J].Brain,2005,128:2327-2337.
[5]Burke G,Cossins J,Maxwell S,et al.Distinct phenotypes of congenital acetylcholine receptor deficiency[J].Neuromuscul Disord,2004,14:356-364.
[6]Ramarao MK,Bianchetta MJ,Lanken J,et al.Role of rapsyn tetratricopeptide repeat and coiled-coil domains in self-association and nicotinic acetylcholine receptor clustering[J].J Biol Chem,2001,276:7475-7483.
[7]Maselli RA,Dunne V,Pascual-Pascual SI,et al.Rapsyn mutations in myasthenic syndrome due to impaired receptor clustering[J].Muscle Nerve,2003,28:293-301.
[8]Ono F,Shcherbatko A,Higashijima S,et al.The Zebrafish motility mutant twitch once reveals new roles for rapsyn in synaptic function[J].Neurosci,2002,22:6491-6498.
[9]Cossins J,Burke G,Maxwell S,et al.Diverse molecular mechanisms involved in AChR deficiency due to rapsyn mutations[J].Brain,2006,129:2773-2783.
[10]Pal Z,Gal A,Remenyi V,et al.Oestrogen receptor alpha geneintronic polymorphisms and autoimmune myasthenia gravis in Cauasian women[J].Neuromuscul Disord,2009,19(12):822-824.
[11]王莉莉,谢琰臣,侯世芳,等.糖皮质激素受体基因多态性与重症肌无力的关系[J].中华医学杂志,2009,89(43):3035-3037.
[12]王梓炫,李海峰,孙 亮,等.散发性重症肌无力患者267例维生素D受体基因多态性[J].中华神经科杂志,2011,44(7):473-478.
[13]Nong LM,Ren KW,Xu NW,et al.1858 C/T polymorphism of the protein tyrosine phosphatase nonreceptor 22 gene and rheumatoid arthritis risk in europeans:a meat-analysis[J].Arch Med Res,2011,42(8):698-702.
[14]Hüffmeier U,Steffens M,Burkhardt H,et al.Evidence for susceptibility determinant(s)to psoriasis vulgaris in or near PTPN22 in German patients[J].J Med Genet,2006,43(6):517-522.
[15]Garber K.Companies waver in efforts to target transforming growth factor beta in cancer[J].J Natl Cancer Inst,2009,101(24):1664-1667.
[16]Das J,Ren G,Zhang L,et al.Transforming growth factor beta is dispensable forthe molecularorchestration ofTh17 cell differentiation[J].J Exp Med,2009,206(11):2407-2416.
