硝酸镧对2型糖尿病大鼠胰腺 INSR、IRS1和细胞凋亡影响的实验研究①
2014-11-27李冬梅黄可欣马洪喜长春大学特殊教育学院长春130022
李冬梅 黄可欣 马洪喜(长春大学特殊教育学院,长春 130022)
2型糖尿病(DM2)是目前全世界增长最快的疾病之一,多在35~40岁之后发病,占糖尿病患者90%以上,它是一种多因子疾病,由环境因素和遗传因素双方决定[1]。国内外研究报道,DM2在外围组织中胰岛素抵抗性存在差异,胰腺β细胞胰岛素分泌的破坏也存在差异,这两种异常存在交互作用是DM2的发病机制之一[2,3]。目前稀土元素的应用蓬勃发展,已扩展到科学技术的各个方面,特别是在医学领域,已证实较低剂量的稀土化合物经口服,腹腔注射及尾静脉注射可降低血糖水平及升高胰岛素水平[4,5]。本实验通过建立 2型糖尿病大鼠模型,检测口服硝酸镧(0.2 mg/kg)对糖尿病大鼠胰腺胰岛素受体(INSR)、胰岛素受体底物1(IRS1)和细胞凋亡的影响,旨在探讨硝酸镧对糖尿病大鼠胰腺组织的保护作用机制。
1 材料与方法
1.1 实验动物及主要试剂 健康雄性Wistar大鼠50只,体质量为(160.5±8.5)g由吉林省药品检验所提供(动物合格证号960101032);实验用“硝酸镧”用生理盐水稀释成相应浓度,由全国农用稀土研究中心提供;链脲佐菌素(STZ)购于美国Sigma公司;ELISA试剂盒购于南京建成生物有限公司;兔抗鼠一抗 INSR和 IRS1购于 Santa Crus公司;TUNEL凋亡试剂盒购于北京中杉生物有限公司。
1.2 糖尿病模型制备 将40只Wistar雄性大鼠高脂高糖饲料喂养,8周后,腹腔注射链脲佐菌素(STZ,30 mg/kg)以诱导2型糖尿病模型,48 h后采尾血测空腹血糖,浓度大于16.7 mmol/L为模型复制成功,该模型成功31只。
1.3 实验分组及给药 取未造模的10只动物做正常对照组,造模成功的31只动物随机分为糖尿病模型组(16只)、硝酸镧给药组(15只),硝酸镧给药组每日灌胃硝酸镧0.2 mg/kg,正常对照组及糖尿病对照组均每日给予等剂量生理盐水,连续给药1个月。在实验过程中糖尿病模型组动物死亡5只、硝酸镧给药组动物死亡2只。
1.4 标本收集 各组动物在实验结束后次日清晨摘取眼球取血,然后迅速处死取出胰腺固定于10%中性福尔马林液中,每组随机取10个胰腺组织,常规石蜡包埋,切成4微米切片4张,分别进行HE、免疫组化和TUNEL染色。
1.5 指标检测
1.5.1 各组大鼠血糖、胰岛素的检测 血糖采用美国强生血糖仪测定;胰岛素采用放免法测定。
1.5.2 各组大鼠血清中INSR、IRS1蛋白含量的测定 采用酶联免疫法,操作严格按照说明书步骤。
1.5.3 各组大鼠胰腺组织中INSR、IRS1蛋白阳性强度的检测 采用免疫组化SP法,光镜下观察见棕黄色为阳性表达,结果分析采用Motic Images Advanced 3.2图像分析系统测灰度值,灰度值越低,蛋白含量越高。
1.5.4 各组大鼠胰腺组织中细胞凋亡率的检测 采用TUNEL凋亡试剂盒,操作严格按照说明书步骤。
1.5.5 各组大鼠胰腺组织的病理学检测 采用HE染色,光学显微镜下观察。
1.6 统计学分析 采用SPSS13.0软件进行统计学分析,实验数据均以表示,采用t检验,检验标准α=0.05。
2 结果
本实验过程中大鼠的一般状态:对照组大鼠体重明显增加、精神活泼、皮毛有光泽、反应度灵敏。糖尿病组大鼠明显消瘦、精神萎靡、皮毛无光泽且反应迟钝。硝酸镧治疗组大鼠体重略增加、精神状态较佳、皮毛有光泽、反应度较对照组略差,但明显好于糖尿病组。
2.1 各组大鼠血中血糖和胰岛素水平的比较 与正常对照组比较,糖尿病模型组大鼠血中血糖水平明显升高、胰岛素水平明显降低差异有统计学意义(P<0.01);硝酸镧治疗组大鼠血中血糖水平略升高、胰岛素水平略降低差异有统计学意义(P<0.05);见表1。
2.2 各组血清中INSR和IRS1的蛋白含量的比较
与正常对照组比较,糖尿病模型组大鼠血清中INSR和IRS1的蛋白含量明显降低差异有统计学意义(P<0.01);硝酸镧治疗组大鼠血清中INSR和IRS1的蛋白含量略降低差异有统计学意义(P<0.05);见表1。
2.3 各组大鼠胰腺组织的病理改变 光镜下可见对照组大鼠胰腺组织排列紧密、饱满、胰岛体积大,糖尿病模型组大鼠胰腺组织排列较为疏散、胰岛体积较小,硝酸镧组大鼠胰腺组织基本紧密、较为饱满、胰岛体积略小;采用Motic Images Advanced 3.2图像分析系统半定量分析测胰岛体积(连续5个视野):公式=1/2长径×短径2。见表2、图1。
2.4 各组胰腺组织中INSR和IRS1的蛋白阳性强度的比较 与正常对照组比较,糖尿病模型组大鼠胰腺组织中INSR和IRS1的蛋白阳性表达水平明显降低差异有统计学意义(P<0.01);硝酸镧治疗组大鼠胰腺组织中INSR和IRS1的蛋白阳性表达水平略降低差异有统计学意(P<0.05);蛋白阳性强度采用Motic Images Advanced 3.2图像分析系统半定量分析:测灰度值,灰度值越低,蛋白含量越高。见表2,图1、2。
2.5 各组胰腺组织中细胞凋亡率的比较 与正常对照组比较,糖尿病模型组大鼠胰腺组织中细胞凋亡率明显升高差异有统计学意义(P<0.01);硝酸镧治疗组大鼠胰腺组织中细胞凋亡率略升高差异有统计学意义(P<0.05);细胞凋亡率采用Motic Images Advanced 3.2图像分析系统半定量分析:测灰度值,灰度值越低,凋亡百分率越高。见表2,图3。
表1 各组血糖、胰岛素、INSR和IRS1蛋白含量的比较(,n=10)Tab.1 Comparision of blood suger,insulin,protein contents of INSR and IRS1 in different groups(,n=10)

表1 各组血糖、胰岛素、INSR和IRS1蛋白含量的比较(,n=10)Tab.1 Comparision of blood suger,insulin,protein contents of INSR and IRS1 in different groups(,n=10)
Note:Compared with control,1)P < 0.01;Compared with control,2)P < 0.05.
Groups Blood suger(mmol/L) Insulin(mmol/L) INSR(ng/ml) IRS1(ng/ml)0.85 Diabetic model 18.15±2.071) 3.27±0.511) 2.01±0.491) 2.17±0.381)La(NO3)3treatment 6.01±0.942) 6.16±0.682) 3.48±0.522) 3.85±0.722)Control 4.83±0.76 7.22±0.83 4.29±0.36 4.74±
表2 各组大鼠胰腺组织INSR和IRS1蛋白表达、细胞凋亡率及胰岛体积的比较(,n=10)Tab.2 Comparision of protein expression of INSR and IRS1,apoptosis rate and islet volume in pancreas tissue in different groups(,n=10)

表2 各组大鼠胰腺组织INSR和IRS1蛋白表达、细胞凋亡率及胰岛体积的比较(,n=10)Tab.2 Comparision of protein expression of INSR and IRS1,apoptosis rate and islet volume in pancreas tissue in different groups(,n=10)
Note:Compared with control,1)P < 0.01;Compared with control,2)P < 0.05.
Groups Islet volume(mm3) INSR(Grey value) IRS1(Grey value) Apoptosis rate(%)17.52±1.47 Diabetic model 2.67±0.491) 154.65±4.571) 162.51±4.691) 72.13±5.261)La(NO3)3treatment 8.92±1.252) 127.49±3.182) 132.16±2.922) 32.13±2.122)Control 10.53±1.01 103.15±3.24 114.27±2.83
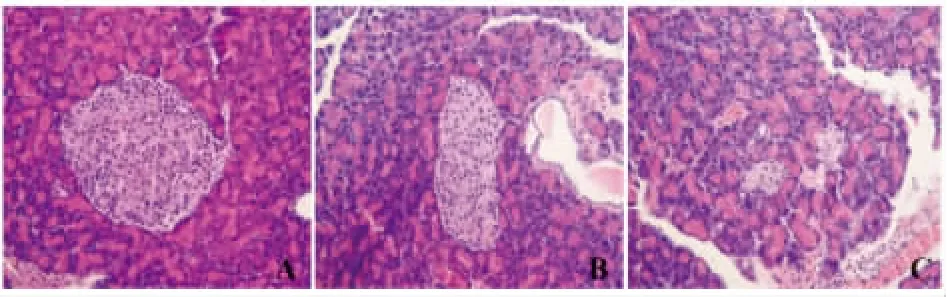
图1 胰腺组织的病理改变(HE染色,×200)Fig.1 Histopathological changes in pancreas tissue(HE staining,×200)
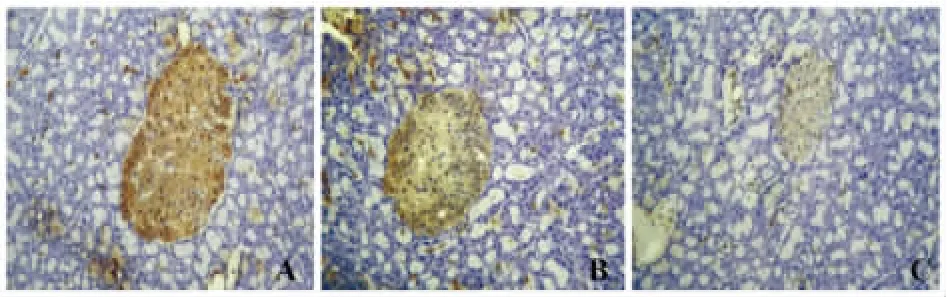
图2 胰腺组织中INSR的表达(免疫组织化学染色,×200)Fig.2 INSR expression in pancreas tissue(Immunohistochemical staining,×200)
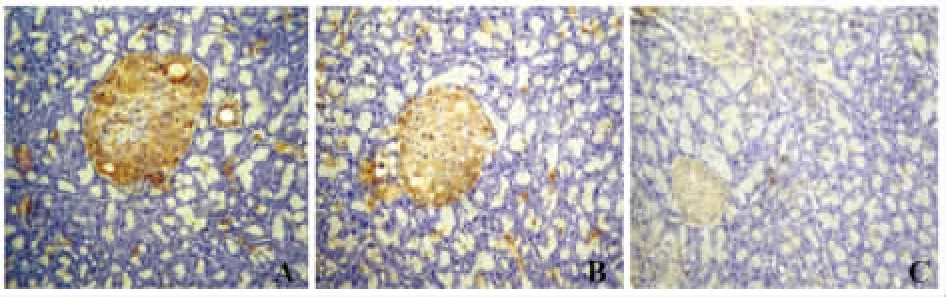
图3 胰腺组织中IRS1的表达(免疫组织化学染色,×200)Fig.3 IRS1 expression in pancreas tissue(Immunohistochemical staining,×200)

图4 胰腺组织中细胞凋亡的表达(免疫组织化学染色,×200)Fig.4 Apoptosis expression in pancreas tissue(Immunohistochemical staining,×200)
3 讨论
机体在高血糖和高游离脂肪酸的刺激下,自由基大量生成,进而启动氧化应激;氧化应激信号通路的激活会导致胰岛素抵抗、胰岛素分泌受损;糖尿病时胰岛素抵抗可以先于糖尿病发生,当胰岛素抵抗增强时血糖开始升高;高血糖加重氧化应激,也激活应激敏感信号途径,从而又加重胰岛素抵抗[6,7]。β细胞也是氧化应激的重要靶点,β细胞内抗氧化酶水平较低,故对氧化应激较为敏感,其直接损伤胰岛β细胞,促进β细胞凋亡,还可通过影响胰岛素信号转导通路间接抑制β细胞功能,导致胰岛素分泌水平降低、血糖水平上升,对细胞造成显著的损害[8]。
胰岛素受体底物(IRS)属细胞内糖蛋白,胰岛素与胰岛素受体α亚基结合后能引起IRS多个酪氨酸残基磷酸化;磷酸化的IRS蛋白结合并激活含有肉瘤同源结构域的蛋白质,从而启动级联信号,进而激活下游介导代谢反应、细胞生存、生长和分化的多重效应分子;因此IRS是胰岛素受体信号在胞内传导的重要成分,在胰岛素抵抗中起重要作用[9]。胰岛素受体底物1是首先被发现的IRS,无跨膜结构,为一种信号传导蛋白,广泛分布于胰岛素敏感组织细胞浆内,在胰岛素信号转导途径中发挥着重要作用[10]。IRS-1主要存在于骨骼肌,胰腺、脂肪、肝脏等处也有表达,大量研究认为胰岛素靶组织细胞内IRS-1蛋白水平的高低及结构和功能状态是胰岛素信号转导的基础,当表达降低或IRS-1结构、活性发生异常时,胰岛素在细胞内转导就会受到阻滞[11]。IRS-1介导胰岛素在外周组织代谢、细胞的增殖分化效应中起重要作用;同时IRS-1还具有一定的调节胰岛β细胞分泌胰岛素的作用[12]。引起胰岛细胞功能障碍的原因比较复杂,细胞凋亡是DM2胰岛β细胞数量减少的主要原因,凋亡引起的胰岛β细胞数量减少足以致高血糖。大量的研究显示胰岛β细胞的高水平凋亡在糖尿病发生前就已存在,糖尿病发生后,凋亡水平进一步增高,胰岛β细胞的凋亡可能是导致DM2发生、发展的一个重要因素[13]。DM2时有多种因素可诱导胰岛β细胞凋亡,同时胰岛素受体(INSR)和IRS1是胰岛素信号转导通路中的重要介质,因此导致胰岛功能受损,胰岛素信号转导障碍在胰岛素抵抗和2型糖尿病的形成过程中起到了非常关键的作用[14]。
糖尿病发病机制十分复杂,至今仍未完全阐明。随着稀土微肥的广泛应用,稀土元素通过食物链进入机体内[15]。依据INSR、IRS1和细胞凋亡在糖尿病发病中的相互机制,本实验通过建立DM2大鼠模型,观察硝酸镧对糖尿病大鼠INSR、IRS1和细胞凋亡的影响,实验发现:形态学观察可见对照组大鼠胰腺组织排列紧密、饱满、胰岛体积大;糖尿病模型组大鼠胰腺组织排列较为疏散、胰岛体积较小;硝酸镧组大鼠胰腺组织基本紧密、饱满、胰岛体积略小。免疫学观察与正常对照组比较,糖尿病模型组大鼠血中血糖及胰腺组织中细胞凋亡率明显升高、血中胰岛素、INSR和IRS1的蛋白含量及胰腺组织中INSR和IRS1的蛋白阳性表达水平明显降低差异有统计学意义(P<0.01);硝酸镧治疗组大鼠血中血糖及胰腺组织中细胞凋亡率略升高、血中胰岛素、INSR和IRS1的蛋白含量及胰腺组织中INSR和IRS1的蛋白阳性表达水平略降低差异有统计学意义(P<0.05)。提示:硝酸镧可通过下调糖尿病大鼠血糖水平、抑制胰腺组织的细胞凋亡,上调胰腺组织INSR和IRS1的水平及胰岛素水平,对糖尿病大鼠胰腺组织有一定的保护作用。
[1]孙晓芳,赵长勇,陈 晖,等.高糖高脂饮食加链尿佐菌素建立实验性大鼠2型糖尿病模型[J].南京医科大学学报(自然科学版),2009,29(6):797-800.
[2]Olckers A,Layh K,Towers GW,et al.Protective effect against type 2 diabetesm ellitus identified with in the ACDC gene in a black south African diabetic cohort[J].Metabolism,2007,56(5):587-592.
[3]谢利芳,许志华,郭凯霞.2型糖尿病胰岛素抵抗研究进展[J].科学技术与工程,2010,10(15):3664-3667.
[4]陈 曦,聂毓秀,周 莉,等.低剂量氯化镨对体外培养大鼠胰岛β细胞分泌胰岛素的影响[J].中国稀土学报,2001,19(3):254-256.
[5]黄可欣,马洪喜,石 博,等.低剂量混合稀土常乐对大鼠血清胰岛素及肝细胞糖原的影响[J].环境与健康杂志,2007,24(6):403-405.
[6]Abel ED,Peroni O,KM JK,et al.Adipose-selective targeting of the GLUT4 gene impairs insulin action in muscle and liver[J].Nature,2001,409(6821):729-733.
[7]IaIatrakis G,Tsionis C,Adonakis G,et al.Polycystic ovarian syndrome,insulin resistance and thickness of the endometrium[J].Eur J Obstet Gynecol Reprod Biol,2006,127(2):218-221.
[8]刘红樱,胡齐鸣.黄连素对2型糖尿病(湿热内蕴型)胰岛β细胞功能的影响[J].中国中医药信息杂志,2008,15(3):12-14.
[9]蔡 辉,袁爱红,魏群利,等.针刺对2型糖尿病大鼠脂肪组织INSR基因表达的影响[J].安徽中医学院学报,29(2):36-39.
[10]袁爱红,刘志诚,魏群利,等.针刺对2型糖尿病大鼠肝组织IRS-1基因表达的调节[J].中国老年学杂志,2009,29(7):821-823.
[11]Wiedmann M,Tamaki S,Silberman R,et al.Constitlutive over-ex-pression of the insulin receptor subst ratel causes functional upregulation of Fas receptor[J].J Hepatol,2003,38(6):803-810.
[12]舒 适,刘小美,宋丽娜,等.小聚碱对2型糖尿病大鼠IRS-1/-2、p85 基因表达的影响[J].浙江中医杂志,2009,44(4):254-257.
[13]Gual P,Le Marchand-B rustel Y,Tanti JF,et al.Positive and negative regulation of insulin signaling through IRS-1 phosphory lation[J].Biochimie,2005,87(1):99-109.
[14]Fasshauer M,Klein J,Kriauciunas KM,et al.Essential role of insulin receptor substrate 1 in differentiation of brown adipocytes[J].Mol Cell Biol,2001,21(1):319-329.
[15]汪 伟,李冬梅,李 锐,等.口服低剂量混合稀土"常乐"对糖尿病大鼠心肌NF-KB和TNF-α表达的影响[J].毒理学杂志,2013,27(4):284-287.
