飞秒激光直写生物凝胶模板原位合成纳米粒子
2014-11-26刘东旭孙允陆陈岐岱董文飞
刘东旭,夏 虹,孙允陆,陈岐岱,董文飞
(吉林大学集成光电子国家重点联合实验室,吉林长春130012)
1 引言
聚合物微结构在光子学[1]、微流变学[2]、组织工程[3]和生物分子分析工程[4]等领域有广泛的应用。它们的性能与其形状,尺寸以及化学性质密切相关。例如,作为载体应用于载药工程的聚合物颗粒[5],其流动性,分解性和被吞噬能力取决于它们的几何形状和尺寸[6]。通过改变聚合物结构的形状和组分[7-9],可以高效地修饰其扩散、悬浮流变性、自组装等特性。因此,亟须开发新型制备工艺来实现具有不同形状和化学性能的聚合物微结构[10-11],如低表面粗糙度及三维任意可控几何形状的聚合物微纳结构。采用拉伸聚合物微结构[12]、非浸润模板的复制[13]、光刻[14]和微流体[2,15]等传统方法,能够连续制备具有多种形貌和化学性质的聚合物微结构。然而这些方法往往只局限于简单的规则图形或二维结构,如何实现聚合物微结构的三维加工是相关领域的研究重点。
飞秒激光直写是一种新兴的先进微加工方法,基于多光子吸收原理,它可以制备任意复杂形状和低于衍射极限尺寸的三维结构[16]。因此,其在聚合物微加工中具有不可替代的优势。然而,由于聚合物修饰组分的加入(如加工溶液中混有固态的功能性纳米粒子),会导致激光在聚焦区域的散光,严重影响加工效果。
为了解决以上问题,本文介绍了一种飞秒激光直写与原位纳米粒子合成相结合的方法,先由飞秒激光直写掺有功能液体组分的加工溶液,制备出具有特定结合位点的水凝胶模板,然后进行原位纳米粒子合成,成功制备了具有几十μm量级尺寸和10 nm量级粗糙度同时具有三维复杂形貌和特定化学性质的水凝胶微结构。
2 材料与方法
2.1 实验试剂和仪器
实验所需试剂:低聚物聚乙二醇二丙烯酸酯(Mn=575 g/mol),丙烯酸(AA)和光引发剂亚甲基蓝(MB),Tween 20购自美国 Sigma-Aldrich公司,FeCl3,AgNO3,NaOH,氨水(NH4OH)购自北京化工有限公司。实验中所用超纯水由Threestage Milli-Q Plus 185系统净化,电阻率为18.2 MΩ·cm。所有化学品均直接使用,不需要进一步提纯。
实验所需仪器:钛蓝宝石飞秒激光振荡器Femtosecond laser(Spectra Physics 3960-X1BB),泵浦光源波长532 nm,功率7.3 W,稳定输出功率1.4 W,重复频率 80 MHz,输出脉冲 120 fs,波长800 nm,单脉冲能量20 nJ。紧聚焦油浸加工物镜,NA=1.35,60×。压电平台 PZT(Physik InstrumenteP-622ZCD)。数 字 摄 像 头 CCD(DV100,10 Moons)。
2.2 飞秒激光加工原理
飞秒激光加工基于多光子吸收原理,主要为双光子吸收过程。这一过程的预言首先由Maria GEppert-Mayer在 1931 年从理论上提出[17],其取决于光强度的非线性。发生多光子吸收的基本条件是一次吸收两个或更多的光子,因此可以通过一个紧聚焦的油浸显微物镜将超快激光光束汇聚,焦点体积内的材料发生光化学或光物理过程而进行局域化的转变。通过移动焦点在材料中的位置可以实现三维加工。此外,调节加工阈值能够使加工精度突破衍射极限,从而达到亚100 nm的分辨率。
2.3 生物凝胶模板的制备
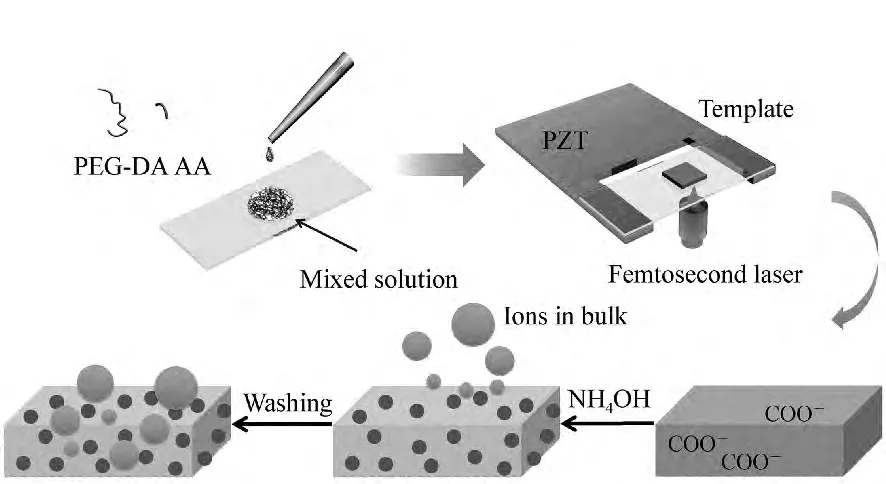
图1 实验示意图Fig.1 Scheme of the laser fabrication
如图1所示,将质量分数为62.5%聚乙二醇二丙烯酸酯,12.5%丙烯酸,0.075%亚甲基蓝溶于超纯水中,在25℃的水浴中超声5 min,使得所有的化学组分分散均匀,制成激光加工预聚物溶液。然后用量程为100 μL的移液枪量取20 μL预聚物溶液滴于24 mm×50 mm规格的盖玻片上。在使用前此盖玻片需经过严格的清洗。先是用丙酮、乙醇、去离子水各清洗15 min,然后在烘干箱中烘干5 min,并在盖玻片上用无色玻璃胶圈出5 mm×5 mm大小的区域,方便固定加工溶液以及后期表征。
将紧聚焦油浸加工物镜(NA=1.35,60×)固定在压电平台底部,用注射器吸取松柏油滴在加工物镜镜头上,然后将有加工预聚物溶液的盖玻片放在压电平台上,调节Z轴方向的机械旋钮,使得盖玻片与镜头之间的距离适中,方便调节激光光斑。选取适当的激光加工参数,制备出生物凝胶模板。
2.4 原位合成纳米粒子
如图1所示,将激光加工后的盖玻片取下,用擦镜纸擦去盖玻片底部的松柏油,然后置于60 mm×30 mm规格的称量瓶中(由于加工后的结构聚合成固体,相当于光刻胶中的负胶,因此洗去未聚合溶液的过程称为显影),在去离子水中显影20 min,并用水漂洗。充分显影后的生物凝胶模板置于0.5 mol/L氢氧化钠溶液中10 min,使COOH基团变成 COO-基团,然后用0.5%Tween 20溶液清洗5次以达到中性pH值。
0.2 mol/L FeCl3溶液和1 mol/L AgNO3溶液是在氮气保护的条件下制备的。将金属盐溶液滴加到生物凝胶模板上,约30 min,使金属离子和COO-基团充分螯合。随后用氨水调节pH至适当值,并用0.5%Tween 20溶液清洗5次。
2.5 实验表征
本实验使用场冷发射扫描电子显微镜JSM 7500(JEOL,Tokyo,Japan)进行微结构的形貌表征。加速电压为 5.0 keV,溅射金层厚度为10 nm,工作模式 SEM,WD 8 mm。能谱仪 EDS(JSM 7001F能量色散X射线分析)表征金属纳米粒子。光学显微镜型号为Motic BA400。
3 结果与讨论
3.1 溶液组分对生物凝胶模板的影响
为了保证聚合物微结构的生物相容性,选择生物相容性极好的聚乙二醇二丙烯酸酯作为主体材料,吸收峰在紫外光区的亚甲基蓝作为光敏剂,同时通过加入丙烯酸在聚合物微结构中引入COOH基团,而COOH基团的引入导致溶液激光加工性能变差。聚丙烯酸是强吸水材料,在自由基聚合时会强烈吸水而导致单点曝光形成的像素点膨胀变形,从而不能得到程序设定的结构。因此,需要减少丙烯酸在溶液中的比重。在本工作中通过先用只含有聚乙二醇二丙烯酸酯的溶液进行参数优化,在最优的配比条件下,固定预聚物的含量,然后逐渐增加丙烯酸组分比例的办法,使得结构在形貌可以接受的情况下,得到最多的COOH基团(即溶液组分中丙烯酸含量最大值)。
图2是溶液组分优化后的生物凝胶模板,此时聚乙二醇二丙烯酸酯为62.5%,丙烯酸为12.5%,亚甲基蓝为0.075%。生物凝胶模板的结构完整性和精细程度都较好,而COOH基团的含量也足够多。

图2 复杂结构的生物凝胶模板Fig.2 Complex structure of biological gel template
3.2 激光参数对生物凝胶模板的影响
生物凝胶模板的制作是采用飞秒激光直写的方式,通过单点曝光形成单个像素点叠加成所设计的结构[18]。因此,影响单个像素点的激光条件参数将直接影响生物凝胶模板的表面形貌和结构完整程度。高的激光功率和长的单点曝光时间都使单个像素点充分曝光,有利于形成致密的结构,然而它们却存在不同,尽管长的单点曝光时间加工的效果更好,但将会导致整个加工过程耗时量增加,不利于快速制备结构。大的激光功率往往因为超过加工阈值而使热效应显著,导致结构变差甚至失效。因此,通过固定单一变量法,来优化加工参数“窗口”,对应点间距为100 nm的结构,单点曝光时间最优参数在100~400 μs之间,激光功率在16~28 mW之间。
3.3 Fe纳米粒子的原位合成

图3 生物凝胶模板进行铁纳米粒子原位合成前后的能谱仪表征((a)~(f))分别为未进行原位合成时电镜照片及C、O、Si、Fe的分布情况((g)~(i))分别为原位合成后电镜照片及 C、O、Si、Fe的分布情况Fig.3 EDS characterization before and after the iron nanoparticles in-situ synthesis in the bio-gel template((a)~ (f)),the SEM image and the distribution of the elements of C,O,Si and Fe before in-situ synthesis((g)~(i))The SEM image and the distribution of the elements of C,O,Si and Fe after in-situ synthesis
图3是飞秒激光直写后的方块形生物凝胶模板对Fe纳米粒子的原位合成。图3(a)~3(f)是未经过原位合成的生物凝胶模板的能谱仪表征。图3(a)为SEM图像,可以看到未经过原位合成的生物凝胶模板表面光滑平整,内部插图为不同颜色分别代表C、O、Si、Fe等元素。图3(b)整体颜色分布图,图3(c)为C元素分布,由于生物凝胶为有机物,因此有C元素呈明显的方形分布。而图3(d)为O元素分布,由于凝胶模板加工在盖玻片上,盖玻片主要成分为SiO2,因此O元素在这个图中都有分布,而生物凝胶模板中有聚乙二醇二丙烯酸酯,其中也含有O元素,故图中O元素在方块微结构的区域含量大于背景区域含量,绿颜色较深。而对于Si元素,则只存在于盖玻片上,平均分布于图3(e)中。图3(f)为Fe元素的表征,可以看出由于盖玻片和结构中均不含Fe元素,因此,图中只有部分噪点,而无明显的Fe元素分布现象。
图3(g)~3(i)是经过Fe纳米粒子原位合成后的表征。由图3(g)可以看出在经过Fe纳米粒子原位合成后,生物凝胶模板表面变的粗糙,而从图3(h)~(k)可以看出,微结构中的Fe纳米粒子对能谱仪的X射线有很强的散射作用,从而出现明显的阴影区域。图3(i)则直接证明结构中Fe元素集中分布在生物凝胶模板中。
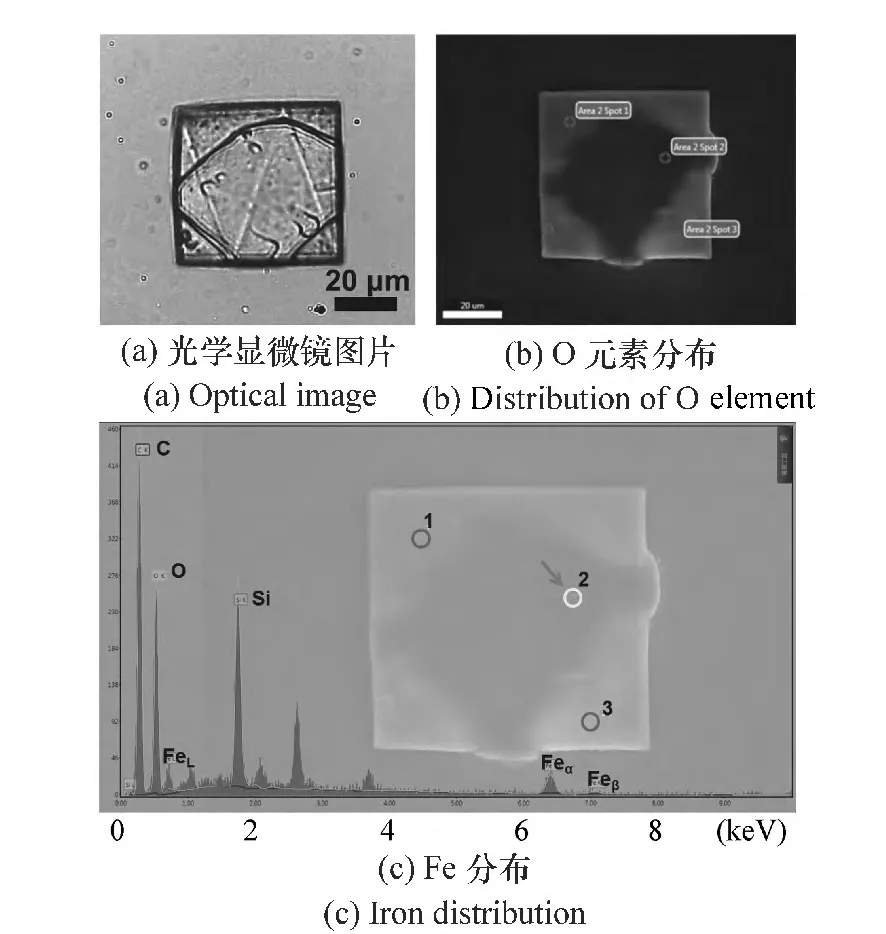
图4 多次原位合成纳米粒子后生物凝胶模板的图片Fig.4 Image of the bio-gel template after in situ synthesis
如图4所示,原位合成纳米粒子的步骤可以重复多次,从而使纳米粒子粒径增大。图4(a)为多次原位合成Fe纳米粒子后的生物凝胶模板的光学显微镜图片,可以看出经过多次原位合成后,铁纳米粒子含量和粒径均有增加,表现在生物凝胶模板呈现出3价铁的黄色。而多次原位合成后,3价铁并不是均匀分布的,主要集中在中心区域,如图4(b),中心区域由于Fe纳米粒子粒径大,含量多,导致对电子束散射大,从而呈现出阴影区域。同时采用点扫描方式对其中的1,2,3点进行Fe分布的相对强度的表征,如图4(c)所示,可以看出2点所对应的区域Fe分布强度更大。分析其原因,可能是多次原位合成后产生的晶核的电荷吸引作用导致的。
3.4 Ag纳米粒子的原位合成
如图5所示,制作了两层卷曲状的三维生物凝胶模板并进行Ag纳米粒子的原位合成。图5(a)中可以看出,对于制作复杂的层状生物凝胶模板,飞秒激光直写具有其他方法所不可比拟的优势[16],可以实现这种三维复杂微结构的制作,并且在加工过程中只需要设计特定图案的程序,无须制作昂贵、耗时的掩膜版,能够实现生物凝胶模板制作过程的实时监控。因此,采用飞秒激光能够快速制备生物材料光子晶体、细胞微镊、纳米针、细胞原位支架及各向异性颗粒等,从而使聚合物微结构在生物医学领域有更大的应用潜力。此外,由于加工预聚物溶液中COOH基团的引入,使得生物凝胶模板可以与多种金属阳离子耦合,从而形成多种纳米粒子修饰的结构,并且在多次的原位合成步骤后,金属纳米粒子的粒径和含量也可以得到控制。
在实验中发现,由于功能组分丙烯酸的引入,使得凝胶模板在氢氧化钠处理过程中羧酸基团互相排斥从而使整个生物凝胶模板结构膨胀度变大,有利于金属盐溶液的进入成核,以及纳米粒子核的长大。羧酸基团使金属阳离子在特定区域进行选择性吸附。由于凝胶结构浸泡在盐溶液中呈现负价态,使金属阳离子的吸附能力进一步增强。比较图5(c)和图5(f)可以看出在经过多次纳米粒子原位合成后,生物凝胶模板中银的含量相对于结合位点数来说是非常高的,区域中Ag的含量达到了9%,比C含量7%还多。同时,从图5(f)中可以看出,双层卷曲结构的上层,由于结构悬空,相对扩散距离比束缚在衬底上的下层更小,金属盐溶液浸泡时,更有利于金属纳米粒子的成核与生长,因此,上层结构银纳米粒子更多,表观黄色程度更深。图6为图5中上层卷曲结构的Ag分布,可以看出Ag M相和Ag Lα相相对强度最大。

图5 三维结构的生物凝胶模板原位合成银纳米粒子的能谱仪表征((a)~(f))分别为电镜照片,总体元素分布及 C、O、Si、Ag的分布情况Fig.5 EDS characterization after the silver nanoparticles in situ synthesis in the 3D bio-gel template.The SEM image,the total distribution of all elements and the distribution of the single element of C,O,Si and Ag
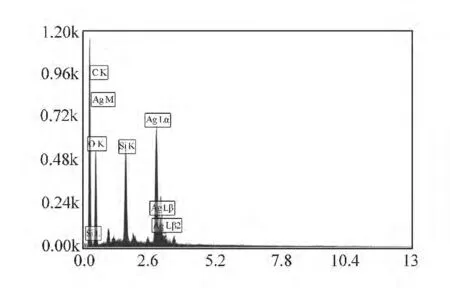
图6 上层卷曲结构的Ag分布Fig.6 Silver distribution in the upper curl layer of the bio gel template
4 结论
本文将先进的飞秒激光直写技术与纳米粒子原位合成方法相结合,先由飞秒激光直写出生物凝胶模板,然后用金属盐溶液处理凝胶模板原位合成纳米粒子,制备出同时具有三维复杂形貌及特定纳米粒子化学修饰的聚合物微结构。在生物凝胶模板的制作过程中,通过调节溶液组分和激光加工参数,实现在保证微结构的复杂精细程度前提下(分辨率为亚100 nm,结构大小为10 μm量级),更多地保留功能结合位点COOH基团。此外,进行了方块微结构Fe纳米粒子和Ag纳米粒子的原位合成,以及复杂的双层卷曲结构的Ag纳米粒子原位合成。多次循环原位合成纳米粒子步骤后,对纳米粒子聚集行为进行了分析。这种简单高效的功能性聚合物微结构加工方法,在光子学[1]、生物医学工程[4]、催化[19]、组织工程[3]及数据存储等领域有广泛的应用前景[21-24]。
[1] STEBE K J,LEWANDOWSKI E,GHOSH M.Oriented assembly of metamaterials[J].Science,2009,325(5937):159-160.
[2] ANTHONY S M,HONG L,KIM M,et al..Single-particle colloid tracking in four dimensions[J].Langmuir,2006,22(24):9812-9815.
[3] DU Y,LO E,ALI S,et al..Directed assembly of cell-laden microgels for fabrication of 3D tissue constructs[J].Proceed-ings of the National Academy of Sciences,2008,105(28):9522-9527.
[4] PREGIBON D C,TONER M,DOYLE P S.Multifunctional encoded particles for high-throughput biomolecule analysis[J].Science,2007,315(5817):1393-1396.
[5] HORCAJADA P,CHALATI T,SERRE C,et al..Porous metal-organic-framework nanoscale carriers as a potential platform for drug delivery and imaging[J].Nature Materials,2009,9(2):172-178.
[6] CHAMPION J A,KATARE Y K,MITRAGOTRI S.Particle shape:a new design parameter for micro-and nanoscale drug delivery carriers[J].J.Controlled Release,2007,121(1):3-9.
[7] HAN Y,ALSAYED A M,NOBILI M,et al..Brownian motion of an ellipsoid[J].Science,2006,314(5799):626-630.
[8] MADIVALA B,VANDEBRIL S,FRANSAER J,et al..Exploiting particle shape in solid stabilized emulsions[J].Soft Matter,2009,5(8):1717-1727.
[9] GLOTZER S C,SOLOMON M J.Anisotropy of building blocks and their assembly into complex structures[J].Nature Materials,2007,6(8):557-562.
[10] DENDUKURI D,DOYLE P S.The synthesis and assembly of polymeric microparticles using microfluidics[J].Advanced Materials,2009,21(41):4071-4086.
[11] JIANG S,CHEN Q,TRIPATHY M,et al..Janus particle synthesis and assembly[J].Advanced Materials,2010,22(10):1060-1071.
[12] CHAMPION J A,KATARE Y K,MITRAGOTRI S.Making polymeric micro-and nanoparticles of complex shapes[J].Proceedings of the National Academy of Sciences,2007,104(29):11901-11904.
[13] ROLLAND J P,MAYNOR B W,EULISS L E,et al..Direct fabrication and harvesting of monodisperse,shape-specific nanobiomaterials[J].J.American Chemical Society,2005,127(28):10096-10100.
[14] BROWN A B D,SMITH C G,RENNIE A R.Fabricating colloidal particles with photolithography and their interactions at an air-water interface[J].Physical Review E,2000,62(1):951.
[15] JEONG W,KIM J,KIM S,et al..Hydrodynamic microfabrication via“on the fly”photopolymerization of microscale fibers and tubes[J].Lab on a Chip,2004,4(6):576-580.
[16] LAFRATTA C N,FOURKAS J T,BALDACCHINI T,et al..Multiphoton fabrication[J].Angewandte Chemie International Edition,2007,46(33):6238-6258.
[17] GOPPERT-MAYER M.Two-quantum processes[J].Ann Phys(Leipzig),1931,9:273-294.
[18] SUN Y L,LIU D X,DONG W F,et al..Tunable protein harmonic diffractive micro-optical elements[J].Optics Letters,2012,37(14):2973-2975.
[19] STEVENS P D,FAN J,GARDIMALLA H M R,et al..Superparamagnetic nanoparticle-supported catalysis of Suzuki cross-coupling reactions[J].Organic Letters,2005,7(11):2085-2088.
[20] TERRIS B D,THOMSON T.Nanofabricated and self-assembled magnetic structures as data storage media[J].J.Physics D:Appl.Phys.,2005,38(12):R199.
[21] 孟想,杨蕊竹,刘东旭,等.紫外固化型聚合物水凝胶的周期图案形成及其调控[J].中国光学,2012,5(4):436-443.MENG X,YANG R ZH,LIU D X,et al..Formation and adjustment of cycle pattern of UV-curable polymeric hydrogel[J].Chinese Optics,2012,5(4):436-443.(in Chinese)
[22] 王二伟,鱼卫星,王成,等.用表面等离子体共振传感器检测纳米间距[J].中国光学,2013,6(2):259-266.WANG E W,YU W X,WANG CH,et al..Nanogap measurement by using surface plasmon resonance sensor[J].Chinese Optics,2013,6(2):259-266.(in Chinese)
[23] 任玉,李付锦,董旭,等.飞秒激光等离子体通道传导能量特性的研究进展[J].中国光学,2012,5(2):134-142.REN Y,LI F J,DONG X,et al..Research of guiding energy with plasma channel induced by femtosecond laser in air[J].Chinese Optics,2012,5(2):134-142.(in Chinese)
[24] 张以亮,汪建斌,黄晓高,等.聚合物波导型表面等离子体共振传感器的特性研究[J].发光学报,2013,34(7):948-951.ZHANG Y L,WANG J B,HUANG X L,et al..Characteristics of SPR sensor based on polyer waveguide[J].Chinese J.Luminescence,2013,34(7):948-951.(in Chinese)
