复方卡波姆前房注射构建大鼠慢性高眼压模型的实验研究
2014-11-26庞国龙尹丽颖
孙 河 庞国龙 尹丽颖
2黑龙江中医药大学
青光眼是以眼压升高为主要体征,伴随视神经损害和视野缺损为主要特征的眼部疾病。其为仅次于白内障的全球第二大致盲性眼病〔1-3〕。高眼压是青光眼的最重要体征,临床中往往结合病理性的视神经改变和视野缺损方可明确诊断并进行治疗,但是临床中患者的眼压得到控制后,其视神经损害和视野缺损仍然处于下行状态〔4〕。对于青光眼复杂多变的机制、演变过程以及有效治疗方法等研究需要进行大量的动物实验,然而实际中用于青光眼的发病机理、手术治疗、视神经保护治疗等研究的青光眼模型并不多见。现在流行的青光眼慢性高眼压模型大多为巩膜上静脉烧灼(或结扎)、小梁激光光凝或两者的联合,但是两者在实际造模过程中技术要求相对较高,成模率较低,且死亡率较高,为了探寻一种操作相对简单,技术含量要求低,造模成功率高且死亡率低的造模方法,2004年黑龙江中医药大学附属第一医院眼科课题组应用复方卡波姆溶液制作兔慢性高眼压模型〔5〕,获得成功。本次实验我们选择SD大鼠作为实验动物,用不同浓度复方卡波姆溶液制作大鼠慢性高眼压模型,并与传统造模方法作对照,发现卡波姆造模的效果确切,可操作性强,优于对照组。
1 材料和方法
1.1 实验动物与仪器药品
SD大鼠(购自北京维通利华实验动物技术有限公司,实验动物许可证号:SCXK-(京)2012-0001),卡波姆 940(Carbomer-940,CAS:9007-20-9,购自北京国人逸康科技有限公司),将其配制成含0.3%卡波姆和0.025%地塞米松(郑州卓峰制药有限公司,生产批号12100611)的复方卡波姆溶液(150 mg卡波姆粉剂放入盛有50 ml蒸馏水的100 ml烧杯中,并放入12.5 mg的地塞米松磷酸钠注射液,用玻璃棒搅拌卡波姆并放入超声设备内振荡至全部溶解即可),pH 值为4。微量进样器(德国 Eppendorf),Tonopen-avia笔式眼压计(美国Mentor公司产品),研究型显微镜(OLYMPUS-BX60,日本),眼科手术显微镜(苏州六六视觉医疗设备公司)。
1.2 动物及分组
健康SD大鼠29只,雌雄兼用,体重大约在250g左右,随机分为5组,A、B、C、D组各6只,雌雄各半,均给予右眼前房不同剂量的复方卡波姆溶液注射,左眼为自身对造眼。D组给予右眼巩膜上静脉3条烧灼,左眼为自身对照眼。E组5只,为空白对照组。造模前测量所有大鼠眼压,将眼压大于21 mmHg或眼压高于非手术眼5 mmHg的大鼠剔除,并补充符合条件的大鼠〔6〕。
1.3 造模方法
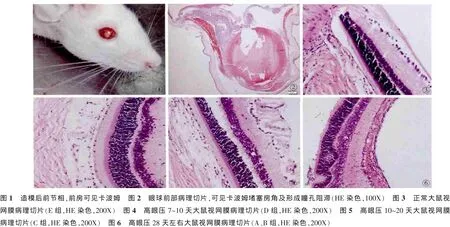
A组:10%水合氯醛3.5 ml/kg腹腔麻醉,0.5%丁卡因滴眼液滴右眼行表面麻醉,复方托吡卡胺滴眼液(美多丽)术眼散瞳,术眼每眼先用10 ul微量进样器抽取房水5 ul,随后用10 ul微量进样器注射复方卡波姆溶液5ul缓慢进入前房,伴随着卡波姆溶液的进入,显微镜下清晰可见卡波姆遇房水后瞬间变为白色絮状物,部分卡波姆留在瞳孔区,形成瞳孔阻滞,部分卡波姆进入房角位置,形成房角阻滞(图1,图2)。注射完毕后用棉签轻压穿刺口,无房水外漏,弃掉棉签。
B组:麻醉、散瞳同前,每只术眼先用10 ul微量进样器抽取房水10 ul,随后用10 ul微量进样器注射卡波姆溶液10 ul缓慢进入前房,卡波姆进入前房情况同前。注射完毕后处置同前。
C组:麻醉、散瞳同前,术眼每眼先用20 ul微量进样器抽取房水15 ul,随后用20 ul微量进样器注射卡波姆溶液15 ul缓慢进入前房,卡波姆进入前房情况同前。注射完毕后处置同前。
D组:腹腔注射10%水合氯醛3.5 ml/kg全身麻醉,并给予2%利多卡因结膜下注射,剪开上方结膜10点~3点位,轻柔、仔细分离下方筋膜及肌肉,充分暴露巩膜上静脉,可见2根分别位于上直肌旁,2根分别位于下斜肌旁,用加热的大头针烧灼静脉主干,使静脉封闭。如果烧灼成功,可见到被烧灼静脉后方成一白线,近角膜缘端静脉明显充盈,给予烧灼3条静脉。
E组:只做术眼前房穿刺,正常饮食、饮水。
手术完毕后,术后 1、3、5、7、14、28 d 给予测眼压,每日术眼点可乐必妥滴眼液1次,连续点1周,每日显微镜下观察结膜、角膜、前房的炎症情况。
1.4 模型成功的判断标准
眼压大于21mmHg或眼压高于非手术眼5mmHg,且高眼压连续持续7天以上为造模成功〔6〕。
1.5 统计学方法
采用SPSS 18.0(汉化版)软件进行分析。两组间的比较采用t检验,各项指标以±s表示。以P<0.05为差异有统计学意义。
2 结果
2.1 眼压情况(表1)
A 组:基线眼压:右眼(12.34±1.23)mmHg,左眼(13.04±0.43)mmHg。 6只右眼均形成高眼压,高眼压持续时间为20~30天,高眼压范围为(右眼):(25.23±2.31)mmHg,眼压峰值为 35~40 mmHg,青光眼模型成功率100%。左眼眼压同术前。术后第3天眼压开始上升,角膜轻度水肿,瞳孔区可见卡波姆阻滞,部分房角区可见卡波姆阻滞,前房炎性反应较轻,第2周开始出现虹膜新生血管,第3、4周虹膜新生血管明显增多。
B 组:基线眼压:右眼(12.14±1.02)mmHg,左眼(12.35±1.67)mmHg。 6 只右眼均形成高眼压,高眼压持续时间为20~30天,高眼压范围为(右眼):(28.23±4.31)mmHg,眼压峰值为 40~45 mmHg,青光眼模型成功率100%。左眼眼压同术前。术后第1d眼压即开始升高,角膜轻度水肿,瞳孔区可见卡波姆阻滞,部分房角区可见卡波姆阻滞,前房炎性反应适中,第2周虹膜新生血管开始出现,且新生血管较A组粗大,第3、4周数量增加。
C 组:基线眼压:右眼(13.44±2.54)mmHg,左眼(13.35±2.67)mmHg。 6 只右眼均形成高眼压,高眼压持续时间为10~20天,高眼压范围为(右眼):(30.56±3.45)mmHg,眼压峰值为 45~50 mmHg,青光眼模型成功率100%。左眼眼压同术前。术后第1 d眼压即开始升高,角膜明显水肿,瞳孔区可见卡波姆完全阻滞,部分房角区可见卡波姆阻滞,前房炎性反应明显,该组在第2周开始有大鼠出现角膜软化、扩张,角膜向前膨出,出现眼压逐渐下降,大约第3周后期降至正常眼压范围,该组大鼠第1周末虹膜出现粗大的新生血管,且量大,在第2、3周时,已经布满整个虹膜。
D 组:基线眼压:右眼(13.32±2.13)mmHg,左眼(13.37±2.09)mmHg。术后第 2d 死亡大鼠 2 只。其中1只大鼠眼压升高不明显,其余3只眼压升高,眼压范围为(25.54±2.45)mmHg,眼压峰值为 25~30mmHg,高眼压持续时间7~10天,造模成功率50%。左眼眼压同术前。角膜轻度水肿,轻度前房炎症反应。
E 组:眼压:右眼(12.34±3.13)mmHg,左眼(12.54±3.21)mmHg。
表1 4组大鼠慢性高眼压的比较(±s,mmHg)
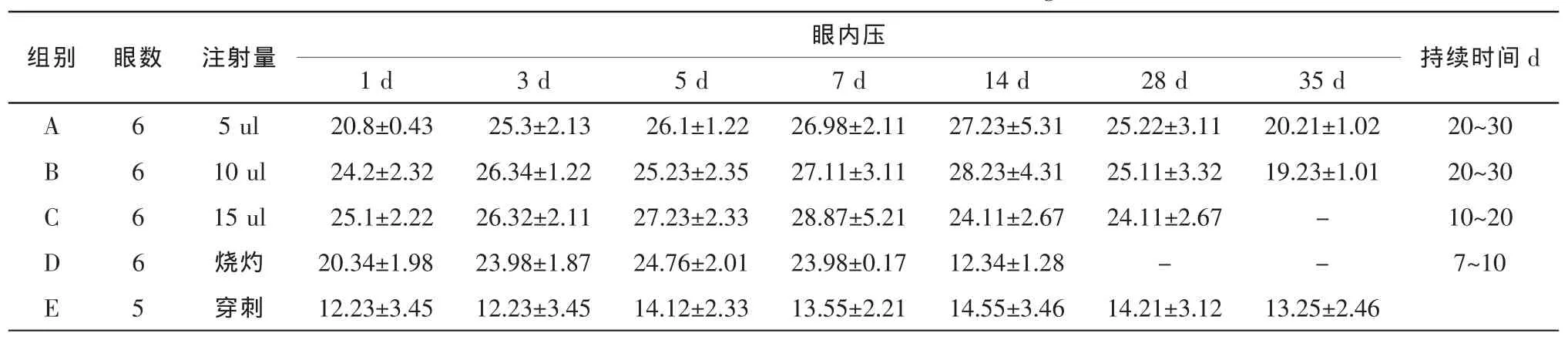
表1 4组大鼠慢性高眼压的比较(±s,mmHg)
注:“-”表示实验结束
持续时间d 28 d 35 d.31 25.22±3.11 20.21±1.02 20~30.31 25.11±3.32 19.23±1.01 20~30 C 6 15 ul 25.1±2.22 26.32±2.11 27.23±2.33 28.87±5.21 24.11±2.67 24.11±2.67 - 10~20 D 6 烧灼 20.34±1.98 23.98±1.87 24.76±2.01 23.98±0.17 12.34±1.28 - - 7~10 E 5 穿刺 12.23±3.45 12.23±3.45 14.12±2.33 13.55±2.21 14.55±3.46 14.21±3.12 13.25±2.46
对于两组间的比较我们采用t检验,A、B、C、D组眼压升高后同E组空白组眼压比较,均P<0.05,差异具有统计学意义。说明慢性高眼压的大鼠模型构建成功,但是各组的眼压及大鼠的一般状况有所不同,A、B组眼压相对于C、D组眼压升高平稳,持续时间较长,前房、角膜反应相对较轻,特别是B组的眼压升高快、平稳,是较为理想的造模剂量。
2.2 光镜结果
36 d后(实验观察完毕),每组选择5只大鼠右眼做视网膜的组织切片观察。
2.2.1 大鼠的正常视网膜结构:大鼠的正常视网膜结构光镜下所见与人相似,呈明显的结构分层。外核层细胞数最多,有3~5层;内核层细胞数较少,有2~4层;节细胞为单层,形态呈圆形或椭圆形,细胞核多偏于外侧,细胞分布均匀、紧密,形态、大小相似。可以清楚地看到内界膜、神经纤维层、神经节细胞层、内丛状层和内核层、外丛状层、外核层等各层次(图 3)。
2.2.2 各组高眼压模型大鼠的视网膜结构:D组大鼠模型(高眼压持续7~10 d):神经节细胞排列稀疏,数目较空白组减少10.41%,但仍可见较多正常的神经节细胞,D组与空白组间节细胞数目比较,差异有统计学意义(P<0.05)。视神经纤维层轻度变薄,偶见淋巴细胞浸润,内丛状层水肿明显,内核层细胞减少,外丛状层加厚,外核层细胞层数减少(图4)。C组大鼠模型(高眼压持续10~20 d):神经纤维层、视神经节细胞层及内丛状层高度水肿增厚,层次欠清晰,其神经节细胞表现为部分细胞泡状死亡,可见凋亡细胞,剩余神经节细胞形态出现轻度异常,主要为胞质减少,细胞形态紊乱,神经节细胞计数较空白组下降 29.59%(图5),两者之间差异有统计学意义(P<0.05)。内核层细胞层几乎为单层,外丛状层水肿明显增厚,空泡增多;内丛状层及外核层细胞数减少。A、B组高眼压模型(高眼压持续28d左右):RGCs数目下降38.19%,且与空白组之间差异有统计学意义(P<0.01)。神经纤维层、视神经节细胞层及内丛状层萎缩,变薄,层次较为清晰,可见较多淋巴细胞浸润,外核层细胞排列稀疏(图6)。
3 讨论
科学有效的构建动物模型是进行实验研究首要的必需条件,目前我国常见的用于制作疾病模型的动物为大鼠、兔和猴,猴由于价格昂贵且为国家特殊保护动物等因素限制了其广泛应用于动物实验研究。国内有研究使用兔制作动物模型,但是兔的房角结构与人眼差别较大,因此其实验结果用于临床还有一定的距离〔5-9〕。当前大鼠为眼科最常用的青光眼实验动物,是因为鼠眼的解剖结构和生理特点同人类的眼球有众多的相似点,例如小梁、schlemm管、睫状体、视网膜血管、巩膜上静脉等,房水引流途径也同人类相似〔10,11〕。 还有大鼠的眼压呈周期性节律〔12,13〕,神经特异性烯醇化酶在发育成眼前节组织的神经嵴细胞中的分布、滤过结构、筛板的蛋白等〔14,15〕。 大鼠高眼压模型与人类的青光眼病理变化相似,像视网膜神经节细胞的凋亡,筛板结构的破坏与再建,视神经轴突的损伤等〔15〕。大鼠种族稳定,容易排除干扰因素,使得结果更加科学、可信。大鼠价格低廉,较易获得,便于饲养,可进行大规模的实验。
文献提供的青光眼高眼压模型为激光光凝小梁网法〔16〕、巩膜上静脉封闭诱导法两种〔17,18〕,其中激光光凝小梁法通过光凝小梁网影响房水的回流引起眼压升高,该办法需要特制的激光治疗仪,技术要求比较高,并且需要多次重复打激光以维持高眼压状态,因此并不是理想的造模方式。巩膜上静脉封闭也是流行的造模方法之一,或进行缝线结扎,或进行烧灼静脉,或用激光进行光凝静脉,其原理为封闭巩膜上静脉阻止房水外流以达到眼压升高的目的。我们此次实验D组选择了烧灼静脉法,效果并不是很理想,眼压未有明显提高,即使个别大鼠眼压升高,但在4~5天后眼压又会下降到正常范围,且死亡率较高,还有的模型眼眼压升高不明显,升高后维持时间短等情况。因此用该造模方法升高眼压与维持高眼压状态的时间有待商榷。
我们采用了前房注射不同剂量的复方卡波姆溶液进行观察,并采用了现在比较流行的烧灼巩膜上静脉法作为比较组进行眼压升高的参照,在实验中我们发现A组模型(低剂量卡波姆)眼压升高相对较慢,升高眼压较为平稳,眼压升高时间相对较长,前房反应相对较轻,无明显角膜软化、凸出情况等。B组模型(中剂量卡波姆)眼压升高较快,术后第1日即升高,且眼压较为平稳,眼压升高时间相对较长,基本同A组,前房反应也较轻,无明显的角膜软化、凸出情况等。C组模型(高剂量卡波姆)眼压升高同样较快,术后第二日即升高,但是部分大鼠的角膜在第二周开始出现软化、凸出,眼压开始缓慢下降,大约在第三周降至正常范围内。D组大鼠模型为烧灼巩膜上静脉造模的模型,造模后第2日即有2只大鼠死亡,且眼压升高缓慢,持续时间相对较短,有1只大鼠眼压升高不明显,该组大鼠前房反应较轻,角膜状况好,但是造模成功率低,同其他文献报道的较高的造模成功率有差距〔19〕。我们通过实验得出结论,B组模型10 ul剂量组为理想的卡波姆造模剂量,该组大鼠模型升高眼压快,眼压升高稳定,维持高眼压约为28天左右,是较为理想的高眼压时间窗,并且并发症少。下一步的实验我们将采取10 ul剂量作为造模剂量,进行后续的一系列实验。为进一步验证高眼压造成的视网膜损伤,我们观察了高眼压持续7~10天、10~20天、28天左右的高眼压大鼠视网膜改变,通过光镜观察发现视网膜厚度逐渐变厚,最后逐渐变薄,考虑为早期和中期高眼压造成了视网膜渐进性水肿,后期由于长时间缺血、缺氧造成了视网膜逐渐萎缩变薄。视网膜神经节细胞数量随着高眼压时间的延长而逐渐下降,说明了高眼压对视网膜形成了损害,造成了视网膜的厚度、显微结构、神经节细胞数量的变化,同时也进一步验证了慢性高眼压模型的构建成功。
卡波姆为丙烯酸键合烯丙基蔗糖或季戊四醇烯丙醚的高分子聚合物,是一类重要的流变调节剂,中和后的卡波姆是优秀的凝胶基质,广泛应用于乳液、膏霜、凝胶中,是优良的药剂新辅料。其最大特点:(1)当pH值低时呈溶液状,随着pH值的升高,溶液的黏稠度逐渐增加而变成凝胶状,当且仅当pH值在6~12时最为黏稠;(2)具备较好的乳化性、增稠性、助悬性以及成膜性。这些特性使得卡波姆在制药中得到了广泛的应用〔20,21〕。根据卡波姆随着 pH 值发生变化的特点,分析注入前房的卡波姆溶液在房水作用下,随着pH值的升高,变为凝胶状阻滞瞳孔和房角造成房水排出受阻,从而形成高眼压,基于此种设想,我们进行了大鼠前房注射卡波姆溶液形成高眼压的动物实验。根据大鼠前房狭小的情况,我们分成3个不同的剂量进行观察,观察哪个剂量的模型眼压升压快、稳定、并发症少而轻、安全性好、可用性强,找出模型的最佳剂量。对于成功的高眼压模型,我们观察其造模后的眼压升高情况,并于眼压观察完毕后,于实验的第36d从各组选出5只大鼠进行光镜下观察视网膜显微结构变化,以及视网膜神经节细胞数量变化。
复方卡波姆诱发大鼠青光眼模型的优点:(1)眼压升高较稳定,可使眼压保持足够长的时间,因此我们可使用大鼠高眼压模型研究青光眼视乳头形态学改变,视网膜神经节细胞及轴索损害等病理生理过程,以及药物干预对其的保护作用等。(2)该模型眼压平稳上升的原因,我们分析为随着房水的不断分泌,前房的pH值也处于不断升高状态,导致前房内卡波姆凝胶的黏稠度不断增加,加大了房水流出易度。(3)使用卡波姆溶液诱导大鼠青光眼,方法简单,成本低廉,易于操作和控制,对操作人员的操作技能要求低,适合大范围推广。(4)眼压升高持续时间近1个月,按人与大鼠寿命折算,相当于人高眼压一年半,完全可用于进行各种抗青光眼药物降眼压作用和视神经、视网膜保护作用的药物研究。
复方卡波姆溶液诱导大鼠青光眼模型的缺点:引起部分眼球结膜充血、角膜水肿、轻度前房渗出、对光反应减弱等一系列并发症,分析原因可能为卡波姆引起眼压增高的继发性反应。前房的炎性反应,可能与注入前房的卡波姆pH值较低或是卡波姆作为异物的刺激有关。我们运用地塞米松注射液的目的:(1)增加眼压升高的幅度及延长眼压升高的时间;(2)减轻前房的炎症反应。
总之,本模型具有可使大鼠眼压缓慢稳定升高,高眼压持续时间长,对角膜影响小,炎症反应轻,方法简单,易于操作和控制等优点。是一种很好的慢性高眼压模型。
[1]Quigley HA,Broman AT.The number of people with glaucoma world-wide in 2010 and 2020[J].Br J Ophthalmol,2006,90(3):262-267.
[2]Raymond V.Molecular genetics of the glaucomas:mapping of the first five“GLC”loci[J].Am J Hum Genet,1997,60( 2):272-277.
[3]Quigley HA,Reacher M,Katz J,et al.Quantitative grading of nerve fiber layer photographs[J].Ophthalmology,1993,100(12):1800-1807.
[4]Bull ND,Irvine KA,Franklin R,et al.Transplanted oligodendro-cyte precursor cells reduce neurodegeneration in a model of glaucoma[J].Invest Ophthalmol Vis Sci,2009,50(9):4244-4253.
[5]孙河,张慧,黄春娟,等.建立兔慢性高眼压模型方法的研究[J].中国中医眼科杂志,2005,15(4):208-210.
[6]徐岩,陈祖基,宋洁贞.复方卡波姆诱导的兔高眼压模型与其它兔高眼压模型的比较研究[J].中华眼科杂志,2002,38(3):172-175.
[7]雷迅文,韦萍,李军,等.兔高眼压模型的眼球超微结构的改变[J].眼科研究,2008,26(4):280-284.
[8]任燕如,唐由之.复方卡波姆溶液诱导慢性实验性兔高眼压模型研究现状[J].眼科新进展,2010,30(7):686-689.
[9]魏文,李运,杨晓冉,等.慢性高眼压致兔视神经及视功能的损伤[J].中国老年学杂志,2012,32(3):525-528.
[10]杜兆江,刘杰,杨新光,等.浅层巩膜静脉烧烙法诱发大鼠慢性高眼压的研究[J].第四军医大学学报,2003,24(22):2107-2109.
[11]张富文,路雪婧,段俊国.大鼠慢性高眼压模型的建立[J].眼视光学杂志,2005,7(1):44-46.
[12]Kr Ishna R,Mermoud A,Baerveldt G,et al.Circadian rhythm of in traocular pressure:a rat model[J].Ophthal micRes,1995,27(3):163-167.
[13]Moore CG,Johnson EC,Morrison JC.Circadian rhythm of in traocu-lar pressure in the rat[J].Curr Eye Res,1996,15(2):185-191.
[14]Nucci P,Tredici G,Manitto MP,et al.Neuron-specific enolase and embryology of the trabecular meshwork of the rat eye:an immunohistochemical study[J].Int J Biol Markers,1992,7(4):253-255.
[15]Morrison J,Farrell S,Johnson E,et al.Structure and composition of the rodent lamina cribrosa[J].Exp Eye Res,1995,60(2):127-135.
[16]刘东敬,陈晓明,盘如刚,等.大鼠慢性高眼压模型的建立及玻璃体游离谷氨酸变化的实验研究[J].眼科研究,2008,26(5):343-346.
[17]戴乐,赵薇,李燕,等.水下电凝巩膜表面静脉制作大鼠慢性高眼压模型的探讨[J].昆明医学院学报,2009,30(3):37-39.
[18]WoldeMussie E,Ruiz G,Wi jono M,et al.Neuroprotection of retinal ganglion cells by brimon idine in rats with laser induced chronic ocularhypertension[J].Invest Ophthalmol Vis Sci,2001,42(12):2849-2855.
[19]吴真真,朱益华.烙闭上巩膜静脉建立大鼠慢性高眼压模型[J].福建医科大学学报,2012, 46(6):415-417.
[20]罗明生,高天惠.药剂辅料大全[M].成都:四川科学技术出版社,1995:383-386.
[21]冯端浩,郑毅.卡波姆在半固体制剂中的应用[J].中国药学杂志,1998,18(9):420-421.
