四羟丙基乙二胺–乙二胺四乙酸二钠体系快速化学镀铜
2014-11-25曹权根陈世荣杨琼汪浩王恒义谢金平范小玲
曹权根 ,陈世荣, *,杨琼,汪浩,王恒义,谢金平,范小玲
(1.广东工业大学轻化学院,广东 广州 510006;2.广东致卓精密金属科技有限公司,广东 佛山 528247)
电子工业的发展,特别是微电子技术的发展,使化学镀铜在非金属材料的金属化[1]、复合材料的制备[2]及电磁屏蔽材料的制备[3-4]中得到了广泛应用。目前,PCB(印制电路板)孔内化学镀铜的发展趋势是快速化学镀厚铜,即要求沉积速率为6~9 μm/h,30 min 内镀层厚度为2~3 μm[5]。以四羟丙基乙二胺(THPED)为配位剂的化学镀铜溶液体系,可在室温(20°C)、中温(40~45°C)或高温(50~70°C)条件下操作,溶液稳定性好、沉积速率快,镀层机械、电气性能也很好[6],但成本较高。郑雅杰等[7]以乙二胺四乙酸二钠(EDTA-2Na)代替部分THPED,研究了THPED和EDTA-2Na 双配位化学镀铜体系,在最佳条件下的沉积速率为4.05 μm/h,远低于单独添加THPED时的9.54 μm/h。为了提高沉积速率,申晓妮等[8]研究了添加剂对THPED和EDTA-2Na 化学镀铜的影响,在适宜条件下,沉积速率可达7.1 μm/h,且镀液稳定。本文系统地研究了THPED–EDTA-2Na 体系快速化学镀铜,以期进一步提高沉积速率及镀液稳定性。
1 实验
1.1 材料及工艺流程
以4 cm×4 cm 的环氧树脂板为基片,所用试剂均为化学纯,所用水为去离子水。工艺流程为:除油─微蚀─预浸─活化─解胶(加速)─化学镀铜。
1.2 配方与工艺
1.2.1 除油
IMT-8715 除油整孔剂5%(体积分数,下同),温度45~50°C,时间5~7 min。
1.2.2 微蚀
过硫酸钠80~120 g/L,硫酸(1.84 g/mL)5%,温度28~32°C,时间0.5~2.0 min。
1.2.3 预浸IMT-873 预浸盐210 g/L,盐酸(1.18 g/mL)1%,室温,时间1~2 min。
1.2.4 活化IMT-873 预浸盐210 g/L,IMT-8736 活化剂1%,盐酸1%,温度40~45°C,时间4~6 min。
1.2.5 加速
IMT-8745S 加速剂4.6%,室温,时间2~4 min。
1.2.6 化学镀铜
1.3 性能检测
1.3.1 沉积速率
镀层厚度用牛津CMI900 型X 射线荧光测厚仪测得,厚度除以施镀时间即得沉积速率。基础镀液的沉积速率约为16.8 μm/h。
1.3.2 镀层背光级数
取4 cm×4 cm 的环氧树脂板化学镀铜处理后,沿导通孔孔边切割为长条,用金相砂纸将排孔一侧均匀打磨至孔的半径处,将排孔的另一侧打磨至距孔边缘3 mm 处,然后将镀件置于50 倍放大镜下观察孔壁透光情况,对照标准“背光级数”图像表(10 级制)[9]确定镀件背光级数。PCB 工业生产中背光级数在8 级以上即为合格。
1.3.3 镀层形貌
取4 cm×4 cm 的环氧树脂板,化学镀铜后水洗吹干,用日本电子JSM-6510 型扫描电子显微镜(SEM)观察镀层表面形貌及颗粒大小。
1.3.4 镀液稳定性
镀液稳定性采用基础镀液进行测定,测定时只改变所考察因素的浓度,其他条件不变。采用氯化钯加速试验,在50°C 下向50 mL 镀液中加入3 mL 1 g/L 的PdCl2,镀液表面产生大量泡沫且有红色铜析出时表明镀液分解,从PdCl2加入到镀液分解经历的时间即为镀液的稳定时间。
2 结果与讨论
2.1 化学镀铜反应机理
还原剂不同时,化学镀铜的反应机理也不同。以甲醛为还原剂的碱性化学镀铜的主反应为:

在碱性溶液中,甲醛不仅仅是将Cu2+还原成Cu,还有少量Cu2+被还原成Cu+而生成CuOH和Cu2O。小部分CuOH和Cu2O 会溶解,发生歧化反应而生成单质Cu 粉,其分散于镀液中会形成新的催化中心,导致镀液自发分解。因此除上述主反应外,还有以下副反应。
(1)康尼查罗歧化反应:

(2)生成Cu+的反应:

2.2 配位剂含量对沉积速率和稳定性的影响
EDTA-2Na和THPED 对化学镀铜沉积速率和镀液稳定性的影响见图1。由图1 可知,随EDTA-2Na 质量浓度增大,沉积速率呈先增后减的趋势。这是因为随EDTA-2Na 含量增大,镀液中反应生成Cu(OH)2沉淀的Cu2+减少,更多Cu2+与EDTA-2Na 配位生成铜的配合物,使沉积速率加快,但EDTA-2Na 含量过高时,配位体含量过高,沉积速率减慢。THPED 对沉积速率的影响与EDTA-2Na 相反,这是因为THPED 含量较小时,THPED 只作为化学镀铜的配位体,随THPED 含量增大,溶液中游离Cu2+减少,沉积速率降低;当镀液中THPED 浓度达到一定值时,THPED 同时起到铜配位体和加速剂的作用[10],因而沉积速率升高。

图1 配位剂含量对化学镀铜沉积速率和镀液稳定性的影响Figure 1 Effect of complexant content on electroless nickel deposition rate and stability of plating bath
镀液稳定性随EDTA-2Na 含量增大而降低,随THPED 含量增大则升高。可能是由于THPED 比EDTA-2Na 的配位能力强,因此随镀液中THPED 与EDTA-2Na 之间的比值增大,与配位剂发生配位的Cu2+离子越来越难离解出来,镀液中自由铜离子越少,镀液在碱性条件下就越稳定。
镀液中EDTA-2Na、THPED 的质量浓度分别为2.3~9.0 g/L和10.0~12.6 g/L时,沉积速率高,镀层光亮,镀液较稳定。综合考虑沉积速率、稳定性和成本,分别选择EDTA-2Na、THPED 的含量为5.8 g/L和10 g/L。
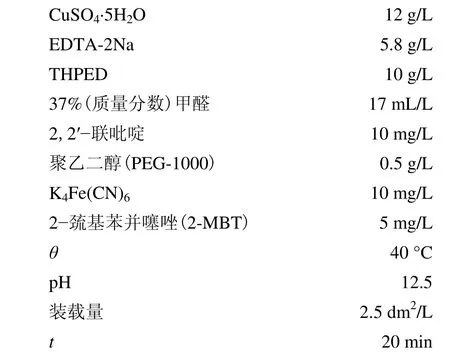
2.3 硫酸铜含量对沉积速率和稳定性的影响
硫酸铜对沉积速率和镀液稳定性的影响见图2。
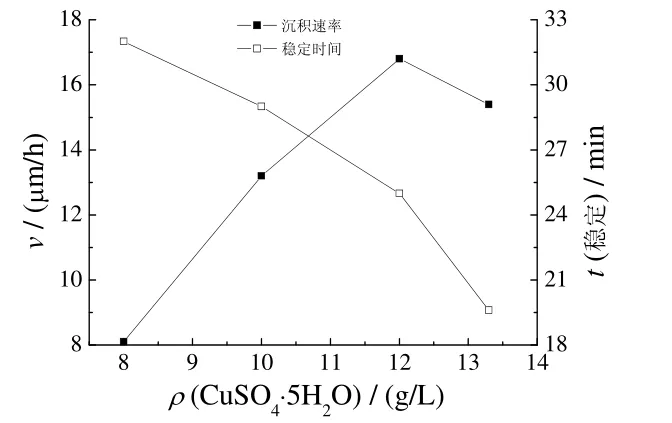
图2 硫酸铜含量对化学镀铜沉积速率和镀液稳定性的影响Figure 2 Effect of CuSO4content on electroless nickel deposition rate and stability of plating bath
由图2 可知,随硫酸铜质量浓度增大,沉积速率先升高后降低,镀液稳定性逐渐降低。可能是因为随硫酸铜质量浓度增加,配位剂与硫酸铜的摩尔比减小,配位体含量相对减小,溶液中游离的Cu2+增多,沉积速率提高;继续增大硫酸铜质量浓度,副反应加快,施镀过程中有红色Cu2O 析出,造成镀液分解,稳定性下降,沉积速率降低。综合考虑沉积速率、稳定性、镀层质量及成本,确定配位剂与硫酸铜的适宜摩尔比为1.0~1.2,即CuSO4·5H2O 取12 g/L。
2.4 甲醛含量对沉积速率和稳定性的影响
甲醛对沉积速率和镀液稳定性的影响见图3。

图3 甲醛含量对化学镀铜沉积速率和镀液稳定性的影响Figure 3 Effect of HCHO content on electroless nickel deposition rate and stability of plating bath
由图3 可知,随甲醛体积分数增大,沉积速率逐渐增大,稳定性逐渐降低。甲醛为8.0~10.3 mL/L时,沉积速率较慢,镀层表面光亮;甲醛为14.0~17.0 mL/L时,沉积速率快,镀层外观光亮;继续增大甲醛体积分数,镀层开始变暗。镀液中甲醛含量增大时,副反应加剧,镀液分解而析出红色Cu2O。因此甲醛含量不宜过高,选择其含量为14 mL/L。
2.5 pH 对沉积速率和稳定性的影响
镀液pH 对沉积速率和稳定性的影响见图4。
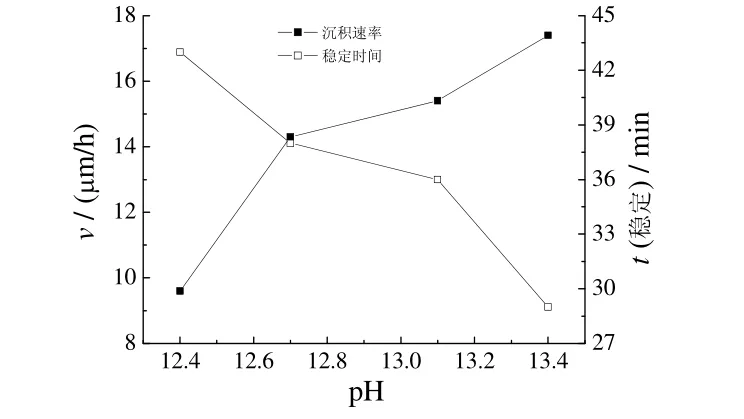
图4 pH 对化学镀铜沉积速率和镀液稳定性的影响Figure 4 Effect of pH on electroless nickel deposition rate and stability of plating bath
由图4 可知,随pH 增大,沉积速率逐渐增大,镀液稳定性逐渐降低。pH为12.4、12.7时,沉积速率慢,镀层光亮,稳定性好;pH为13.0时,沉积速率快,镀层光亮,镀液稳定;pH为13.4时,沉积速率快,镀层表面有暗纹,镀液不稳定。沉积速率增大是总反应式中作为还原剂的OH−浓度不断增大的结果。镀液中OH−浓度增大,导致副反应(3)加剧,析出红色Cu2O,Cu2O 进一步分解析出铜,最终导致镀液分解。综合考虑沉积速率、镀层质量及镀液稳定性,适宜的pH为12.5~13.0。
2.6 温度对沉积速率和稳定性的影响
固定pH为12.4和其他工艺条件不变时,温度对沉积速率和稳定性的影响见图5。由图5 可知,随温度升高,沉积速率逐渐增大,镀液稳定性逐渐降低。温度为30~40°C时,沉积速率慢,镀层光亮,镀液稳定;温度由40°C 升至50°C时,镀层红亮,沉积速率由9.4 μm/h 增大到15.4 μm/h,镀液稳定时间由94 min缩短至57 min。综合考虑沉积速率、镀层质量及镀液稳定性,适宜的温度为40~45°C。
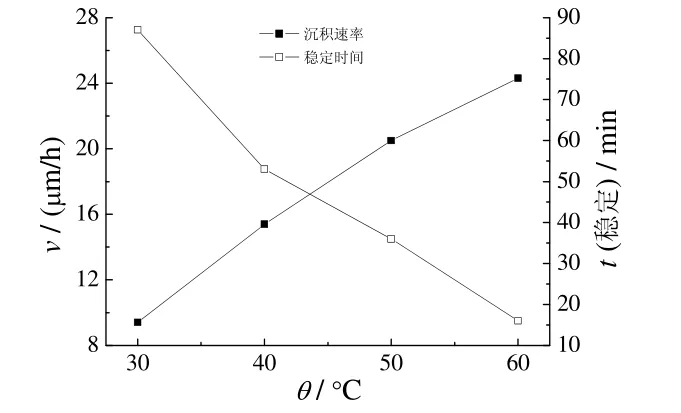
图5 温度对化学镀铜沉积速率和镀液稳定性的影响Figure 5 Effect of bath temperature on electroless nickel deposition rate and stability of plating bath
2.7 添加剂含量对沉积速率和稳定性的影响
2.7.1 2,2′−联吡啶
其他条件不变时,2,2′−联吡啶含量对沉积速率和镀液稳定性的影响见图6。
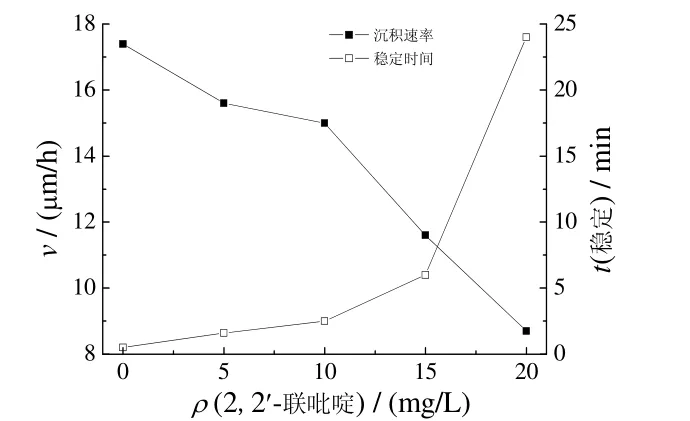
图6 2,2′−联吡啶含量对化学镀铜沉积速率和镀液稳定性的影响Figure 6 Effect of 2,2′-dipyridyl content on electroless nickel deposition rate and stability of plating bath
由图6 可知,随2,2′−联吡啶质量浓度增大,沉积速率降低,稳定性反之。2,2′−联吡啶为10、15 mg/L时,沉积快,镀层光亮,结晶细致,镀液稳定;2,2′−联吡啶为20 mg/L时,沉积慢,镀层不光亮。综合考虑沉积速率、镀层质量和镀液稳定性,确定2,2′−联吡啶的质量浓度为15 mg/L。
2.7.2 K4Fe(CN)6
图7为K4Fe(CN)6含量对沉积速率和稳定性的影响。
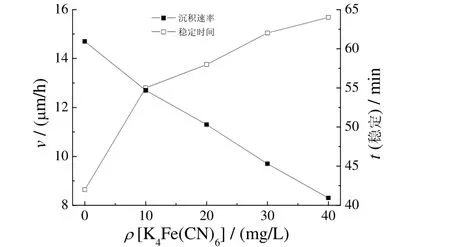
图7 K4Fe(CN)6含量对化学镀铜沉积速率和镀液稳定性的影响Figure 7 Effect of K4Fe(CN)6content on electroless copper deposition rate and stability of plating bath
K4Fe(CN)6为0~10 mg/L时,随K4Fe(CN)6质量浓度增大,沉积速率降低,镀液稳定性增强,镀层外观改善。继续增大K4Fe(CN)6的质量浓度,沉积速率和稳定性的变化趋缓。其原因可能是K4Fe(CN)6可吸附于镀层表面,使电子迁移或晶粒形核速率下降;当吸附达到饱和时,K4Fe(CN)6含量变化对沉积速率的影响也就不大[11-12]。因此K4Fe(CN)6的适宜质量浓度为10 mg/L。
2.7.3 2-MBT
2-MBT含量对沉积速率和镀液稳定性的影响见图8。

图8 2-MBT 含量对化学镀铜沉积速率和镀液稳定性的影响Figure 8 Effect of 2-MBT content on electroless copper deposition rate and stability of plating bath
由图8 可知,随2-MBT 质量浓度增大,沉积速率先升高后降低,稳定性逐渐增强。2-MBT 质量浓度由3 mg/L 增至5 mg/L时,镀层光亮,沉积速率由14.6 μm/h降至12.7 μm/h,镀液分解时间则由36 min延长到55 min。观察镀层外观可知,2-MBT 含量为7 mg/L时,镀层发黑。因此选择2-MBT 的质量浓度为5 mg/L。
沉积速率增大可能是由于2-MBT 含离域π 电子,其含量较低时,2-MBT 对铜电极的吸附作用强于CuT2(OH)2配合物(其中T为THPED),可促进Cu(II)还原[13-14]。2-MBT 对镀液的稳定作用可能与其在铜表面的吸附或其能与一价铜离子形成更强的螯合物有关[15]。
2.8 镀层性能
综上可知,PCB 化学镀铜的最佳工艺条件为:EDTA-2Na 5.8 g/L,THPED 10 g/L,CuSO4·5H2O 12 g/L,甲醛14 mL/L,2,2′−联吡啶15 mg/L,PEG-1000 0.5 g/L,K4Fe(CN)610 mg/L,2-MBT 5 mg/L,pH 12.5~13.0,温度40~45°C,装载比3.0 dm2/L,时间20 min。
在pH为12.4、温度为40°C 及其他参数为最佳的条件下进行化学镀铜。结果表明,沉积速率为12.7 μm/h,镀层厚度为4.2 μm,背光级数达9 级,满足PCB 工业生产要求。从其SEM 照片(图9)可知,化学镀铜层表面平整、致密。
3 结论

图9 PCB 表面镀层表面形貌Figure 9 Surface SEM image of copper coatings on PCB
(1)提高硫酸铜含量、甲醛含量、pH和温度可提高化学镀铜的沉积速率,但同时会降低镀液稳定性;随配位剂THPED 含量升高,沉积速率先降后升,镀液稳定性则先升后降;配位剂EDTA-2Na 对沉积速率和镀液稳定性的影响与THPED 相反。
(2)随添加剂2-MBT 含量增大,沉积速率先增后减,镀液稳定性增强;2,2′−联吡啶和亚铁氰化钾虽使沉积速率降低,但能使镀液稳定性增强。
(3)PCB 化学镀铜的最佳工艺条件为:EDTA-2Na 5.8 g/L,THPED 10 g/L,CuSO4·5H2O 12 g/L,甲醛14 mL/L,2,2′−联吡啶15 mg/L,PEG-1000 0.5 g/L,K4Fe(CN)610 mg/L,2-MBT 5 mg/L,pH 12.5~13.0,温度40~45°C,装载比3.0 dm2/L,时间20 min。在最佳工艺条件下的沉积速率可达12.7 μm/h,镀层厚度为4.2 μm,背光级数达9 级,表面平整、致密。
[1]朱焱,孔小雁,江茜,等.表面活性剂在陶瓷化学镀铜工艺中的作用[J].中国表面工程,2012,25 (1):76-82.
[2]张振忠,赵芳霞,丘泰.钨粉表面化学镀铜研究[J].铸造技术,2006,27 (11):1241-1244.
[3]SUN L L,LI J,WANG L J.Electromagnetic interference shielding material from electroless copper plating on birch veneer [J].Wood Science and Technology,2012,46 (6):1061-1071.
[4]DEEPA J P,RESMI V G,RAJAN T P D,et al.Studies on the influence of surface pre-treatments on electroless copper coating of boron carbide particles [J].Applied Surface Science,2011,257 (17):7466-7474.
[5]SRIDHAR A,VAN DIJK D J,AKKERMAN R.Inkjet printing and adhesion characterization of conductive tracks on a commercial printed circuit board material [J].Thin Solid Films,2009,517 (16):4633-4637.
[6]廖小波.一种性能优异的化学镀铜溶液体系[J].新兴科技,1992 (3):11-16.
[7]郑雅杰,邹伟红,易丹青,等.四羟丙基乙二胺和EDTA·2Na 盐化学镀铜体系研究[J].材料保护,2006,39 (2):20-24.
[8]申晓妮,赵冬梅,任凤章,等.添加剂对四羟丙基乙二胺(THPED)化学镀厚铜的影响[J].中国腐蚀与防护学报,2011,31 (5):362-366.
[9]邹伟红.快速化学镀铜工艺及机理研究[D].长沙:中南大学,2006.
[10]NORKUS E,VAŠKELIS A,ŽAKAITÉ I,et al.Polarographic investigation of Cu(II)complexes with N,N,N′,N′-tetrakis-(2-hydroxypropyl)-ethylenediamine [J].Talanta,1995,42 (11):1701-1705.
[11]LI J,HAYDEN H,KOHL P A.The influence of 2,2′-dipyridyl on non-formaldehyde electroless copper plating [J].Electrochimica Acta,2004,49 (11):1789-1795.
[12]OITA M,MATSUOKA M,IWAKURA C.Deposition rate and morphology of electroless copper film from solutions containing 2,2′-dipyridyl [J].Electrochimica Acta,1997,42 (9):1435-1440.
[13]NUZZI F J.Accelerating the rate of electroless copper plating [J].Plating and Surface Finishing,1983,70 (1):51-54.
[14]DUDA L L.Effect of isomeric dipyridyls on electroless copper deposition from EDTA solutions [J].Plating and Surface Finishing,1998,85 (7):60-62.
[15]HANNA F,HAMID Z A,AAL A A.Controlling factors affecting the stability and rate of electroless copper plating [J].Materials Letters,2004,58 (1/2):104-109.
