模拟高钠高放废物铁硼磷酸盐玻璃固化体的结构和性能
2014-11-25廖其龙陈奎儒向光华潘社奇
廖其龙,陈奎儒,王 辅,向光华,潘社奇
(1.四川省非金属复合与功能材料重点实验室--省部共建国家重点实验室培育基地,西南科技大学,四川 绵阳 621010;2.表面物理与化学国家重点实验室,四川 绵阳 621907)
目前高放废物的处理方法主要是玻璃固化技术,铁磷酸盐基础玻璃对高放废物中磷酸盐、硫酸盐、氧化铬、氧化铁和其他一些重金属元素有较好的溶解能力,在近几年得到广泛关注和研究[1--3]。由于铁磷酸盐系统玻璃中缺少对中子吸收系数较高的轻元素氧化物[4],因此,Bingham 等[5]研究了在摩尔组成为40Fe2O3-60P2O5的铁磷酸盐玻璃中加入10%(摩尔分数)的B2O3,发现B2O3的加入对其化学稳定性几乎无影响,且玻璃的热稳定性得到改善。通过电子能量损失谱对掺B2O3的铁磷酸盐玻璃的研究表明,其辐照稳定性能与硼硅酸盐体系玻璃媲美,硼元素在玻璃结构中仅以四面体[BO4]形式存在。Karabulut等[6]也系统的研究了B2O3的加入方式及加入量对铁磷酸盐系统玻璃结构和性能的影响,表明B2O3的加入对其化学稳定性无影响,玻璃的热稳定性得到提高,且结构中二价铁的比例由于B2O3的存在而减小。这些研究表明Fe2O3-B2O3-P2O5体系玻璃可能更适用于固化基础玻璃。
但对Fe2O3--B2O3--P2O5体系玻璃的固化性能研究相对较少,本课题组用36Fe2O3-10B2O3-54P2O5玻璃包容单一元素的研究表明,该组成的基础玻璃能包容摩尔分数为20%左右的Na2O[7]或10%左右的CeO2[8]。在此基础上,用铈元素氧化物模拟高放废物中的锕系放射性核素,系统研究高钠高放废物对36Fe2O3-10B2O3-54P2O5基础玻璃所形成固化体结构和部分物理性能的影响,并初步探讨其化学稳定性。
1 实验
1.1 模拟废物组成的确定
根据我国某高放废液所含元素浓度的特点[9],将废液中超铀元素(TRUs)用Ce元素代替作为高钠模拟放射性废物,模拟废物氧化物的具体组成见表1,该类放射性废物中Na2O的摩尔分数为66.6%。
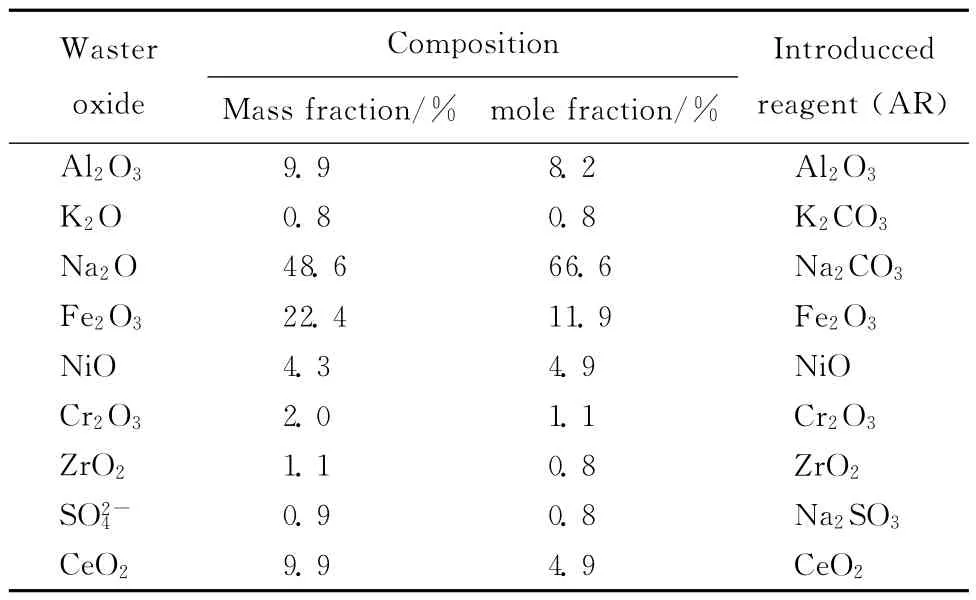
表1 高钠废物组成及引入试剂Table 1 Compositions of wastes containing Na and the introduced reagent
1.2 试样制备
不同废物包容量的铁硼磷酸盐玻璃固化体的组成见表2。以表1中列出的引入试剂为原料,按表2中化学计量比准确称量,将可熔融60g玻璃熔体的配合料放入黏土坩埚中,于马弗炉在熔融温度下空气中熔融2.5~3.0h后,浇铸到已预热到800 ℃左右的钢模具中,然后转移到已升温至450℃退火炉中保温1h,再以1℃/min的速率降到常温。所有用于性能检测的试样均来自退火后的固化体。试样采用高放废物的包容量加废物的英文第一个字母命名,如样品30 W 表示废物包容量为30%(质量分数)的铁硼磷玻璃固化体。
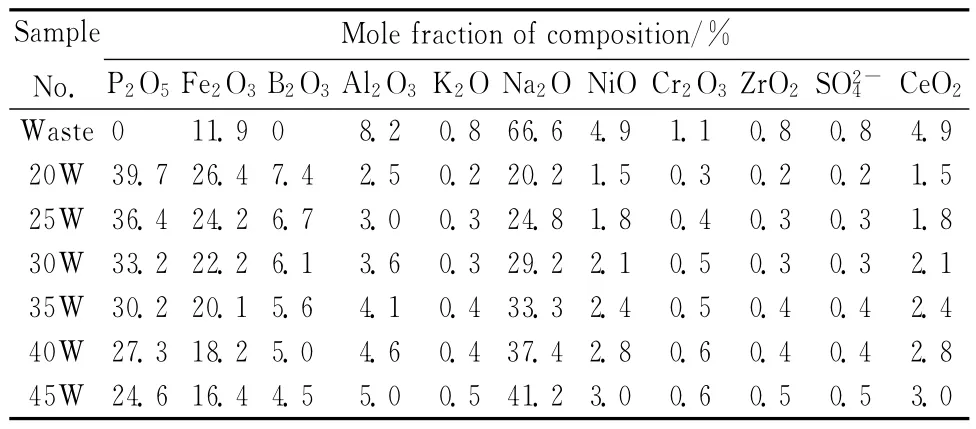
表2 铁硼磷酸盐玻璃固化体的组成Table 2 Molar compositions of iron borophosphate glass wasteforms
1.3 性能检测
退火后的玻璃试样用日本理学电机公司生产的D/max-RB型X 射线衍射仪检测可能存在的晶相。试样的密度ρ(g/cm3)用Archimedes原理测定,试样的摩尔体积根据该试样的密度和摩尔组成计算得到。试样的差热分析在Mettler Toledo公司生产的TGA/SDTA 851e型综合热分析仪上进行。光谱用美国热电尼高力公司生产的Nicolet 380 型智能Fourier变换红外光谱仪测试样品的Fowrier红外(FTIR),采用KBr压片法,测量范围为400~2 000 cm--1,FTIR 分析的谱线用纯KBr的谱线来校正。
采用溶解速率法(DR)测定试样的化学稳定,其具体测试步骤见文献[10]。由下试计算试样质量损失速率:
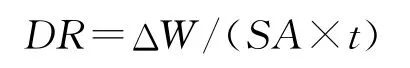
式中:DR 为块体试样的质量损失速率,g/cm2·min;ΔW 为每个浸泡周期试样的质量损失,g;SA 为试样表面积,cm2;t为浸泡时间,min。
2 结果与分析
2.1 FTIR分析
图1为玻璃固化体试样的红外光谱。从图1可见,不同废物包容量的固化体试样的图谱非常接近,峰出现的位置仅因废物元素及其增加对玻璃网络结构极化的影响不同有很小的变化,相对强度变化也较小,说明随着废物包容量的增加,玻璃的基本网络结构没有发生质的改变。为详细分析随着废物包容量的增加对玻璃结构产生的微小影响,对固化体试样的红外光谱进行Gauss分峰处理(见图2)。各振动吸收峰对应的振动基团(键)类型见表3。
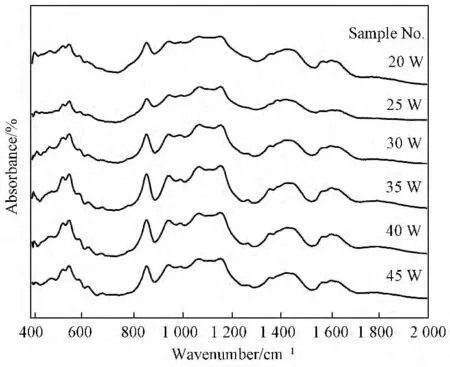
图1 玻璃固化体试样的FTIR 谱Fig.1 FTIR spectra of glass wasteforms
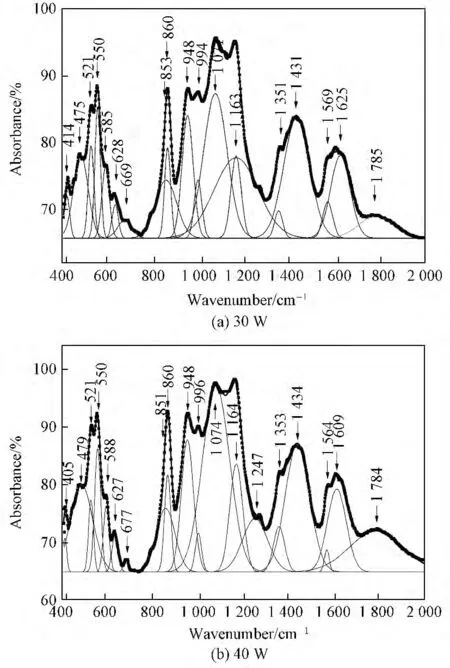
图2 部分玻璃固化体试样FTIR 谱的Gauss分峰谱Fig.2 Gaussian peak spectra of FTIR spectra of some glass wasteform samples
对铁硼磷酸盐玻璃,其主要结构网络为磷氧基团和硼氧基团相互连接而成[11],一些原子量较大的元素基团在波数较低的范围易出现吸收峰[12],因此,图中405~418cm--1范围的吸收峰可归因于与废物元素中重金属基团有关吸收峰;470~500cm--1处的吸收带是由链的弯曲振动和[FeO6]基团引起[13];521cm--1左右处的吸收峰是与(PO4)3-磷酸盐基团有关的 吸收振动峰[14];540~550cm--1范围内的尖锐吸收峰是(P2O7)4-磷酸盐基团中O—P—O的弯曲振动吸收峰[15];585~593cm--1处的吸收峰为(P2O7)4-焦磷酸盐基团中O—P—O 的弯曲振动吸收峰[12];627cm--1处的吸收峰归因于玻璃固化体结构中Fe—O—P的伸缩振动吸收峰[14];669~689cm--1范围内的吸收峰是与[BO4]基团中B—O 键弯曲振动吸收有关的峰,860cm--1处的吸收峰是[BO4]基团中B—O 键伸缩振动吸收峰[16]。此外,在947~951cm--1范围内的吸收峰也归因于[BO4]基团中B—O 键的对称伸缩振动吸收峰[17];851~860cm--1范围的吸收峰是P—O—P桥氧键的非对称伸缩振动吸收峰[16];在994~1 000cm--1范围的吸收峰是与(PO4)3-基团有关的非对称伸缩振动吸收峰;在1 066~1 074cm--1范围的吸收峰归因于(PO4)3-四面体基团中PO-离子团的对称伸缩振动吸收峰;1 161~1 164cm--1范围的吸收峰是受废物元素影响后(PO3)-离子团有关的振动吸收峰[15];1 163~1 262cm--1范围的吸收峰归因于固化体结构中Fe—O—P的伸缩振动吸收峰[15];在1 352~1 400cm--1范围的吸收峰是PO 键的对称伸缩振动吸收峰[15];在1 431~1 455cm--1范围的吸收峰是与硼氧三角体基团[BO3]有关的振动吸收峰[12]。波数大于1 564cm--1以上的3个吸收峰为与水中氢氧根有关的振动吸收峰[12]。
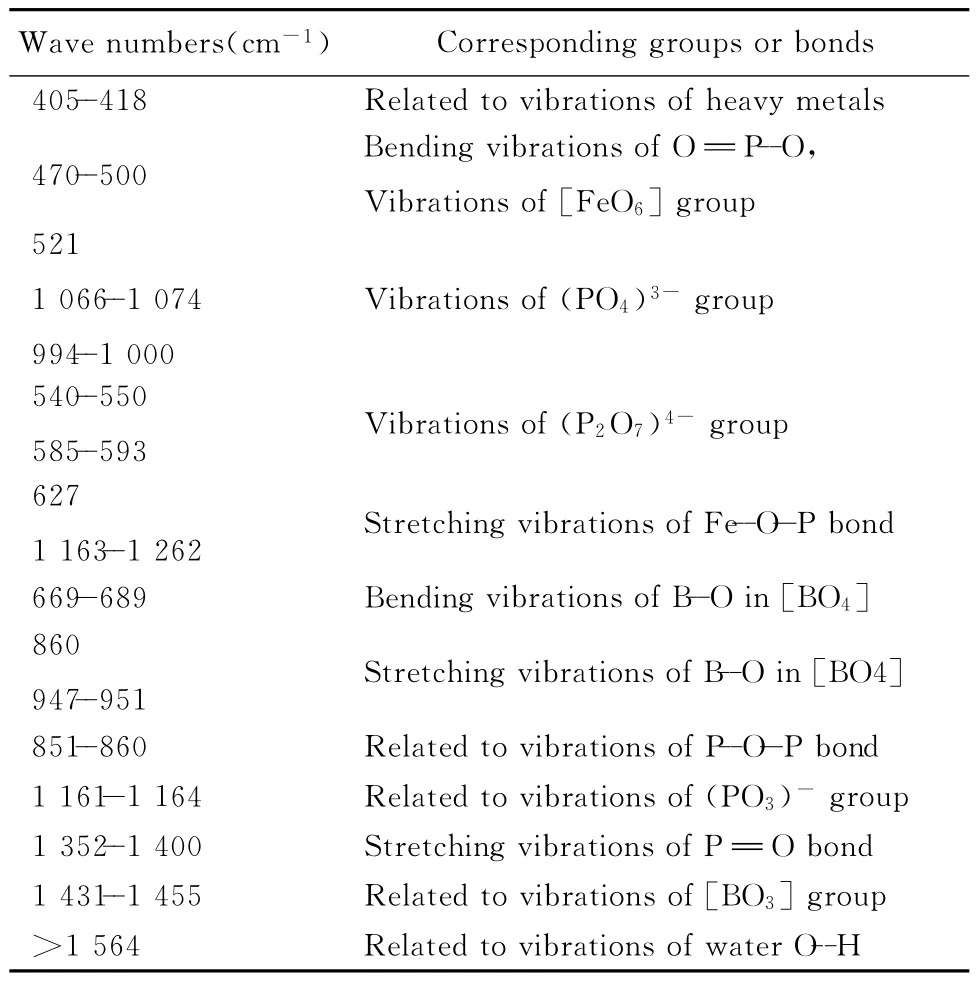
表3 铁硼磷酸盐玻璃固化体的红外吸收峰Table 3 Assignment of absorption bands in the infrared spectra for glass wasteform samples
各固化体试样红外光谱通过Gauss分峰拟合后计算得到与磷氧键有关的峰的面积随废物包容量增加的变化图见图3。对应键的振动峰面积的大小与该键在玻璃结构中的存在量成正比[12]。从图3可以看出,与(PO4)3-四面体基团振动有关峰的面积较大,且随着废物包容量的增加而增加,表明玻璃固化体试样中网络结构以(PO4)3-四面体基团为主,部分废物元素氧化物还能提供游离氧,使(PO4)3-四面体的量继续增多。而代表键、(PO3)-离子团和(P2O7)4-焦磷酸盐基团中O—P—O 键振动峰的面积相对较小,表明玻璃固化体试样结构中键、(PO3)-离子团和P2O7焦磷酸盐基团的量相对较小,且这些峰的面积随包容量的增加变化比较小,废物元素及其氧化物对玻璃固化体试样结构(PO3)-离子团和(P2O7)4-焦磷酸盐基团的量几乎无影响键的量略有减小。然而,代表(P2O7)4-磷酸盐基团中O—P—O 键的峰的面积随废物包容量的增加先减小,在废物包容量为35%以后又有所增加。这是因为随废物包容量的增加,废物中提供的游离氧增多,Q1磷酸盐基团有向(PO4)3-基团转变的趋势而较小,当包容量达到一定值后,固化体结构中存在的Al和Zr元素增多,这些元素形成玻璃网络结构会消耗游离氧,(P2O7)4-磷酸盐基团有所增加。
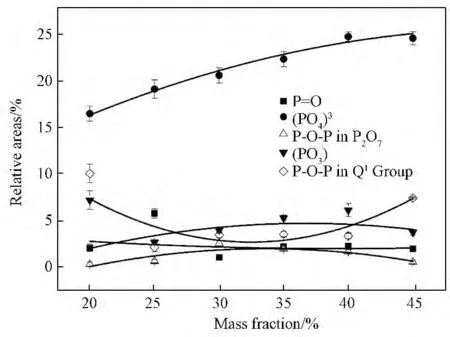
图3 与磷氧键有关的峰的面积随废物包容量的增加变化Fig.3 Relative areas dependence of bands corresponding to different P--O vibrational modes versus waste content
图4为Gauss分峰拟合计算得到的与硼氧键有关的峰的面积随废物包容量的增加变化。如图4所示:随着基础玻璃废物包容量的增加,代表[BO3]基团振动峰的峰面积逐渐减小,而代表[BO4]基团振动峰的峰面积逐渐在增大,表明废物氧化物能为玻璃提供游离氧增加,[BO3]基团向[BO4]基团转变。图4还表明,尽管随废物包容量的增加,[BO3]基团能向[BO4]基团转变,但四配位的硼原子数的数目不能超过由玻璃组成所决定的某一限度[18],玻璃固化体试样结构中[BO3]基团的量始终较[BO4]基团多,表明此配方基础玻璃的主要结构网络形成氧化物配比还可进一步优化。
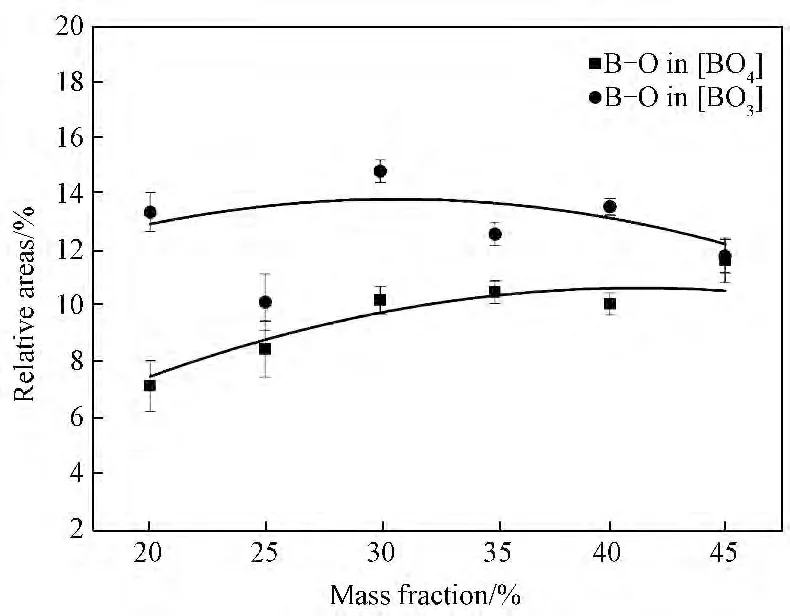
图4 与硼氧键有关的峰的面积随废物包容量的增加变化图Fig.4 Relative areas dependence of bands corresponding to different B--O vibrational modes versus waste content
图5为Gauss分峰拟合计算得到的P—O—P桥氧和Fe—O—P振动峰面积随废物包容量的增加变化图。图5表明:随着基础玻璃废物包容量的增加,代表P—O—P桥氧键振动峰的面积逐渐减小。在材料结构中同时存在多种基团时,同种基团间有尽可能不连接的趋势。随废物包容量增加,固化体中逐渐增多的Al和Zr元素能参与在网络结构中,且废物元素氧化物提供了更多游离氧,固化体结构中[BO4]基团更多(见图4),这些都使磷氧基团自身之间尽可能不连接,造成P—O—P桥氧键减小。图中代表Fe—O—P键的峰面积先增加,在包容量超过25%时开始减小,但废物包容量超过40%时又增加。开始,随着包容量的增加,废物元素提供的游离氧更多,所形成的玻璃网络基团也相对较多(如[AlO4]),也有更多的Fe元素参与到玻璃网络结构中,磷氧基团自身之间尽可能不连接而Fe—O—P的成键量增加。但包容量超过25%,Al和Zr元素形成的网络基团和[BO4]基团都增加,这些基团与[FeO4]基团相互竞争,都尽可能的与磷氧基团连接,Fe—O—P键的量开始下降,(PO4)3-四面体基团增多(见图3)。但当超过40%时结构中存在过量的网络外体元素在结构中起着断网络结构的作用或造成玻璃分相,Fe—O—P键的量又有所增加。
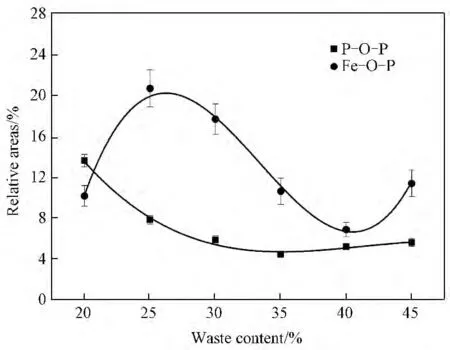
图5 P—O—P 桥氧和Fe—O—P 振动峰面积随废物包容量增加的变化曲线Fig.5 Relative areas dependence of bands corresponding to different P--O--P and Fe--O--P vibrational modes versus waste content
2.2 固化体玻璃形成范围、密度及摩尔体积
固化体的熔融温度、密度和摩尔体积见表4。由表4可知:固化体配合料根据废物包容量不同在1 200~1 250℃的温度范围内能熔融。当包容量小于30%时(含30%),固化体配合料在1 200℃能熔融;当包容量大于30%时,固化体配合料因废物中的Ce、Zr、Cr和Ni元素增多需在1 250℃下熔融。所制备固化体的密度在3.022~3.115g/cm3之间,基础玻璃在废物包容量为25%时密度有最大。当废物包容量小于25%时,部分废物元素(如Zr和Al)为玻璃网络形成体,另一些废物元素大多填补玻璃网络空隙中,网络结构相对更致密,固化体密度有所上升,但废物包容量超过25%后,废物平均分子量较基础玻璃平均分子量小起着主要作用,固化体密度开始降低。当废物包容量大于35%后由于废物氧化物在玻璃中的“固溶”趋于饱和,由废物引入的玻璃网络外体Na和K 元素也较多,对玻璃结构的断网起主导作用,玻璃网络结构变疏松,固化体密度降低更快。但在包容量超过40%时所制备出的固化体密度又上升,观察表明该试样已不具有玻璃光泽,可能出现了分相,分相的试样由于结构相对玻璃结构更致密,密度增加。固化体的摩尔体积(VM)在34.62~40.87cm3/mol1之间,随着废物包容量的增加,由于部分废物元素形成自身网络结构,另一部分元素存在玻璃网络结构空隙中,固化体摩尔体积减小。
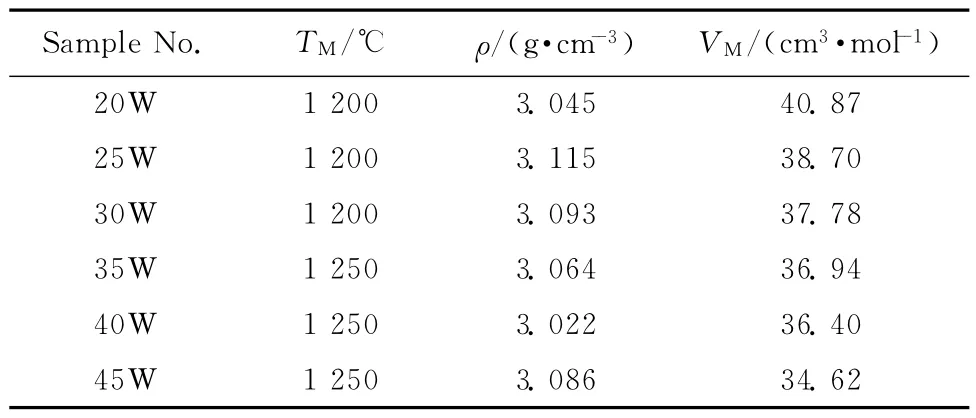
表4 固化体的熔融温度、密度及摩尔体积Table 4 Melting temperatures(TM),densities(ρ),molar volumes(VM)of wasteforms
2.3 化学稳定性分析
玻璃固化体在90℃去离子水中的质量损失速率可用来表征其化学稳定性,经过一段时间浸泡后,其质量损失速率越小,化学稳定性越好。部分玻璃固化体试样不同浸泡周期的质量损失速率见图6。从图6可见,在浸泡初期,固化体试样的质量损失速率受去离子水的侵蚀有所增加;随着浸泡时间的延长,玻璃固化体表面形成了保护膜,质量损失速率逐渐减小。废物包容量小于40%的试样在不同浸泡周期的质量损失速率值为10--8数量级,在浸泡28d后,该值小于2×10--8g/(cm2·min),具有较佳的化学稳定性。
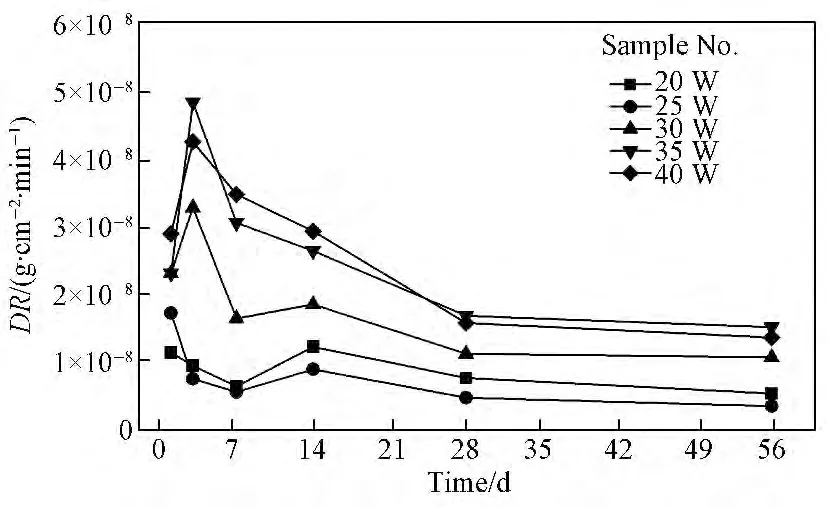
图6 部分试样不同浸泡周期的质量损失速率Fig.6 Mass loss rate(DR)of some samples in different immersion periods
比较几个固化体试样的DR 值可知,包容量为20%和25%的固化体试样相对其他几个试样化学稳定性较佳,其中25%最佳。从红外光谱结构分析可知,随着废物包容量的增加,虽(PO4)3-四面体的量一直增加,但在包容量较低时(20%),玻璃结构中存在相对较多的[BO3]基团和易水化的Q1磷酸盐基团,Fe—O—P 键的存在量也相对25%的固化体试样少,所以其化学稳定性较25%的固化体试样差。研究表明,铁磷酸盐玻璃的化学稳定性相对其他磷酸盐玻璃较好,其中一个主要的原因铁磷酸盐玻璃结构中P—O—P 键被更稳定的Fe—O—P 键代替,玻璃中存在大量稳定的Fe—O—P 键[18]。当废物包容量为30%时,玻璃固化体结构中虽有更多的[BO4]基团,但Fe—O—P 键都相对25%的固化体试样少,化学稳定性开始降低。此后随着包容量的增加,固化体化学稳定性降低。包容量为45%的固化体试样相对35%和40%虽有较多的Fe—O—P键和[BO4]基团,但玻璃固化体结构中存在过多的网络外体元素在结构中起着断网络结构的作用或造成玻璃分相,其化学稳定性降低更快,该试样的质量损失速率较大(为10--7数量级),未在图6中画出。
3 结论
用组成为36Fe2O3--10B2O3--54P2O5的基础玻璃固化Na2O 含量为66.6%的模拟高放废物,固化体配合料根据废物包容量不同在1 200~1 250℃温度范围能熔融并形成玻璃,所制备的玻璃固化体密度在3.022~3.115g/cm3之间。随着废物包容量的增加,固化体试样结构中(PO4)3-四面体基团增加,[BO3]基团向[BO4]基团转变,磷酸盐基团彼此间的连接程度减小,Fe—O—P 键在包容量为25%到30%时存在量较大。玻璃固化体网络结构以(PO4)3-四面体基团为主,易水化的(PO3)-磷酸盐基团的含量较小。在废物包容量为25%左右时,固化体结构各网络形成基团的含量较合理,具有相对较佳的化学稳定性。当废物包容量小于40%时,固化体不同浸泡周期的质量损失速率均在10--8g/(cm2·min)数量级。
[1]KIM Cheol-Woon,DAY D E.Immobilization of Hanford LAW in iron phosphate glasses[J].J Non Cryst Solids,2003,331(1/3):20-31.
[2]黄文旵,周蔡,DAY D E,等.磷酸盐玻璃固化体化学耐蚀性研究[J].硅酸盐学报,2004,32(4):460-470.HUANG Wenhai,ZHOU Nai,DAY D E,et al.J Chin Ceram Soc,2004,32(4):460-470.
[3]PRANESH Sengupta.A review on immobilization of phosphate containing high level nuclear wastes within glass matrix-Present status and future challenges[J].J Hazard Mater,2012,235-236:17-28.
[4]BINGHAM P A,YANG G,HAND R J,et al.Boron environments and irradiation stability of iron borophosphate glasses analysed by EELS[J].Solid State Sciences,2008,10(9):1194-1199.
[5]BINGHAM P A,HAND R J,FORDER S D,et al.Struc-ture and properties of iron borophosphate glasses[J].Phys Chem Glasses-B,2006,47(4):313-317.
[6]KARABULUT M,YUCE B,BOZDOGAN O,ERTAP H,MAMMADOV G M.Effect of boron addition on the structure and properties of iron phosphate glasses[J].J Non-Cryst Solids,20113,57:1455-1462.
[7]王辅,廖其龙,潘社奇,廖华.Na2O 对铁硼磷酸盐玻璃结构和性能的影响[J].辐射防护,2010,30(4):208-213.WANG Fu,LIAO Qilong,PAN Sheqi,et al.Radiat Prot(in Chinese),2010,30(4):208-213.
[8]廖其龙,王辅,潘社奇,廖华.掺铈铁硼磷酸盐玻璃的结构和化学稳定性[J].核化学与放射化学,2010,32(6):336-341.LIAO Qilong,WANG Fu,PAN Sheqi,et al.J Nucl Radiochem(in Chinese),2010,32(6):336-341.
[9]DONALD I W,METCALFE B L.The immobilization of high level radioactive wastes using ceramics and glasses[J].J Mater Sci,1997,32:5851-5887.
[10]DAY D E,WU Z,RAY C S.Chemically durable iron phosphate glass wasteforms[J].J Non-Cryst Solids,1998,241(1):1-12.
[11]ABDLGHANY A M,ELBATALl F H,AZOOZ M A,et al.Optical and infrared absorption spectra of 3dtransition metal ions-doped sodium borophosphate glasses and effect of gamma irradiation[J].Spectrochim Acta A,2012,98:148-155.
[12]ABDELGHANY A M,OUIS M A,AZOOZ M A,et al.Defect formation of gamma irradiated MoO3-doped borophosphate glasses[J].Spectrochim Acta A,2013,114:569-574.
[13]SDIRI N,ELHOUICHET H,AZEZA B,et al.Studies of(90-x)P2O5-xB2O3-10Fe2O3glasses by Mossbauer effect and impedance spectroscopy methods[J].J Non-Cryst Solids,2013,371:22-27.
[14]QIAN Bin,YANG Shiyuan,LIANG Xiaofeng,LAI Yuanming,et al.Structural and thermal properties of La2O3-Fe2O3-P2O5glasses[J].J Mol Struct,2012,1011:153-157.
[15]MAGDAS D A,COZAR O,CHIS V,et al.The structural dual role of Fe2O3in some lead-phosphate glasses[J].Vib Spectrosc,2008,48(2):251-254.
[16]ELBATAL F H,IBRAHIM S,ABDELGHANY A M.Optical and FTIR spectra of NdF3-doped borophosphate glasses and effect of gamma irradiation [J].J Mol Struct,2012,1030:107-112.
[17]SRINIVASULU K,OMKARAM I,OBEID H,et al.Structural and magnetic properties of Gd3+ions in Sodium-lead borophosphate glasses[J].J Mol Struct,2013,1036:63-70.
[18]MARASINGHE G K,KARABULUT M,RAY C S,et al.Properties and structure of vitrified iron phosphate nuclear wasteforms[J].J Non-Cryst Solids,2000,263-264:146-154.
