烟草靶斑病菌(Rhizoctonia solani)SRAP-PCR 体系建立及优化
2014-11-24赵艳琴吴元华赵秀香安梦楠陈建光
赵艳琴,吴元华,赵秀香,安梦楠,陈建光
1沈阳农业大学/植物保护学院,辽宁沈阳市东陵路120号 110866;
2 内蒙古民族大学/农学院,内蒙古通辽霍林河大街22号 028043
烟草靶斑病菌(Rhizoctonia solani)SRAP-PCR 体系建立及优化
赵艳琴1,2,吴元华1,赵秀香1,安梦楠1,陈建光1
1沈阳农业大学/植物保护学院,辽宁沈阳市东陵路120号 110866;
2 内蒙古民族大学/农学院,内蒙古通辽霍林河大街22号 028043
采用烟草靶斑病菌YC-9, LJT-8和QYS-7为DNA模板,初步筛选SRAP引物组合;采用L16(45)正交试验设计,对烟草靶斑病菌的SRAP-PCR反应体系中的Mg2+、dNTPs, Taq DNA聚合酶、引物和DNA模板浓度等5个因素进行优化试验。结果表明:共筛出13对扩增条带清晰且多态性好的引物组合;烟草靶斑病菌的最佳SRAP反应体系为Mg2+浓度2.0 mmol/L、dNTP浓度200 μmol/L、Taq DNA聚合酶0.8 U、引物浓度140 mmol/L、模板DNA 20 ng及1×PCR buffer,反应总体积为20 μL;各因素对SRAP-PCR扩增反应结果影响的差异较大,依次为Taq DNA聚合酶>引物> Mg2+> dNTPs=模板DNA。
烟草靶斑病菌;正交试验设计;反应体系优化;引物筛选
SRAP (Sequence related amplified polymorphism)技术是2001年Li和Quiros在芸苔属植物上开发出的新型分子标记技术[1]。该技术无需任何序列信息即可直接 PCR 扩增,从DNA 水平上直接检测基因组DNA 的多态性[2],相比此前广为应用的RAPD(Random amplification polymorphism DNA)技术以及AFLP (Amplified fragment length poly-morphism)等技术,SRAP技术稳定性和重复性好,并且成本低,简单快速[3]。目前SRAP技术已成功在多种植物遗传图谱和多样性分析的研究中应用[4-5],以及在植物病原物的遗传多样性研究中应用[6-7]。
烟草靶斑病(Thanatephorus cucumeris(Frank)Donk)在许多国家都有发生[8-10],是一种危害严重的烟草叶部病害。我国烟草靶斑病主要发生在烟草旺长期和成熟期,潜育期短、流行性强,严重影响烟叶的品质和产量[11]。烟草靶斑病菌的无性态为立枯丝核菌(Rhizoctonia solani),目前针对我国烟草靶斑病菌的研究报道较少[12-14]。为明确烟草靶斑病菌的遗传多样性及进化背景,本文建立了烟草靶斑病菌SRAPPCR反应体系,并对引物进行了筛选,以期早日明确烟草靶斑病菌的遗传本质,为该病害的防治提供理论依据。
1 材料与方法
1.1 试验菌株
烟草靶斑病菌株YC-9,LJT-8和QYS-7,分别分离自铁岭市营厂乡,李家台乡及丹东市青椅山烟草靶斑病菌组织,保存于沈阳农业大学烟草研究所。
1.2 试验方法
1.2.1 基因组DNA提取与检测
首先将菌株移植于PDA平板上,在28 ℃培养箱内培养3 d后,取5 mm直径的菌饼至含有10 mL的PD培养液的培养皿(9 cm)中,于28 ℃下静置培养3 d,过滤出菌丝,用无菌水冲洗,无菌滤纸吸干水分后于40℃干燥4 h后装入1.5 mL的离心管中,-20℃保存备用。
DNA提取采用北京天根生物技术公司DNA提取试剂盒按照说明进行,并采用1%琼脂糖凝胶电泳检测DNA。
1.2.2 SRAP引物筛选
SRAP引物采用Li等已发表的序列Me1~Me10/Em1~Em10[1],由上海生工生物有限公司合成。选取菌株YC-9、LJT-8和QYS-7,对100对SRAP引物进行多态性初筛。
1.2.3 SRAP-PCR扩增反应体系及程序
基础反应体积为20 μL:l0×PCR buffer (Mg2+)2 μL, Mg2+0.2 μL, 10 mmol/L dNTPs (10 mmol/L Each) 1.6 μL, 正 反 向 引 物 (10 μmol/L)各 0.5 μL, TaqDNApolymerase (2.5 U/μL) 0.32 μL,模板DNA1.0 μL,用ddH2O定容至20 μL。
反应程序参照Li等的方法略加修改[1], 94 ℃ 5 min; 94 ℃ 1 min, 35 ℃ 1 min, 72 ℃ l min, 4 个循环 ;94 ℃ 1 min, 56 ℃ 1 min, 72 ℃ 1 min, 39 个循环 ;72 ℃10 min, 4 ℃保存。
扩增结束后,取7.5 μL扩增产物,与1.5 μL 6×Loading Buffer(TaKaRa)混匀,点入含0.5 μg/mL Goldview 的1.5% 琼脂糖凝胶中,以 DNA Marker DL2000(Tiangen)作为分子量标准,在 5 V/cm 电场强度下电泳 1~2 h,紫外凝胶成像仪下照相。
1.2.4 SRAP 反应体系优化
选取质量较好的菌株DNA作为模板及多态性好的一组SRAP引物进行反应体系优化试验。首先按照表1进行单因素优化,以确定各因子的适宜浓度范围,在此基础上参照表2采用五因素四水平L16(45)进行正交优化。参考张丽等分析统计方法[15],对 Mg2+、dNTPs、Taq DNA 聚合酶、引物以及模板DNA浓度水平进行优化以获得稳定的反应体系。

表1 单因子试验设计表Tab.1 Single-factor experiment
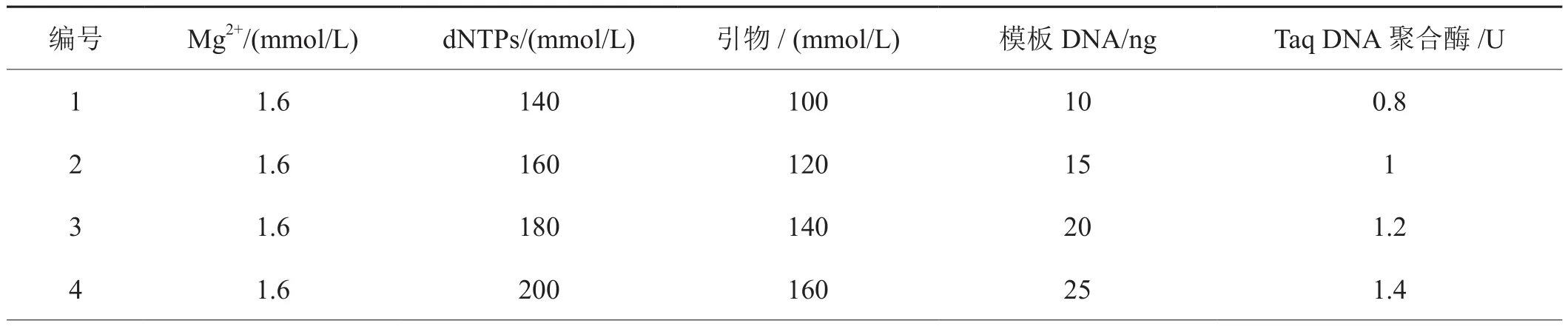
表2 烟草靶斑病菌SRAP-PCR反应体系的L16(45)正交试验设计表Tab.2 An orthogonal design of L16(45) of SRAP-PCR reaction system for Rhizoctonia solani from tobacco target spot
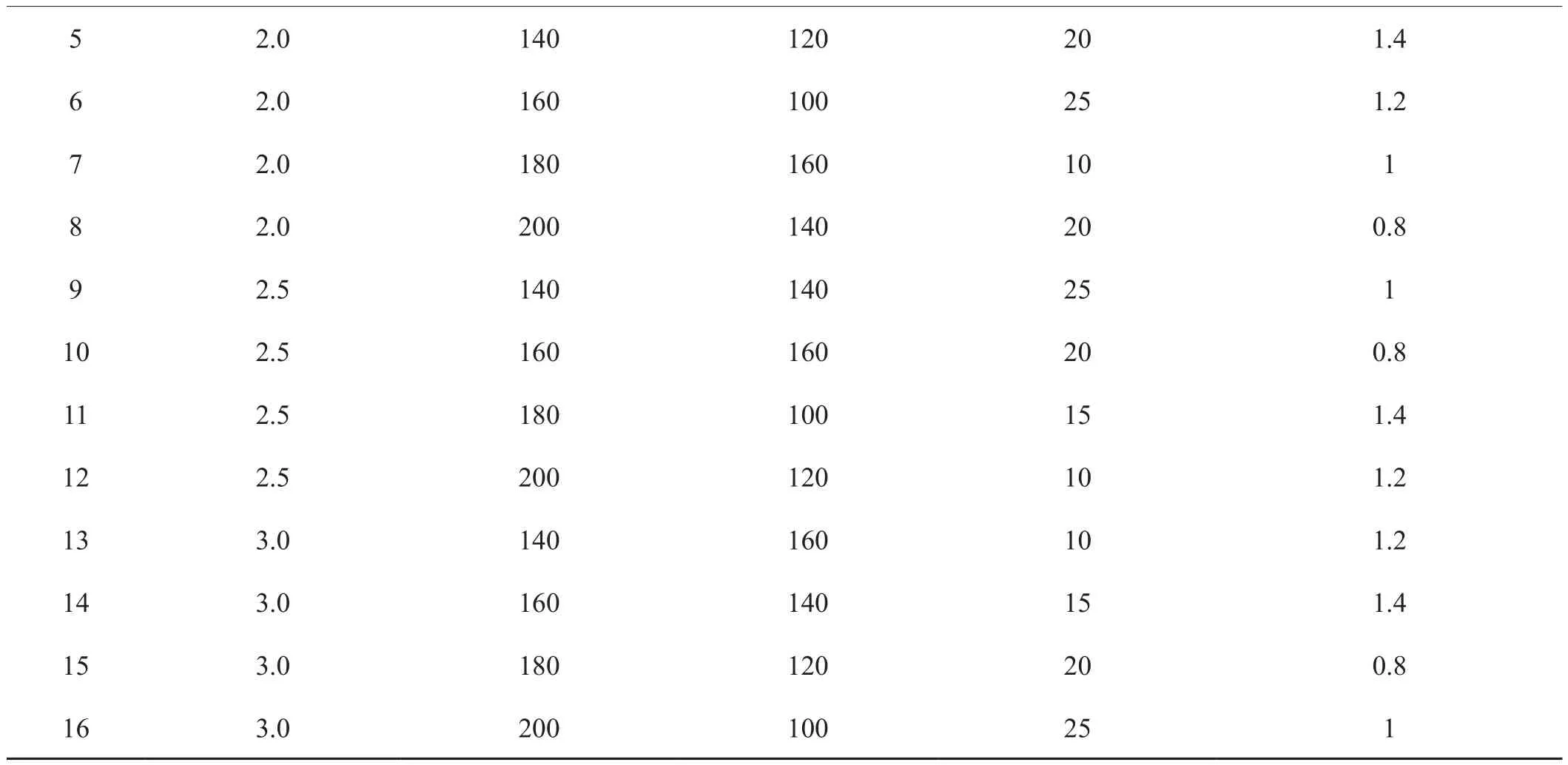
表2(续)
2 结果与分析
2.1 SRAP引物筛选
选取YC-9、LJT-8和QYS-7菌株对100对SRAP引物进行筛选,图1结果表明:筛选获得13组条带清晰且多态性好的引物组合,分别是Me1/Em2、Me3/Em2、Me3/Em9、Me4/Em4、Me4/Em6、Me4/Em9、Me5/Em3、Me5/Em9、Me6/Em2、Me6/Em8 和Me7/Em10 Me8/Em7和 Me9/Em5。

图1 优化SRAP反应体系部分引物中的扩增结果Fig.1 Amplified results of partial primer in the optimization of SRAP reaction system
2.2 SRAP反应体系优化
选择烟草靶斑病菌YC-9 基因组DNA及SRAP引物组合Me7/Em10进行体系优化。
2.2.1 Mg2+浓度
图2试验结果表明:当Mg2+浓度为1.0 mmol/L时,仅有较少的扩增条带数和扩增量;当Mg2+为1.5~2.5 mmol/L时,能获得较清晰的谱带且谱带数量增多,其中以2.5 mmol/L 的Mg2+浓度最佳;当Mg2+为3.0~4.5 mmol/L时,随着Mg2+浓度的增加扩增条带数变化不明显,但扩增量逐渐减少;至Mg2+为5 mmol/L时未扩增出谱带。
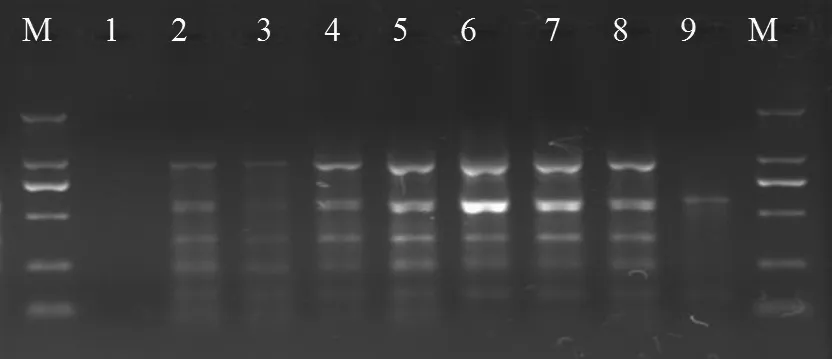
图2 Mg2+浓度对PCR扩增的影响Fig.2 Effect of Mg2+ density on the amplification of PCR
2.2.2 dNTPs浓度优化
图3表明:当dNTPs 为100 mmol/L时,获得谱带少且模糊不清,随着浓度增加,条带数增加,且清晰度增强,至dNTP的浓度为200 mmol/L时获得达到最多,最清晰;而当浓度进一步升高时,扩增谱带明显变弱,并且稳定性降低。
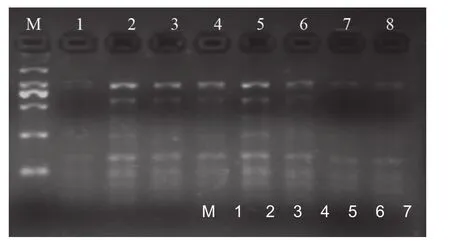
图3 dNTPs浓度对PCR扩增的影响Fig.3 Effect of dNTPs density on the amplification of PCR
2.2.3 Taq DNA聚合酶用量优化
由图4可知,当Taq DNA聚合酶为0.4 U时,扩增条带数明显少,且模糊不清;当用量为0.6~1.6 U时,谱带数及亮度基本一致;当Taq DNA聚合酶1.8~2.0 U比1.6 U增加一条谱带,清晰度有所增加。由于反应体系中 TaqDNA聚合酶的浓度过大时非特异性扩增可能增多,浓度过低又可能导致合成新链的效率的下降,最终导致扩增产物的减少,TaqDNA聚合酶的最佳用量为1.2 U即可。
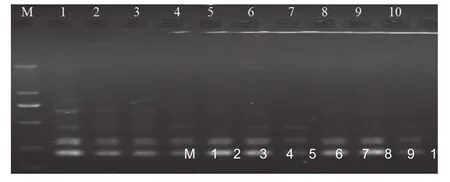
图4 Taq DNA聚合酶用量对PCR扩增的影响Fig.4 Effect of Taq DNA polymerase on the amplification of PCR
由图5结果表明:引物浓度的变化对反应体系的影响较大,当引物浓度为800和700 μmol/L时,扩增条带较少且较弱,当引物浓度降低至100 μmol/L时,获得条带数量随之增加且条带清晰,增加多为250 bp以下的条带,扩增效果最好;当引物浓度增加至为900 μmol/L条带数和亮度也较700 μmol/L时增加,增加的多为1000 bp左右的大片段,但较密集。经比较认为引物的最佳浓度为100 μmol/L。
2.2.4 模板DNA用量
试验结果表明(图6),当模板的用量为10~60 ng时,均能扩增出清晰的带型,随着模板DNA用量的增加,扩增出谱带数量基本一致,而谱带的亮度逐渐增加。模板20 ng时,谱带的亮度适于各条谱带的区分,并且能节省模板DNA的用量,确定为最佳模板用量,即20 μL反应体系中的20 ng模板DNA。

图6 模板DNA用量对PCR扩增的影响Fig.6 Effect of use of template DNA on the amplification ofPCR
2.2.5 SRAP反应体系的正交优化
比较单因素筛选结果,选出正交试验各因子较好的4个水平,进行正交试验体系优化。结果如图7所示,在16个正交组合中,各因素组合不同,扩增结果明显不同。16个处理均能扩出谱带,其中组合8的扩增谱带数量最多,最清晰。因此确定其为最佳反应体系。即模板DNA 20 ng,Mg2+浓度2.0 mmol/L,dNTP浓度200 mmol/L,Taq酶0.8 U,引物浓度140 mmol/L,反应总体积为20 μL。
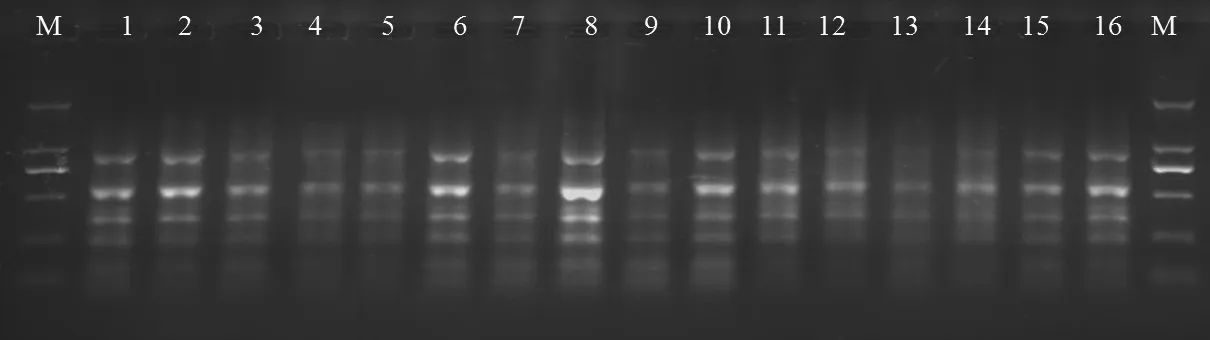
图7 正交设计扩增的结果Fig.7 Results of amplified orthogonal design
对16个正交组合试验图谱进行统计分析,K代表因子在某水平下获得总条带数,k代表所对应K值的平均值,R代表k的最大值与最小值之差,对比R值的大小以反映因子对扩增结果的影响,即R越大影响越显著[15]。由表3可知,Mg2+以2水平的2.0 mmol/L最好,dNTPs 以4水平的200 mmol/L最好,引物则以3水平的140 mmol/L最好,模板DNA用量以4水平的20 ng用量最好,Taq DNA 聚合酶以1水平的0.8 U最好。该数据刚好与通过图谱观察最佳组合8的结果一致。进一步对比R大小,反应体系中对扩增结果的影响强弱顺序为Taq DNA聚合酶>引物 > Mg2+> dNTPs= 模板 DNA。
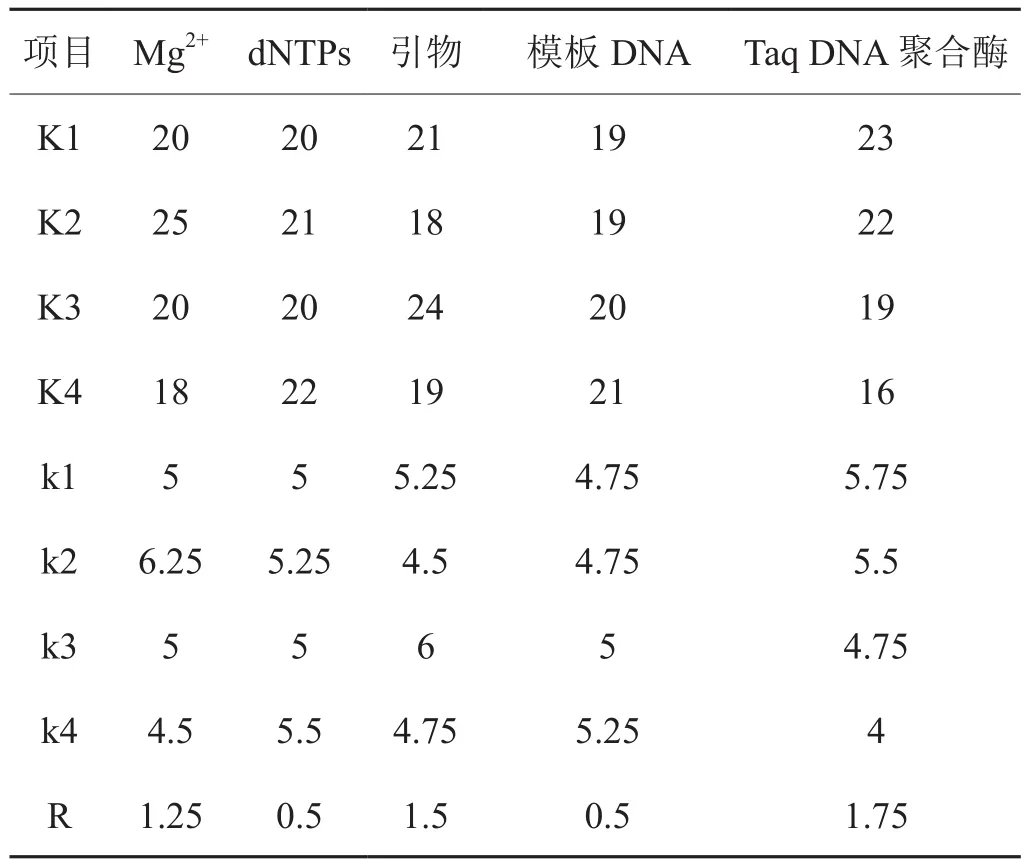
表3 正交试验结果的统计分析Tab.3 Analytical results of orthogonal experiments
3 结论与讨论
在PCR反应体系中各个因素间都会发生相互作用,如dNTPs会与Mg2+发生拮抗作用,Mg2+浓度又会对Taq DNA聚合酶的活性产生直接影响,而Taq DNA聚合酶在引物与模板DNA结合后的延伸中起重要作用[16]。因此,反应体系中无论哪个因素发生改变都会导致扩增结果的变化。采用PCR技术扩增多态性位点及遗传多样性研究,易受到这些因素的影响,因此一个适宜的PCR反应体系对于遗传多样性研究来说是尤为重要的。目前,PCR体系优化的方法中以单因素法和正交试验设计应用最为广泛,其中单因素分析法直观快速,但是忽略各因素间的互相作用[17],而正交试验设计较好的避免了这一点,但是正交试验的各因素水平范围宽泛,缺乏确定各因素水平的标准。将单因素法与正交试验设计结合能够弥补这些缺点。
初步筛选出13对SRAP引物可用于烟草靶斑病菌基因组的多态性分析;并结合了单因素与正交试验设计对烟草靶斑病菌SRAP-PCR反应体系进化优化,建立了适合该病菌的反应体系:模板DNA 20 ng,Mg2+浓度2.0 mmol/L,dNTP浓度200 mmol/L,Taq酶0.8 U,引物浓度140 mmol/L,反应总体积为20 μL。反应体系中对扩增结果的影响强弱顺序为Taq DNA聚合酶>引物> Mg2+> dNTPs=模板DNA。
[1]Li G, Quiros C F.Sequence-related amplified polymorphism (SRAP), a new marker system based on a simple PCR reaction: Its application to mapping and gene tagging in Brassica [J].Theoretical and Applied Genetics, 2001,103(2/3): 455-461.
[2]柳李旺, 龚义勤, 黄浩, 等.新型分子标记-SRAP与TRAP 及其应用[J].遗传, 2004, 26(5): 777-781.
[3]徐操, 赵宝华.SRAP 分子标记的研究进展及其应用 [J].生命科学仪器, 2009, 7(4): 24-27.
[4]Ruiz J J, García-Martínez S, Picó B, et al.Genetic variability and relationship of closely related Spanish traditional cultivars of tomato as detected by SRAP and SSR markers [J].Journal of the American Society for Horticultural Science, 2005, 130(1): 88-94.
[5]Tang L H, Xiao Y, Li L, et al.Analysis of genetic diversity among Chinese Auricularia auricula cultivars using combined ISSR and SRAP markers [J].Current Microbiology, 2010, 61(2): 132-140.
[6]陈碧云, 胡琼, Dixelius C, 等.利用 SRAP 分析核盘菌遗传多样性 [J].生物多样性, 2010, 18(5): 509-515.
[7]王辉, 刘长远, 赵奎华, 等.辽宁省辣椒疫病菌多态性及致病力分化研究初探 [J].微生物学通报, 2012,39(2):180-190.
[8]Costa A S.Mancha aureolada erequeima do fumo causades por corticium solani [J].Biologicol, 1948,14:113-114.
[9]Vargas E.Infection by basidiospores ofThanatephoruscucumeriscausing a foliar disease in tobacco [J].Turrialba,1973, 23:357-359.
[10]Shew H D, Main C E.Rhizoctonialeaf spot of flue-cure tobacco in North Carolina [J].Plant disease, 1985, 69: 901-90.
[11]吴元华, 王左斌, 刘志恒,等.我国烟草新病害—靶斑病[J].中国烟草学报, 2006, 12(6): 22-23.
[12]伏颖, 吴元华, 穆凌霄,等.烟草靶斑病菌基因组DNA提取及RAPD反应体系的优化 [J].烟草科技, 2011, 11:71-75,78.
[13]伏颖, 赵秀香,赵艳琴, 等.烟草靶斑病侵染特性研究 [J].中国烟草学报, 2012, 18(5): 56-59.
[14]吴元华, 赵艳琴, 赵秀香,等.烟草靶斑病原鉴定及生物学特性研究 [J].沈阳农业大学学报,2012,43(5):521-527.
[15]张丽, 周兰英, 肖千文, 等.正交试验设计在建立杜鹃花RAPD-PCR反应体系中的应用 [J].北方园艺,2007(5):124-126.
[16]任小巍, 王瑜, 袁庆华.正交设计优化草地早熟禾SRAP-PCR反应体系及引物筛选 [J].草业科学,2012(3):411-416.
[17]张平湖, 刘冠明.橄榄SRAP-PLR体系的建立和优化[J].中国农学通报, 2010,26(15):86-88.
Establishment and optimization of SRAP-PCR reaction system forRhizoctonia solanifrom tobacco target spot
ZHAO Yanqin1,2, WU Yuanhua1, ZHAO Xiuxiang1, AN Mengnan1, CHEN Jianguang1
1 College of Plant Protection, Shenyang Agricultural University, Shenyang 110866, China;
2 College of Agriculture, Inner Mongolia University for the Nationalities, Tongliao, 028043 China
SRAP primer pairs were screened for polymorphism using DNA ofRhizoctonia solaniisolates YC-9, LJT-8 and QYS-7 as templates.An orthogonal design of L16(45)was used to optimize SRAP-PCR reaction system forR.solaniof tobacco with 5 factors, namely Mg2+, dNTPs, primers, Taq DNA polymerase and template DNA.Results showed that a total of 13 polymorphic SRAP primer pairs were screened out of 100 SRAP primer pairs, and a suitable SRAP-PCR reaction system forRhizoctonia solanifrom tobacco target spot was 2.0 mmol.L-1 Mg2+, 200 mmol.L-1 dNTPs, 0.8U Taq DNA polymerase, 140 mmol.L-1 primer pairs, 20 ng template DNA and 1×PCR buffer.In addition, each factor in SRAP-PCR reaction system had different effects on amplified patterns in descending order of Taq DNA polymerase> primer>Mg2+> dNTPs=DNA.
Rhizoctonia solanifrom tobacco target spot; orthogonal experiment design; optimization of reaction system; primer screening
10.3969/j.issn.1004-5708.2014.03.016
S432.41; Q78 文献标志码:A 文章编号:1004-5708(2014)03-0096-06
国家烟草专卖局科技攻关项目 [国烟办综 (2010)182号];辽宁省烟草专卖局科技攻关项目[辽烟计(2010)86号]
赵艳琴(1978—),博士研究生,植物病原真菌学,Email:zhaoyanqin782828@qq.com
吴元华(1963—),博士,教授,植物病理学及生物农药,Email:wuyh09@vip.sina.com
2013-04-23
