烤烟营养生殖转换期叶片生长标志蛋白的筛选
2014-11-24杨惠娟王景许俐刘国顺史宏志
杨惠娟,王景,许俐,刘国顺,史宏志
河南农业大学烟草学院 /国家烟草栽培生理生化研究基地/ 烟草行业栽培重点实验室郑州文化路95号,450002
生物技术
烤烟营养生殖转换期叶片生长标志蛋白的筛选
杨惠娟,王景,许俐,刘国顺,史宏志
河南农业大学烟草学院 /国家烟草栽培生理生化研究基地/ 烟草行业栽培重点实验室郑州文化路95号,450002
通过双向电泳的方法对烤烟营养、生殖生长转换时期叶片的蛋白质表达谱进行比较研究,鉴定出在两个时期叶片中差异表达的8个标志蛋白。其中有6个蛋白在烤烟营养生长时期的叶片中表达量较高,分别是与光合相关的叶绿体放氧复合蛋白(chloroplast oxygen-evolving complex/thylakoid luminal 25.6kDa protein),光呼吸过程中的关键酶丝氨酸羟甲基转移酶1(SHM1,Serine transhydroxymethyltransferase 1),与蛋白质合成及植物生长发育和细胞分裂有关的核糖体60S与30S蛋白,谷胱甘肽硫转移酶(GST,glutathione S-transferase)和葡聚糖内糖基转移酶(XET,xyloglucan endotransglycosylase )。另外2个碳同化过程中的关键蛋白1,5-二磷酸核酮糖羧化酶/加氧酶Rubisco大亚基(Ribulose-1,5-biphosphate carboxylase/ oxygenase large subunit)和小亚基(Small subunit ribulose 1,5-bisphosphate carboxylase)则在烤烟生殖生长时期的叶片中表达量较高。结果表明烤烟在营养向生殖生长转换过程中叶片通过调节关键途径的蛋白表达以降低叶片的呼吸作用、蛋白质合成过程及抗氧化能力,同时增强叶片的碳同化过程。
烤烟 ;营养生长; 生殖生长;蛋白质组
植物从种子发芽到根、茎、叶的生长,花序分化,开花结实要经过外部形态、内部构造的一系列复杂生理生化的变化过程。其中,营养生长向生殖生长的转变是植物生长过程中的一个重要阶段。营养生长到生殖生长时期的转变意味着植物的生长逐渐进入成熟时期,而植物的内在生理变化是主导植物生长发育时期转变的主要因素[1]。自然界大部分开花植物都是先形成叶这样的营养器官,然后在一定阶段顶端分生组织从营养生长转化成生殖生长,从而产生花及生殖器官[2]。营养、生殖转换时期是植物体内各生理过程发生重要变化的时期,这两个时期的植物生理状态与生长方向有着极大的不同。开花是植物整体进入生殖生长时期的标志,在这一过程中植物顶端分生组织从细胞内部的代谢途径到外部表型都会发生一系列程序化的变化,与开花相关的基因的表达是实现这一转变的基础, 环境因子如春化作用和光周期以及细胞自身的生长状况对这些基因的表达都起着调控作用。有研究结果表明外界因子诱导植物开花的接受器官是叶,叶片在感知外界变化后通过产生信号物质传递给顶端分生组织然后导致植物开花,该结果表明叶在植物营养、生殖生长时期的转换过程中发生了显著的内在变化,从而对植物营养生殖生长时期的转变起了重要的作用[3]。
在生产中通过打顶措施来适当延长和增强烤烟的营养生长同时控制烟株的生殖生长,以获得优质的烤烟叶片。因此,研究烤烟在营养生殖转换时期叶片的生理变化特征及其内在变化机制,对于控制烤烟叶片生长状态有着积极的意义。本文以研究烤烟在营养与生殖转换过程中的关键响应蛋白为目的,旨在了解在烤烟营养生长与生殖生长转换期叶片中主要差异表达的蛋白,并对相关蛋白的功能和作用进行了探讨。
1 材料和方法
1.1 试验设置
供试烟草品种为K326,试验地点为河南省平顶山市郏县。于2010年3月4日播种育苗, 5月11日移栽,种植管理方法均按照当地常规进行。移栽后50 d(烤烟以营养生长为主)和60 d(烤烟以生殖生长为主)时取中部第12叶位叶片,液氮冷冻置-80℃冰箱保存。
1.2 蛋白样品的制备
叶片蛋白样品提取采用植物蛋白微量提取试剂盒(Tiands, Inc, China)。蛋白提取物溶于200 μL缓冲液(8 M尿素,2 M硫脲,4% (v/v) CHAPS,2% (v/v) IPG缓冲液(pH3-10)和30 mM DTT)。混合液室温下放置10 min后,4 ℃冰浴超声降解2 min,再经15000 g、15 min离心两次,取上清液-80 ℃冰箱保存。
1.3 双向电泳分离和图谱分析
第一向为蛋白样品的等电聚焦,操作方法参照IPGphor等电聚焦系统(Amersham Biosciences)。上样量为80 µg的蛋白样品,于500 µl的上样缓冲液中溶解,所用胶条为24 cm电解质胶条(pH 3-10, Liner,Amersham Biosciences)。上样缓冲液成分包括8.0 M尿素, 2% (w/v) CHAPS, 30 mM DTT, 0.5% (v/v) IPG缓冲液(pH 3-10), 和 0.002% (w/v) 溴酚蓝。等电聚焦程序设置为:30 V,12 h;200 V,500 V,2000 V,4000 V,各1 h;8000 V,11 h;程序总共为95060 Vh。聚焦结束后将IEF胶条放入平衡缓冲液Ⅰ中孵育15 min,组分为6 M Urea, 30% glycerol, 2% SDS,0.05 M Tris pH 8.8,1% DTT,之后再将胶条转入平衡缓冲液中Ⅱ中孵育15 min,其组分为6 M Urea, 30%glycerol, 2% SDS, 0.05 M Tris Ph 8.8 ,2.5 % 碘乙酰胺。经2次平衡后将胶条转移至14.5%聚丙烯酰胺SDS分离胶上进行第二向蛋白质凝胶电泳。聚丙烯酰胺凝胶电泳于15℃进行(Ettan DALT six electrophoresis unit,Amersham Biosciences)。结束以银染法进行染色,凝胶经高清晰度图像扫描仪(PowerLook 2100xl-USB,UMAX)扫描。每个样品重复3次,所得蛋白表达图谱用ImageMaster 2D Platinum 6.5.软件分析。蛋白质点的Ratio(打顶后/打顶前)值大于1.50或者低于0.67的蛋白质点为差异表达蛋白。
1.4 胶内酶解和蛋白鉴定
将差异表达蛋白点从凝胶中割下,放入褪色液(30 mmol/L K3Fe(CN)6,100 mmol/L Na2S2O3以1:1 体积比配制)中褪色。经milli-Q水洗涤后,浸入200mmol/L碳酸胺平衡缓冲液中平衡20 min,再以milli-Q水洗两遍。经乙腈脱水后,于真空离心蒸发器(Thermo Savant, USA)中干燥30 min,加入5 μL的胰岛素于4 ℃水化40 min(sequencing grade;Promega, Madison, WI, USA),37 ℃温育过夜或者大于20 h,最后加入100 μL 的0.1 %三氟醋酸和 60%乙腈的混合液浸提15 min以萃取样品,经真空离心蒸发器干燥后,再溶解于1.5 μL,0.1%的三氟醋酸中备用。
将获得的肽段与溶解于0.1% TFA,50% CAN溶液中、浓度为5 mg/mL的α-氰基-4-对羟基桂皮酸(HCCA , Sigma, St.Louis, MO, USA)等体积混合,将样品溶液点至点样板后,于室温干燥。蛋白质鉴定所用质谱仪为4800 MALDI-TOF/TOF(Applied Biosystems, Foster City, CA, USA)。运用GPS ExplorerTM software Version 3.6 (Applied Biosystems,Foster City, CA, USA)和MASCOT搜索引擎(Version 2.2; Matrix Science, London, UK)对蛋白和肽段进行鉴定。查询参数为NCBInr数据库,绿色植物种属,胰蛋白酶消化,MS(一级质谱)和MS/MS(二级质谱)最大容许误差范围为100×10-6,肽片段分子量最大容许误差范围为± 0.8 Da。经MS/MS质谱查询,置信区间> 95%的结果为蛋白鉴定的最终信息。
1.5 总RNA的提取及cDNA的合成
RNA的提取:取约0.1 g的烟草叶片组织在液氮中研磨成粉末状,加入1 mL的Trizol(Invitrogen,USA)于冰上研磨约10 min,转移至1.5 mL的离心管中。室温静置5 min后加入0.2 mL氯仿,剧烈震荡30 s,室温孵育3 min,10000×g于4 ℃离心15 min,转移上层水相于一新离心管中,加入500 μL异丙醇,室温沉淀10 min,12000×g离心弃上清,沉淀用75%的乙醇清洗后溶于30~50 μL的无菌水备用。取约1 μg的总RNA经反转录成cDNA,反转录所用试剂为M-MLV Reverse Transcriptase(LifeFeng,China)。逆转录的cDNA于-20 ℃冰箱保存。
1.6 实时荧光定量PCR分析
反应采用20 μLPCR体系:10 μL SYBR Premix(2×)、5.2 μL无菌水、1 μL cDNA、各0.4 μL(10 mM)的荧光定量上、下游引物。以18s基因为对照基因,分别对内参基因18s和目的基因Rubisco大亚基(l-rub)、小亚基(s-rub)特异引物进行荧光定量PCR(Eppendorf, Germany)扩增,得到Cycle Threshold(CT)值,利用SYBR Green I荧光定量PCR检测目的基因的转录水平(Mastercycler realplex2,Eppendorf, Germany),操作步骤参照SYBR Premix Ex TagTm(TaKaRa, Japan)说明书进行。引物序列为 18s F:5’-CGGCTACCACATCCAAGGAA-3’,18s R:5’-GCTGGAATTACCGCGGCT-3; s-rub F: 5’-TCTTACACGTGGCACCTCCA-3,s-rub R:5’- CAACAACCCCCTCATCTTGG -3’; l-rub F:5’-GCACAGGCTGAAACAGGTGA -3,l-rub R: 5’-CGGAACGCCCAATTCTCTAG -3’。扩增程序为94℃ 30 s,94 ℃ 5 s,60 ℃ 34 s,40个循环反应,溶解曲线程序为 95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。操作步骤参照SYBR Premix Ex TagTm (TaKaRa, Bio.,Inc., Japan)说明书进行。每个样品反应设3次重复,通过2¯△△CT方法计算目的基因的相对表达量(CT,Cycle Threshold)。
2 结果
2.1 烤烟营养生殖生长转换时期叶片差异蛋白的筛选
通过对烤烟移栽后50 d(营养生长为主)的与移栽后60 d(生殖生长为主)叶片的蛋白质表达谱进行分析,共有8个差异表达的蛋白质相对丰度比值(ratio)大于1.5或是小于0.67(图1,图2,表1)。其中有6个蛋白质是在叶片营养生长时期表达量较高,而另外2个蛋白质则在生殖生长时期表达量较高。
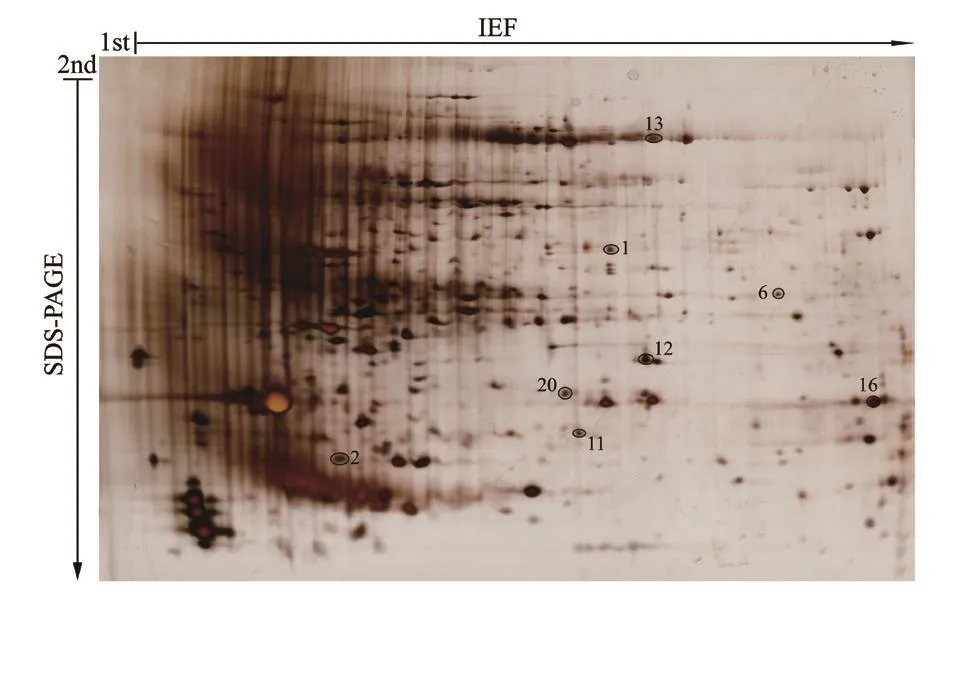
图1 烟草叶片蛋白质双向电泳图谱Fig.1 2-dimensional electrophoresis pattern of the proteins in tobacco leaf
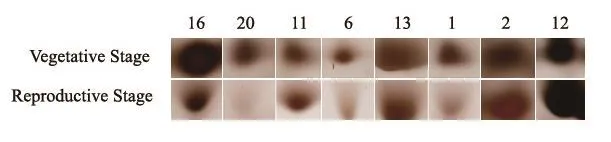
图2 烤烟营养生长与生殖生长转换时期叶片差异蛋白质点Fig.2 Detailed spots images of successfully identified differentially expressed proteins between the two growth stages
2.2 差异表达蛋白质的鉴定
通过质谱和生物信息学鉴定和分析, 8个差异表达蛋白的详细信息如表1所示。6个在营养生长时期高表达的蛋白分别是:叶片光合相关的叶绿体放氧复合蛋白(chloroppast oxygen-evolving complex/thylakoid luminal 25.6 kDa protein)、光呼吸过程中的关键酶丝氨酸羟甲基转移酶1(SHM1,Serine hydroxyl transferase 1)、与蛋白质合成及植物生长发育和细胞分裂有关的核糖体60S与30S蛋白、谷胱甘肽硫转移酶(GST,Glutathione S-transferase)和葡聚糖内糖基转移酶(XET,Xyloglucan endotransglycosylase )。2个在生殖生长时期叶片中高表达的蛋白是碳同化过程中的关键蛋白Rubisco大亚基(Ribulose-1,5-biphosphate carboxylase/ oxygenase large subunit) 和 Rubisco小 亚 基(Small subunit ribulose 1,5-bisphosphate carboxylase)。
2.3 烤烟营养生殖生长转换期叶片Rubisco大亚基与小亚基的mRNA的表达量
在鉴定的8个差异蛋白中,在生殖生长时期的叶片中Rubisco大亚基与小亚基表达量较高。为了验证其在mRNA水平上的积累量,用实时定量PCR方法对Rubisco大亚基与小亚基蛋白的mRNA进行了检测(表2,表3)。结果表明营养生长时期叶片中Rubisco大亚基在mRNA水平表达量是生殖生长时期的表达量的0.4倍, Rubisco小亚基在两个时期的表达量几乎相当。
3 讨论
在营养生殖转换时期植物的各个器官均发生了重要的生理变化。有文献报道,叶片是感知外界因素诱导开花的主要器官,说明叶片的生理变化在植株生育发育转变过程中起了关键的作用。
我们通过对烤烟营养生长、生殖生长关键转换期的叶片的蛋白质表达谱进行分析研究,鉴定出8个在该转换期差异表达的蛋白。其中6个在以营养生长为主的叶片中高表达的蛋白是叶绿体放氧复合蛋白、SHM1、核糖体60S与30S蛋白、GST、和XET。
叶绿体放氧复合蛋白与SHM1与植物的光合和光呼吸过程有关。叶绿体放氧复合蛋白属于叶绿体类囊体腔蛋白,叶绿体蛋白与叶片的光合功能有密切的关系,类囊体是叶绿体的关键组成部分,是叶绿体光反应过程中氧化水分子释放出氧气所不可缺少的酶类[6]。SHM1属于丝氨酸羟甲基转移酶SHMT中的一种,它的主要生理学功能是催化丝氨酸和甘氨酸之间可逆的互换,在高等植物的光呼吸中起着非常重要的作用[7]。如果植物缺少SHMT,通常会导致严重的生长延迟。SHM1编码的丝氨酸羟甲基转移酶参与植物的光呼吸过程,在转录丰度上有周期性,在叶片中的表达和积累受光的强烈诱导[8-10]。也有研究表明苹果树中的丝氨酸羟甲基转移酶(SHMT)只在营养生长时期明显大量表,在生殖生长时期不表达[11]。植物的呼吸作用在植物的各个生长时期也会发生变化,如红杉中的呼吸速率在在幼年期较强,但在成熟期则变弱[12]。研究表明在营养生长与生殖生长两个时期中,与植物光呼吸相关的一些生理过程在营养生长时期作用较强。我们的结果也发现叶绿体放氧复合蛋白与SHM1这两种与光呼吸作用相关的酶在烤烟营养生长时期的叶片中积累较多,而在生殖生长时期的叶片中积累降低,表明处于营养生长时期的叶片具有较强的光合反应能力,也具有较强的光呼吸能力,叶片的这一生理特征可以在烟株的营养生长时期为植株提供充足的光合产物,为植物的快速生长提供条件。伴随着旺盛、活跃的生长代谢过程,叶片也具有较强的光呼吸过程,也将消耗掉一部分的能量物质。营养生长阶段呼吸速率的增强反映出植物为了适应此阶段旺盛的代谢过程而需要大量的能量。所以,叶绿体放氧复合蛋白与SHM1可以很好的表征叶片的光合与呼吸生理过程。
60S 核糖体蛋白L12-3 与30S核糖体蛋白S10在营养生长时期也有较高的积累,核糖体蛋白的功能除组成核糖体、参与蛋白质生物合之外还参与复制、转录加工、翻译调控、DNA修复、自体翻译、细胞凋亡调控、正常细胞的恶性转化及发育调控过程[13-15]。在植物体内,核糖体基因的突变会影响植物体的胚胎发育及生长发育[16-19]。有研究表明在细胞分裂期[19-21],激素处理的胚轴、分生组织的顶端、幼叶及侧根中核糖体基因表达均较高[22-23],说明生长迅速、代谢旺盛的组织和生长时期核糖体蛋白表达量都会有所升高。我们的结果也发现60S 核糖体蛋白L12-3 与30S核糖体蛋白S10在营养生长时期的叶片中的表达量比生殖生长时期的表达量高,表征营养生长时期的叶片生长及蛋白合成相对处于较旺盛的时期,而生殖生长时期的叶片相对较弱,也表明在营养生长向生殖转换的时期叶片的生长及蛋白合成功能会受到抑制。
葡聚糖内糖基转移酶XET与植物的细胞壁的修饰有关。它在植物细胞分化、 扩展和细胞特化等多方面起重要作用,有学者认为它可能是植物生长机制中的核心酶[22]。谷胱甘肽转移酶,在植物的生长发育、次生代谢和抗逆反应中有重要作用。它也受生长素、乙烯等植物激素的诱导表达,与植物的生长发育密切相关[25]。GST属于抗氧化酶类,具有抵抗衰老,清除自由基、维持和保护正常的机体生理功能的作用。XET与GST这两种酶在植物中均能起到促进植物生长发育的作用,提高叶片抗氧化和抗衰老的能力。XET与GST这两种酶蛋白在烤烟营养生长时期的叶片中表达量较高也说明在烤烟的营养生长阶段,叶片出于生长的旺盛期,其组织细胞壁的扩展速度与细胞的抗氧化能力都较强。与此相反,在烤烟的生殖生长时期,叶片的扩展已逐渐停止,并进入衰老生长,其抗氧化能力也将逐渐降低
在烤烟以生殖生长为的生长时期的叶片中,Rubisco大亚基和小亚基两个蛋白的积累量较高。Rubisco是光合碳同化作用的关键酶[26]。同时也参与植物的光呼吸代谢途径,消耗植物光合作用合成的有机物[27]。Rubisco一般由多个大亚基(LSU) 和小亚基(SSU) 组成[28]。大亚基具有催化功能,小亚基具有调节作用。小亚基能促进 CO2, 与Mg2+对酶的活化,维持和稳定酶的活化构象,小亚基可能在进化过程中起了聚集大亚基活性位点的角色,小亚基可能有更多特异性功能[29]。在植物的营养生长与生殖生长两个阶段中,植物体内某些与光合作用相关的酶会发生变化,有研究表明RuBisco在常春藤叶柄中的表达量在营养阶段和生殖阶段具有明显差异[30-31]。Rubisco对植物的生长发育有重要作用,与氮的吸收、利用及循环也有密切关系。烤烟在进入生殖生长时期后,需要消耗大量的同化产物和能量物质用于以开花为主的生殖生长。 Rubisco大、小亚基蛋白在生殖生长时期的烤烟叶片中积累量较高表明该时期的叶片碳同化生理过程也较强,有利于合成较多的同化产物,以满足生殖生长时期大量的能量消耗。本研究还对Rubisco大、小亚基蛋白在烤烟营养生殖转换时期叶片中的mRNA积累量进行了研究。在烤烟营养生长时期的叶片中表达量也是较低,仅为生殖生长时期的0.4倍和 1.06倍,该结果在mRNA水平也证实Rubisco大、小亚基在烤烟生殖生长时期的叶片中表达量较高。生殖生长时期的烤烟叶片Rubisco大、小亚基可以作为标志蛋白表征叶片的碳同化功能与叶片营养生长向生殖生长转换期的标志蛋白。
4 结论
本研究筛选出烤烟营养生长时期向生殖生长时期转化过程中叶片表达具有明显差异的8个标志蛋白。结果提示我们在烤烟以营养生长为主的时期,叶片处于快速生长期,代谢旺盛,有较强的蛋白合成和呼吸作用以及抗氧化能力,而在以生殖生长为主的时期,植物则需要较高的碳同化酶来为积累较多的光合产物为随后大量消耗能量的生殖生长提供条件,从而完成从营养生长向生殖生长的转换。

表1 差异点的质谱鉴定结果以及信息学分析Tab. 1 List of the differentially expressed proteins successfully identified by MALDI-TOF/TOF
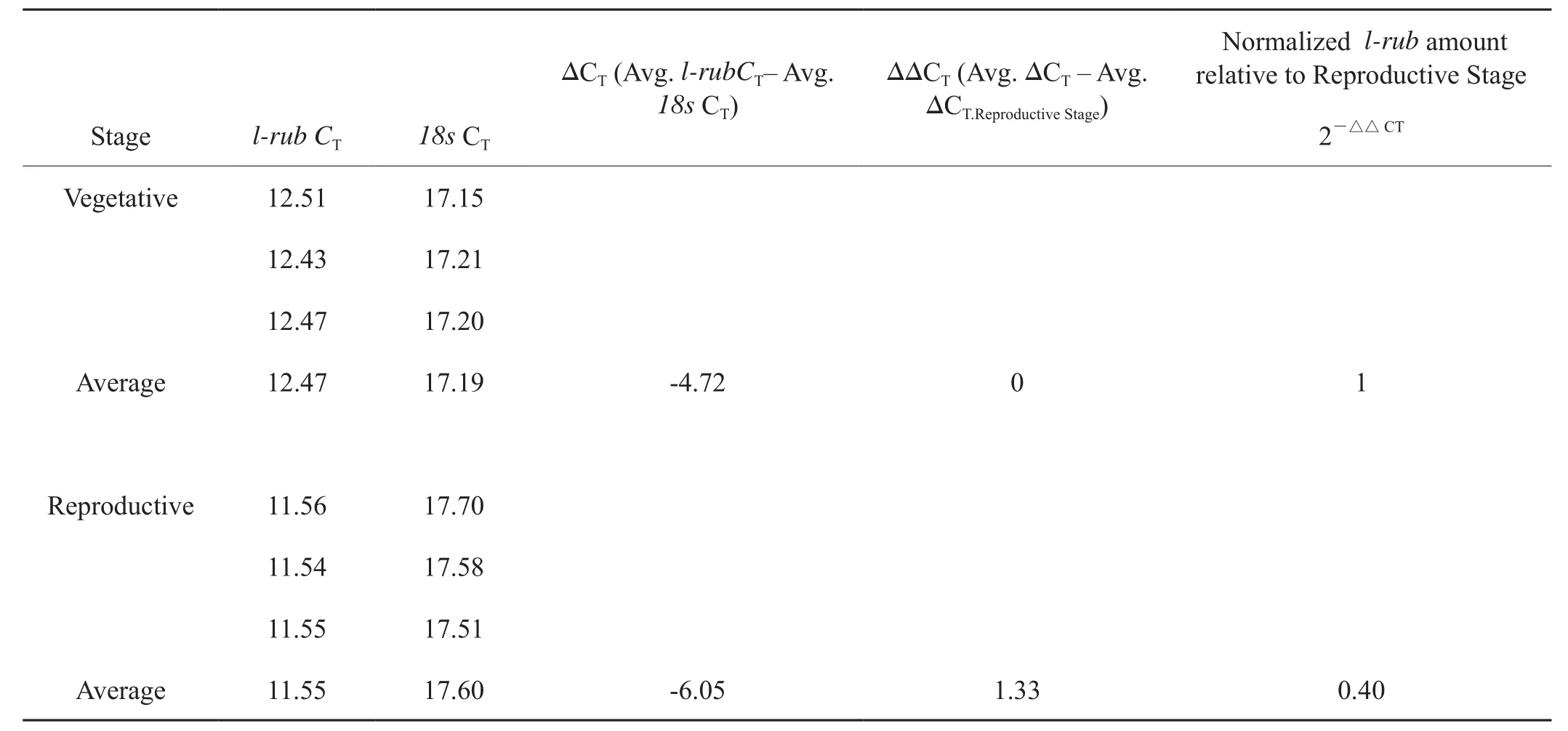
表2 50 d、60d Rubisco大亚基l-rub的mRNA的相对表达量Tab.2 The relative mRNA expression level of Rubisco large subunit (l-rub) in leaves 50 days after transplanting compared with that 60 days after transplanting
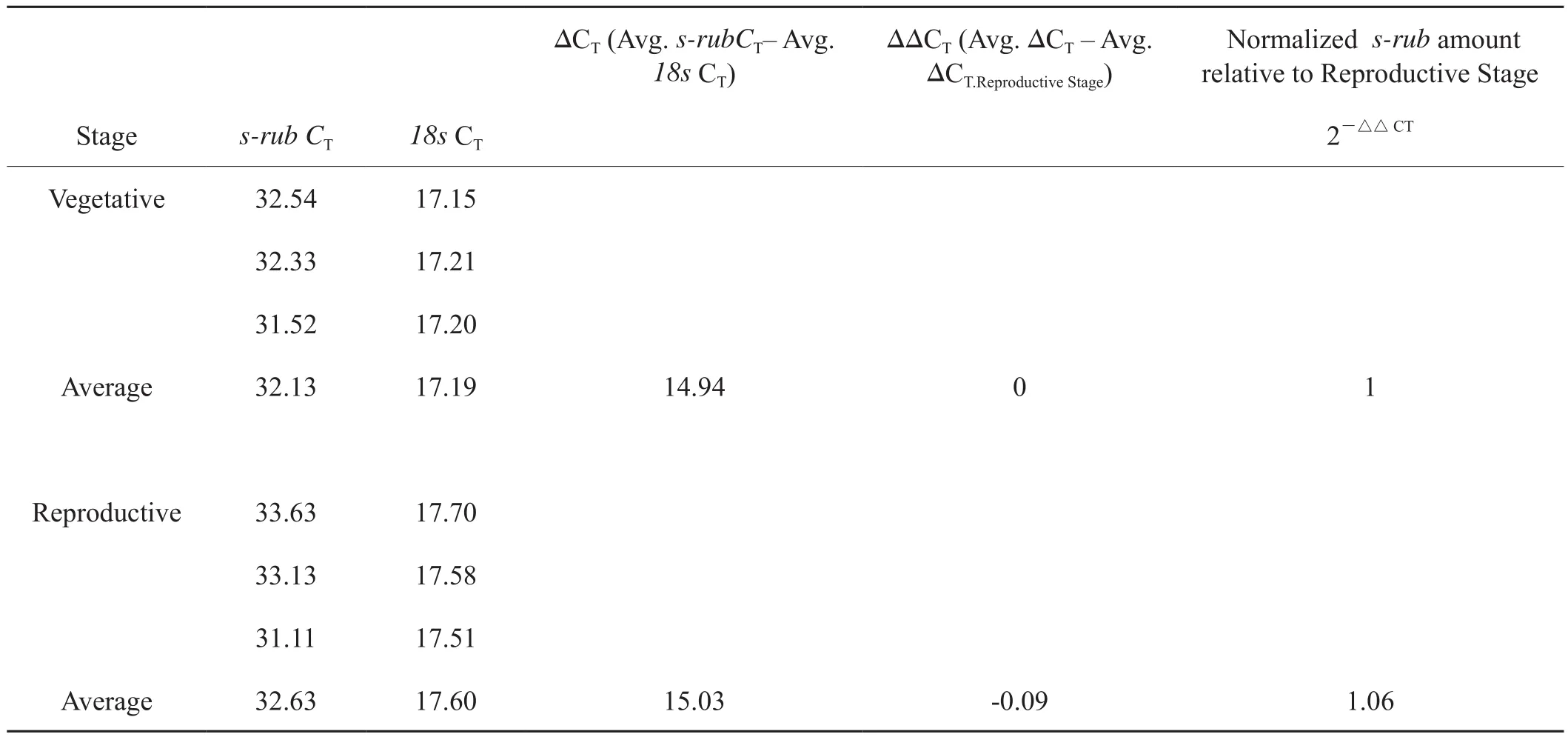
表3 移栽后50 d、60d Rubisco小亚基s-rub的mRNA的相对表达量Tab.3 The relative mRNA expression level of Rubisco small subunit (s-rub) in leaves 50 days after transplanting compared with that 60 days after transplanting
[1]Hackett W P.Phase change and intra-clonal variability [J].HortScience, 1983,18:840-844.
[2]Zimmerman R H, Hackett W P, Pharis R P.Hormonal aspect of phase-change and precocious flowering [J].Encyclopedia of Plant Physiology,1985, 11:79-115.
[3]Yang L, Conway S R, Poethig R S.Vegetative phase change is mediated by a leaf-derived signal that represses the transcription of miR156 [J].Development,2011, 138:245-249.
[4]Shevchenko A, Wilm M, Vorm O, et al.Mass spectrometric sequencing of proteins from silver-stained polyacrylamide gels [J].Analytical Chemistry,1996, 68:850-858.
[5]Yan J X, Wait R, Berkelman T, et al A modified silver staining protocol for visualization of proteins compatible with matrix-assisted laser desorption/ionization and electrospray ionization-mass spectrometry [J].Electrophoresis, 2000, 21:3666-3672.
[6]布坎南B B,格鲁依森姆 W,琼斯R L.植物生物化学与分子生物学[M].瞿礼嘉,顾红雅,白书农,等,译.北京:科学出版社,2004:131- 483.
[7]Stanfffer George V, Baker Carol A, Brenchley Jean E.Regulation of serine transhydroxy-methylase activity in salmonella typhimurium [J].Journal of Bacteriology,1974,120(3):1017-1025.
[8]McClung C R, Hsu M, Painter J E, et al.Integrated temporal regulation of photorespiratory pathway [J].Circadian regulation of two Arabidopsis genes encoding serine hydroxymethyltransferase [J].Plant Physiology,2000, 123:381-392.
[9]Bardel J, Louwagie M, Jaquinod M, et al.A survey of the plant mitochondrial proteome in relation to development [J].Proteomics, 2002, 2:880-898.
[10]马莉,陈丽梅.植物丝氨酸羟甲基转移酶基因研究进展[J].生物技术通报,2008,2:15-19.
[11]Zeng G J, Li C M, Zhang X Z, et al.Differential proteomic analysis during the vegetative phasechange and the floral transition in Malus domestica [J].Development Growth &Differentiation, 2010, 52:635-644.
[12]Huang L C, Weng J H, Wang C H, et al.Photosynthetic potentials of in vitro-grown juvenile, adult, and rejuvenated Sequoia Sempervirens (D.Don) Endl.Shoots [J].Botanical Bulletin of Academia Sinica, 2003, 44:31-35.
[13]Wool I G.Extraribosomal functions ribosomal proteins[J].Trends In Biochemical Sciences, 1996,2l:164-165.
[14]Clemens M J.Targets and mechanisms for the regulation of translation in malignat transformation [J].Oncagene,2004, 23:3180-3188.
[15]Stoneley M, Willis A E.Aberrant regulation of translation initiation itumorigenesis [J].Current Molecular Medicine,2003, 3:597-603.
[16]Van Lijsebettens M, Vanderhaeghen R, De Block M, et al.An S18ribosomal protein gene copy at the Arabidopsis PFL locus affects plant development by its specific expression in meristems [J].EMBO Journal, 1994, 13:3378-3388.
[17]Tsugeki R, Kochieva E Z, Fedoroff N V.A transposon insertion in the Arabidopsis SSR16 gene causes anembryodefective lethal mutation [J].Plant Journal, 1996, 10: 479-489.
[18]Revenkova E, Masson J, Koncz C, et al.Involvement of Arabidopsis thalianaribosomal protein S27 in mRNA degradation triggeredby genotoxic stress [J].EMBO Journal, 1999, 18:490-499.
[19]Ito T, Kim GT, Shinozaki K.Disruption of an Arabidopsis cytoplasmic ribosomal protein S13-homologousgene by transposon-mediated mutagenesis causes aber-rant growth and development [J].Plant Journal, 2000, 22:257-264.
[20]Joanin P, Gigot C, Phillips G.cDNA nucleotide sequence and expression of a maize cytoplasmic ribo-somal protein S13 gene [J].Plant Molecular Biology, 1993, 21:701-704.
[21]Garo J, Kim S R, Chung Y Y, et al.Developmental and environmental regulation of two ribosomal protein genes in tobacco [J].Plant Molecular Biology, 1994, 25:761-770.
[22]Gantt J S, Key J L.Coordinate expression of ribosomal protein mRNAs following auxin treatment of soy-bean hypocotyls [J].Journal of Biological Chemistry, 1985,260:6175-6181.
[23]Williams M E, Sussex L M.Developmental regulation of ribosomal protein L16 genes in Arabidopsis thaliana [J].Plant Journal, 1995, 8:65-76.
[24]Van Sandt VST, Suslov D, Verbelen J P, et al.Xyloglucan endotransglucosylase activity loosens a plant cell wall [J].Annals of Botany, 2007, 100:1467-1473.
[25]Smith A P, Nourizadeh S D, Peer W A, et al.Arabidopsis AtGSTF2 is Regulated by Ethylene and Auxin, and Encodes a Glutathione S-transferase that Interaetswith Flavonoids[J].Plant Journal, 2003, 36:433-442.
[26]Lundqvist T, Schneider G.Crystal structure of activated ribulose - l,5 - bisphosphate carboxylase complexed with its substrate,ribulose- l, 5 – bisphosphate [J].Journal of Biological Chemistry, 1991, 266:12604-l2611.
[27]熊晓然,陈蔚梅,冯胜彦,等.植物Rubisco活性中心的模拟分析[J].中国生物化学与分子生物学报,2003,19(4) :493- 498.
[28]Ashida H, Danchin A, Yokota A.Was photosynthetic RuBisCO recruited by acquisitive evolution from RuBisCO-like proteins involved in sulfur metabolism [J].Research in Microbiology, 2005, 156:611-618.
[29]Hutchison K W, Sherman CD, Weber J, et al.Maturation in larch.II.Effects of age on photosynthesis and gene expression in developing foliage [J].Plant Physiology,1990, 94:1308-1315.
[30]Spreitzer R J.Role of the small subunit of ribulose-l,5-bisphosphate carboxylasel oxygenase [J].Archives of Biochemistry And Biophysics, 2003, 414:141-149.
[31]Hubbs A, Roy H.Synthesis and assembly of large subunits into ribulose bisphosphate carboxyllose oxygenese inchloroplast extracts [J].Plant Physiology, 1992, 100:272-281.
Screening of leaf protein marker during transformation from vegetative growth stage to reproductive stage in flue-cured tobacco
YANG Huijuan , WANG Jing , XU Li ,LIU Guoshun , SHI Hongzhi
College of Tobacco Science, Henan Agricultural University, National Tobacco Cultivation & Physiology & Biochemistry Research Center, Key Laboratory of National Tobacco Cultivation, Zhengzhou 450002, China
A comparative study was conducted on protein expression profiling of leaf blade during transformation from vegetative growth stage to reproductive stage in flue-cured tobacco through 2-D electrophoresis, which identified 8 differentially expressed leave protein markers.Among them 6 proteins related to photo-respiratory, protein synthesis and cell development which are chloroplast oxygen-evolving complex/thylakoid luminal 25.6kDa protein, SHM1 (Serine transhydroxymethyltransferase 1), 60S ribosomal protein and 30S ribosomal protein, GST (glutathione S-transferase) and XET (xyloglucan endotransglycosylase) were shown to be highly expressed in vegetative grown leaves.Ribulose-1,5-biphosphate carboxylase/oxygenase large subunit and small subunit ribulose 1,5-bisphosphate carboxylase which are key enzymes related to carbon fixation were found to have a relative high expression level in reproductive grown leaves.The main differentially expressed proteins between these two stages in tobacco leaves showed that during transformation from vegetative growth stage to reproductive stage the photo-respiratory, protein synthesis and anti-oxidation physiology functions decreased while carbon fixation ability were strengthened through the regulation of expression of related proteins.
flue-cured tobacco; vegetative growth stage; reproductivestage;proteome
10.3969/j.issn.1004-5708.2014.03.015
S572.01; Q78 文献标志码:A 文章编号:1004-5708(2014)03-0089-07
河南省教育厅自然科学基础研究计划项目(2013A180474),国家烟草专卖局特色烟重大专项 (No.110201101001)
杨惠娟 (1978—),女,副教授,从事烟草生物技术研究,Email: huijuanyang@henau.edu.cn
史宏志 (1963—),教授,从事烟草栽培生理研究,Email: shihongzhi88@163.com
2013-04-08
