一株高效解磷菌的分离及理化特性研究
2014-11-23张敏敏李玉玺张丽艳
张敏敏,李玉玺,张丽艳
(滨州学院 生命科学系,山东 滨州 256603)
磷是植物生长必需的营养元素之一,它既是植物体内许多重要有机化合物的组分,又以多种方式参与植物体内各种代谢过程,在人类赖以生存的土壤-植物-动物生态系统中起着不可替代的作用[1]。土壤平均含磷量是0.05 (W/W),但只有0.1 能被植物吸收,我国有74 的耕地土壤缺磷,土壤中95 的磷为无效形式,土壤有效磷的缺乏是限制植物生长的主要因素之一。为了获得高产,人们每年都向土壤反复施加大量可溶性磷肥,由于作物对施入的磷肥当季利用效率只有5 ~10,大部分与土壤中的金属离子结合形成难溶性磷酸盐。土壤中存在大量的具有解磷能力的微生物,能够将难溶性的磷酸盐如磷矿粉转化为水溶性磷,提高土壤中的可溶性磷含量,从而改善植物磷素营养,提高作物产量[2-3]。本文以沾化冬枣为研究对象,从其根围土壤中分离筛选具有较强解磷能力的细菌ZMM-3,对其菌落菌株形态、理化性质、最佳培养条件等进行研究,为以后微生物解磷、提高土壤中水溶性磷和制备菌肥提供理论基础。
1 材料与方法
1.1 材料
1.1.1 样品来源
本实验所用土壤样品取自滨州市沾化县下洼镇大王村冬枣园枣树根系周围。
1.1.2 主要培养基
蒙金娜无机磷培养 基[4-6]:葡萄 糖 10 g,(NH4)2SO40.5 g,NaCl 0.3 g,KCl 0.3 g,FeSO4·7H2O 0.03 g,MnSO4·4H2O 0.03 g,MgSO4·7H2O 0.3 g,Ca3(PO4)210g,酵母膏0.4 g,水1 000 mL,pH值7.0~7.5。牛肉膏蛋白胨培养基[7]:牛肉膏3 g,蛋白胨10 g,氯化钠5 g,琼脂20 g,蒸馏水1 000 mL,pH值7.0。
1.1.3 主要试剂和仪器
实验所用钼酸铵、酒石酸锑钾、磷酸二氢钾、浓硫酸、Ca3(PO4)2等试剂均为分析纯。高速低温离心机为Beckman Coulter的Allegra X-22R;分光光度计为TU-1810系列。
1.2 方法
1.2.1 解磷微生物的初筛及纯化
准确称取10 g土壤样品置于90 mL无菌水中,充分震荡混匀制成土壤悬液,将土壤悬液梯度稀释,取稀释液200 μL涂布在蒙金娜无机磷固体培养基上,将涂布好的平板用封口膜封口倒置于生化培养箱(30℃,150 r/min)中培养7 d。菌落长出之后,通过观察菌落产生透明圈(测量其透明圈直径D、菌落直径d,D/d>1.4)的大小来筛选解磷菌[7]。挑取具有较大透明圈的单菌落进行多次纯化,直至通过平板和镜检观察确定其为纯培养物后,挑取该细菌单菌落转至牛肉膏蛋白胨平板(37℃)上培养24 h,待菌落长出将分离得到的菌株均置于4℃冰箱保存。
1.2.2 解磷微生物的复筛
挑取各初筛细菌菌株的单菌落,放于牛肉膏蛋白胨液体培养基中,30℃往复震荡培养至发酵液变浑浊。将发酵液进行离心,10 000 r/min,离心5 min,弃上清,用无菌水将沉淀物重悬,制成菌悬液。按5 接种量将菌悬液接入100 mL蒙金娜无机磷液体培养基中,30℃摇床培养7 d之后将发酵液进行离心,10 000 r/min离心5 min,取上清。采用钼锑抗比色法定量测定上清液中可溶性磷的含量,以不接菌的培养液为空白对照。通过对比各发酵液中溶磷量的大小,筛选出高效解磷菌[2-8]。
1.2.3 菌落、菌株形态观察及菌株革兰氏染色观察[9-10]
观察初筛及复筛平板上菌落的形态特征(大小、颜色、质地、透明度、表面状况、边缘状况、形状及隆起程度),油镜下观察菌株形状,对菌株进行革兰氏染色,观察。
1.2.4 菌株理化性质研究
1)淀粉水解实验
挑取斜面培养基上的菌株接种至淀粉培养基平板上,30℃恒温培养48 h。打开培养皿盖,滴加几滴革氏碘液,轻转使碘液均匀铺满整个平板,若出现无色透明圈,则说明淀粉已水解,呈阳性,否则为阴性。
2)油脂水解实验
挑取斜面上的菌株接种至油脂培养基,30℃恒温培养48 h。观察平板上菌落生长的地方,若出现红色斑点,说明油脂已被分解,为阳性,否则为阴性。
3)明胶液化实验
用穿刺培养法,接种菌株于明胶培养基中,30℃恒温培养48 h,将试管置于冰浴中,观察培养基有无液化情况及液化后的形状。
4)甲基红实验
按照1 的接种量接菌悬液于葡萄糖蛋白胨培养基中,30℃恒温、200 r/min摇床培养48 h。加入3~4滴甲基红试剂,若变红色,则为阳性;若变黄色,则为阴性。
5)V-P反应
按照1 的接种量接菌悬液于葡萄糖蛋白胨培养基中,30℃恒温、200 r/min摇床培养48 h。取2 mL发酵液于试管中,再加入2 mL V-P试剂,充分震荡2 min,37℃水浴30 min,颜色变红为阳性,否则为阴性。
6)柠檬酸盐利用实验
挑取斜面上的菌株接种至柠檬酸盐培养基斜面上,30℃恒温培养48 h。观察培养基上有无细菌生长和是否变色。若呈蓝色,则为阳性;若呈绿色,则为阴性。
7)吲哚实验
按照1 的接种量接菌悬液于蛋白胨培养基中,30℃恒温、200 r/min摇床培养48 h。取5 mL发酵液于试管中,加入2 mL乙醚(呈明显的乙醚层),充分震荡,静置片刻,沿壁加入10滴吲哚试剂,再震荡,静置,若乙醚层呈现玫瑰红色,则为阳性,否则为阴性。
8)过氧化氢酶实验
在洁净的载玻片中央滴2滴3 的过氧化氢溶液,挑取斜面培养基上的菌落,涂抹于过氧化氢溶液中,若产生气泡,则为阳性;不产生气泡,则为阴性。
1.2.5 菌株生长与培养时间的关系
将高效解磷菌株接入牛肉膏蛋白胨液体培养基中制备其菌悬液,按5 的接菌量接入牛肉膏蛋白胨培养液中,混匀后,分装到灭菌的试管中,每支试管装5 mL,用灭过菌的棉塞封口;每隔2 h取样,每次取三支试管,放于4℃冰箱中,最后一起在600 nm下测定发酵液的光吸收值,确定最佳培养时间。
1.2.6 pH值对菌株生长的影响
将高效解磷菌株接入牛肉膏蛋白胨液体培养基中制备其菌悬液,按5 接菌量分别接入pH值为5.0、6.0、7.0、8.0、9.0、10.0的牛肉膏蛋白胨培养基中,每个pH梯度设置三个同等实验。30℃恒温、200 r/min摇床培养24 h,测其在600 nm处的光吸收值,确定最佳pH值。
2 结果与分析
2.1 高效解磷菌的筛选
利用蒙金娜固体培养基分离所采集的沾化冬枣根际土壤中的解磷细菌,获得4株能产生明显溶磷圈的细菌,说明这些菌株具有溶解无机磷能力,将这些细菌分别命名为ZMM-1至ZMM-4。利用蒙金娜液体培养基培养初筛菌株7 d后,测定发酵液中的可溶性磷含量,发现ZMM-3菌株的溶磷能力较强,发酵液中可溶性磷含量为72.26 mg/L,对照组的仅为6.23 mg/L。
2.2 菌落、菌株形态及菌株革兰氏染色特征
对高效解磷菌的菌落特征进行观察,可以看出菌株ZMM-3菌落如图1所示,菌落呈乳白色、圆形、表面凸起、菌落较小、边缘圆整、不透明、黏稠。菌株革兰氏染色如图2所示,呈阴性,油镜下观察为杆菌。
图1 ZMM-3菌落
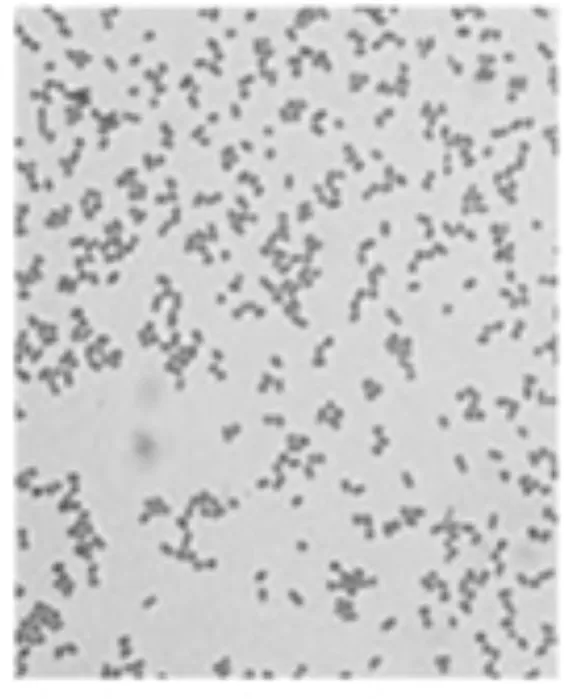
图2 ZMM-3革兰氏染色(10×100)
2.3 菌株生理、生化特征
解磷菌ZMM-3生理、生化特征如表1所示,淀粉水解实验中,滴加碘液后,出现无色透明圈,说明淀粉已被水解,呈阳性。油脂水解实验中,培养48 h后,平板上出现红色斑点,说明油脂已被水解,呈阳性。明胶液化实验中,冰浴后,穿刺周围呈现漏斗状,说明明胶已液化,呈阳性。甲基红实验中,加入甲基红试剂后,溶液变为黄色,呈阴性。V-P反应中,水浴30 min后,颜色变为红色,阳性。柠檬酸盐利用实验中,斜面上有菌落产生,且变为蓝色,呈阳性。吲哚实验中,加入乙醚后,出现分层,乙醚层最终变为玫瑰红色,呈阳性。过氧化氢酶实验中,出现大量的气泡,说明菌株产生了过氧化氢酶,并将过氧化氢氧化,呈阳性。
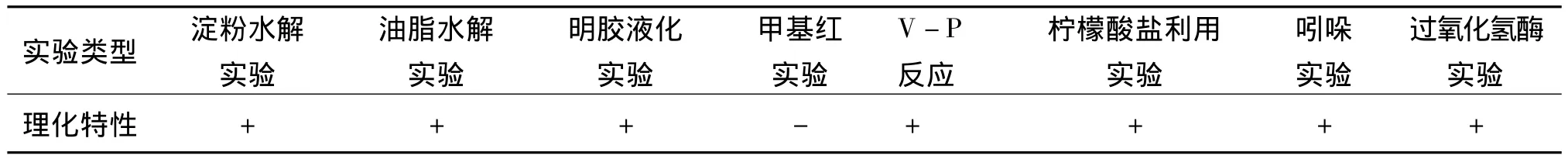
表1 解磷菌ZMM-3生理、生化性质
2.4 pH值对菌株生长的影响
以菌株在牛肉膏蛋白胨液体培养基中的培养时间为横轴,以菌株在不同时间段的牛肉膏蛋白胨培养基在600 nm处的吸光度值为纵轴,绘制生长曲线。pH值不同的牛肉膏蛋白胨培养基对菌体的生长有明显的影响,如图3所示。当基本培养基的pH值处于5~7之间时,菌株OD600值呈上升趋势;当基本培养基pH值超过7以后,菌株OD600值下降;特别是当pH值超过9后,OD值迅速下降,对菌株的生长影响较大,因此,该菌株最佳生长pH值为7。
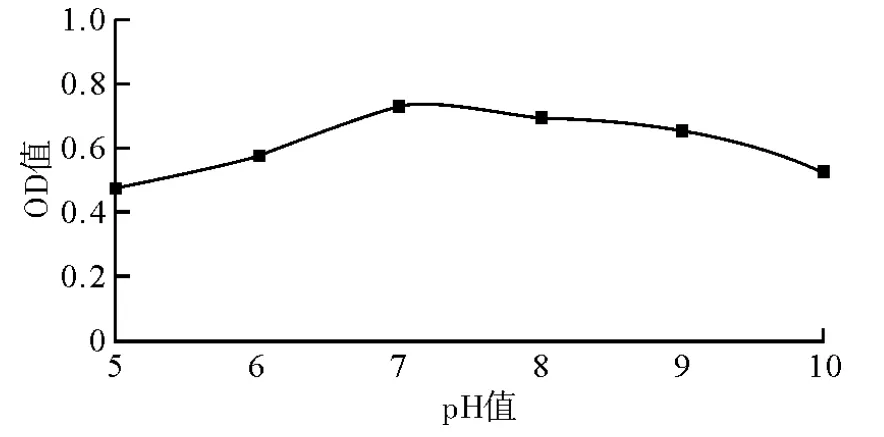
图3 pH值对ZMM-3生长的影响
2.5 菌株生长与培养时间的关系
以菌株在牛肉膏蛋白胨液体培养基中的培养时间为横轴,以菌株在不同时间段的牛肉膏蛋白胨培养基在600 nm处的吸光度值为纵轴,绘制菌株生长与培养时间的关系,如图4所示。0~6 h内解磷细菌处于延滞期,6~16 h内菌株大体处于对数生长期,12~23 h内大体处于典型生长曲线的稳定期,之后逐渐进入衰亡期,因此,菌株的最佳培养时间为16 h。
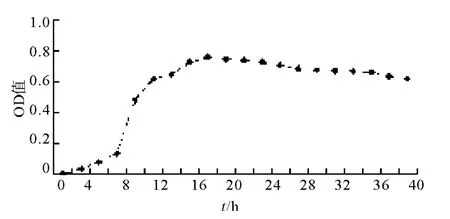
图4 ZMM-3生长与培养时间的关系
3 结束语
本研究从沾化冬枣的根际土壤中分离得到一株高效溶无机磷细菌ZMM-3,在此基础上研究了形态学特征、理化性质、培养条件等。发现该菌株为革兰氏阴性杆菌,菌落呈乳白色、圆形、表面凸起、菌落较小、边缘圆整、不透明、黏稠;淀粉水解实验、油脂水解实验、明胶液化实验、柠檬酸盐利用实验、吲哚实验、P-V实验和过氧化氢酶实验均呈阳性,甲基红实验呈阴性;最佳培养时间为16 h,培养基最适合pH值为7。
[1] 吴平,印莉萍,张立萍.植物营养分子生理学[M].北京:科学技术出版社,2001.
[2] 张毅民,孙亚凯,吕学斌,等.高效溶磷菌株Bmp5筛选及活力和培养条件的研究[J].华南农业大学学报,2006,27(3):61-65.
[3] 陈俊,陆俊锟,康丽华,等.红树林溶磷菌的初步鉴定、溶磷能力测定及其优化培养[J].微生物学通报,2009,36(8):1183-1188.
[4] 蔡磊,李文鹏,张克勤.高效解磷菌株的分离、筛选及其对小麦苗期生长的促进作用研究[J].土壤通报,2002,33(1):44-46.
[5] 覃丽金.高效解磷菌筛选及接种盆栽株花草的效益研究[D].儋州:华南热带农业大学,2006.
[6] Vazquez P,Holguin G,Puente M E,et al.Phosphatesolubilizing microorganisms associated with the rhizosphere of mangroves in a semiarid coast allagoon[J].Biology Fertility of Soils,1999(8):125-146.
[7] 沈萍,陈向东.微生物学实验[M].北京:高等教育出版社,2007.
[8] 任嘉红,刘辉,吴晓蕙,等.南方红豆杉根际溶无机磷细菌的筛选、鉴定及其促生效果[J].微生物学报,2012,52(3):295-303.
[9] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[10] 贺梦醒,高毅,胡正雪,等.解磷菌株B25的筛选、鉴定及其解磷能力[J].应用生态学报,2012,23(1):235-239.
