WspR在大肠杆菌中的表达及其对c-di-GMP合成的影响*
2014-11-23凡责艳木佳毛自朝官会林
凡责艳, 木佳, 毛自朝, 官会林
(1.云南师范大学 能源与环境科学学院,云南 昆明650092;2.云南农业大学 农业与生物技术学院,云南 昆明650201)
可得胶(curdlan),又称热凝胶,是农杆菌ATCC31749菌株所产生的一种胞外多糖,由400~500个D-葡萄糖以β-(1→3)糖苷键线性连接而成的一类葡聚糖[1-2];由于其具有凝胶强度高、热成型后不可逆、无色、无味和保水力强等特性,已被广泛应用于农业、建筑及化工行业等多个领域,在食品、化妆品等中用为添加剂;其抗HIV、抗肿瘤、提高免疫力活性等特性使其具有广阔的医用前景[3-4].目前全球可得胶产品约有60亿美元的市场份额,并预计以每年10%左右的需求速度增长.相关研究发现,大多数细菌胞外多糖的合成受控于新近发现环二鸟苷酸(c-di-GMP),该c-di-GMP是细菌中参与各种生理功能调节的第二信使[5-7],其合成及分解涉及三个蛋白质域,其中GGDEF结构域为c-di-GMP合成中的二鸟核苷酸环化酶,而 EAL 和 HD-GYP域是c-di-GMP分解中的磷酸二酯酶[5,8-9].细菌中广泛分布有 这三个结构域[5-6,9],具有GGDEF、EAL、及HDGYP结构域的蛋白质参与到细菌纤维素生物合成、移动性、附着性、生物膜形成、毒力因子生产和致病 性[7-8,10-12].作为细菌中的第二信使,c-di-GMP除具有上述功能外,还能够刺激胞外多糖的生物合成[13].大量研究表明,从绿脓杆菌(P.aeruginosa)中得到的类超化系统蛋白WspR具有GGDFE结构域,有DGC活性,可促进c-di-GMP的合成[14-17].生物信息学分析发现,土壤农杆菌ATCC31749含有十几个GGDEF保守结构域[18].因此,如能在 ATCC31749中提高 WspR的表达活性,就能提高c-di-GMP的产生,从而促进胞外多糖可得胶的合成.本实验将ATCC31749的WspR克隆到pQE81L,并转入大肠杆菌,以确定WspR的表达是否可促进c-di-GMP的合成,下一步探究WspR在ATCC31749中作用及其对可得胶的合成调控研究提供基础.
1 材料与方法
1.1 材料
1.1.1 菌种、质粒
土壤农杆菌 ATCC31749、WspR cDNA模板,大肠杆菌BL21(DE3),质粒载体pQE81L,均由云南农业大学生物化学与分子生物学实验室提供.
1.1.2 酶和试剂
限制性内切酶(SalI,BamHI)和 T4DNA连接酶购自Promega公司;Tap DNA聚合酶和dNTP购自TakaRa公司;血红素、吖啶黄、ABTS(2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐)、30%过氧化氢购买于sigma公司,其他试剂均为分析纯.
1.2 方法
1.2.1 引物设计与合成
根据GenBank中报道的pQE81L-WspR基因序列,设计合成含有相关酶切位点的上下游引物,并由上海生工生物工程有限公司合成.
1.2.2 目的基因的PCR扩增
根据pQE81L-WspR基因序列设计引物,上游引物:5′-GCGGATAACAATTTCACAC-3′;下游引物:5′-GCAGCACCAGGTTAGTTTCC-3′.PCR反应体系为:WspR 的cDNA 模板2.5 μL,10×PCR buffer 5 μL(含 Mg2+),2.5 mmol/L的dNTP 4μL,50μmol/L的上下游引物各1μL,5U/μL的Tap DNA聚合酶0.5μL,加去离子水至总体积为50μL.PCR反应程序:94℃ 预变性5min;94℃变性30s,55℃退火30 s,72℃延伸45s,共30个循环;72℃延伸5 min.结束反应,PCR产物放置于4℃冰箱,留待电泳检测.PCR产物的检测:配制1%(w/v)的琼脂糖凝胶,取5μL的PCR产物pQE81L-WspR同1μL的6×Loading buffer(1mL 6×Loading buffer混有25μL的花青素)混匀上样,所用Marker为250bp-I DNA ladder.上样后,凝胶于1×TAE缓冲液中,120V,电泳45min.电泳结束后使用IQuant capture凝胶成像分析系统拍照分析.
1.2.3 WspR蛋白表达的初步检测
1.2.3.1 WspR蛋白的诱导表达
将冻存的含有pQE81L-WspR的重组质粒转入BL21菌株中,在LB含卡那霉素抗性固体平板上划线活化,37℃温箱倒置培养12~16h.挑取单菌落接种于LB液体培养基中,于37℃恒温摇床中200rpm振荡过夜培养.次日,按1∶100的比例,将种子液接种于LB液体培养基中,200 rpm,37 ℃振荡培养.待OD600达到0.5~1.0时,加入0.1mol/L的IPTG至终浓度为1mmol/L,之后低温30℃,200rpm振荡培养.并在培养0,2,4,6h后分别取样1mL,留作SDS-PAGE电泳检测.
1.2.3.2 WspR诱导表达后粗蛋白样品的处理
将诱导时所取的样品12 000rpm离心5min,弃去上清液.用无菌去离子水清洗细胞沉淀,同样12 000rpm离心,弃上清,并重复1次.按照0.2g/mL的比例加2×Loading Buffer(其中含5%的巯基乙醇),混匀.混匀后的样品于沸水中煮15min,之后液氮速冻,如此重复3次.解冻后,12 000rpm 离心3min.留待SDS-PAGE检测.
1.2.4 c-di-GMP的粗提取
将菌株BL21pQE81L-WspR、BL21 pQE81L分别用接种环蘸取一定量在已倒好的LB固体培养基上划板培养,37 ℃恒温摇床中180rpm培养12h,然后分别在两菌株平板上挑取一个单菌落接于5mL LB液体培养基中(培养菌株BL21pQE81L-WspR的培养基加入Amp抗生素,培养菌株BL21pQE81L的培养基加入Amp和Kan抗生素),37℃恒温摇床中180rpm振荡培养过夜;取1mL上述菌液接种于50mL LB培养基中,37℃恒温摇床中180rpm振荡培养4~6h,至 OD600值为0.4~0.6左右,停止培养;在超菌台上往培养基中加入0.1M的IPTG 250μL(最终浓度为0.5M)诱导,28℃摇床,180 rpm培养4h.
把上述诱导好的菌液分别用两个50mL的离心管平均分装成两管(每管25mL),高速离心机4℃,12 000rpm离心15分钟;倒掉上清液,沉淀用25mL的双蒸水洗涤一次,4 ℃,12 000 rpm离心10分钟后,再重复一次;倒掉上清液,用1mL 10mM Tris-HCl (pH 8.0,含100mM NaCl)溶液进行重悬;向悬浮液中加入25μL的25mg/mL的溶菌酶;将悬浮液用细胞破碎仪破碎细胞(2mm超声探头,50%功率)每次3s,间隙3s,30min,使外膜破裂,溶菌酶进入细胞壁;向溶液中加入60%的HClO4,至终浓度为20%,使悬浮液的大分子物质沉淀;将悬浮液放置于冰上10min,用约1.5mL 3MKOH(含0.4M Tris和2MKCl)溶液中和至PH=7.0;再次用高速离心机12 000r/min,4℃离心10min;取上清液,用0.2μm滤膜的细菌过滤器进行过滤,即得到c-di-GMP粗提取品,将滤液用2mL的离心管保存在-80℃冰箱备用.
1.2.5 c-di-GMP的初步检测
本过程分成对照组和实验组:对照组加入菌株BL21pQE81Lc-di-GMP的粗提取物,实验组加菌 株 BL21pQE81L-WspR 的 c-di-GMP 粗提物.
取四个无菌2.5mL的离心管,其中两管里加入23ul的pQE81L,另外两管两管里加入23 μL的pQE81L-WspR,然后往四个离心管里各加入50mM Tris-HCl(pH 8.0,含100mM KCl)550μL,血红素32.6μL混匀,放入水浴锅中加热至95℃,并保持5min;冷却上述混合液至常温,保持15min,分别往四个离心管里加入2.6 μL的吖啶黄,放入4 ℃冰箱12h;从冰箱里取出,分别往里面加入109.8μL ABTS,并放入16℃冰箱15min;然后加入5μL的30%的过氧化氢混匀,观察各管内颜色变化,即可检测出c-di-GMP合成酶基因WspR在大肠杆菌中的表达情况.
2 结果与分析
2.1 质粒pQE81L-WspR的构建
将质粒载体pQE81L和目的基因片段WspR进行双酶切,然后用T4DNA连接酶将载体和目的基因片段连接,转化大肠杆菌BL21(DE3)得到重组质粒,如图1所示.
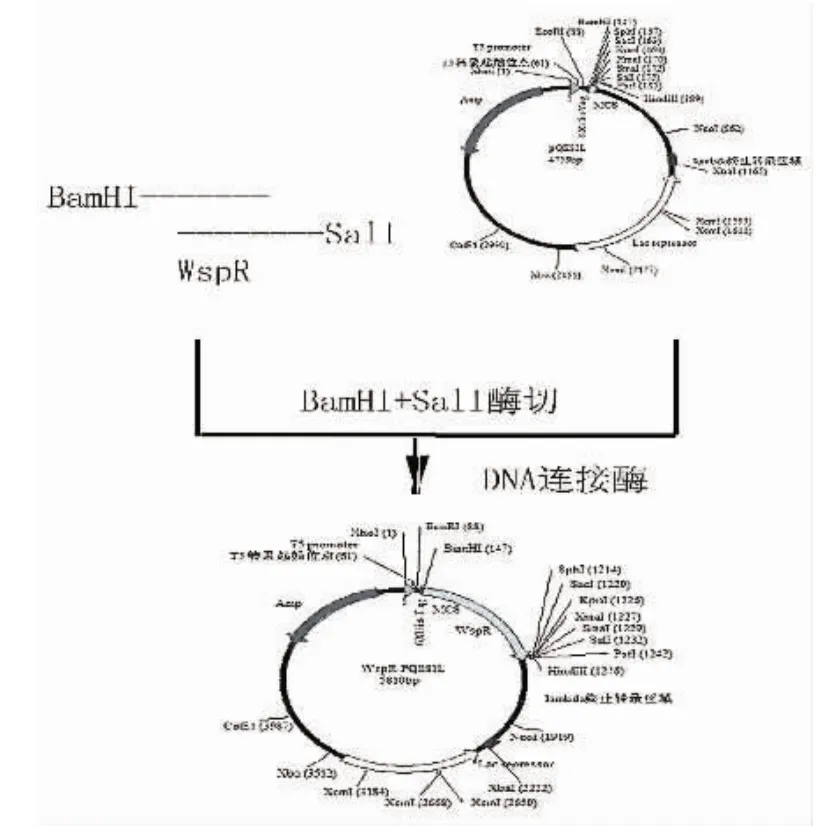
图1 pQE81L-WspR质粒构建流程Fig.1 The process of building plasmid pQE81L-WspR
2.2 PCR扩增检测携带pQE81L-WspR的阳性转化子
转入大肠杆菌中的质粒pQE81L-WspR,经菌落PCR扩增检测呈阳性的克隆提取质粒进行PCR鉴定,1%琼脂糖凝胶电泳检测图谱中呈现588bp左右的目的基因条带,与预期结果一致,说明大肠杆菌BL21PQE81L已携带WspR的阳性转化子,如图2所示.

图2 pQE81L-WspR的鉴定Fig.2 The identification of pQE81L-WspR
2.3 蛋白表达结果
通过SDS-PAGE凝胶电泳,可以初步确定蛋白表达图谱上增加了一条40kD左右的条带,为WspR蛋白,如图3所示.
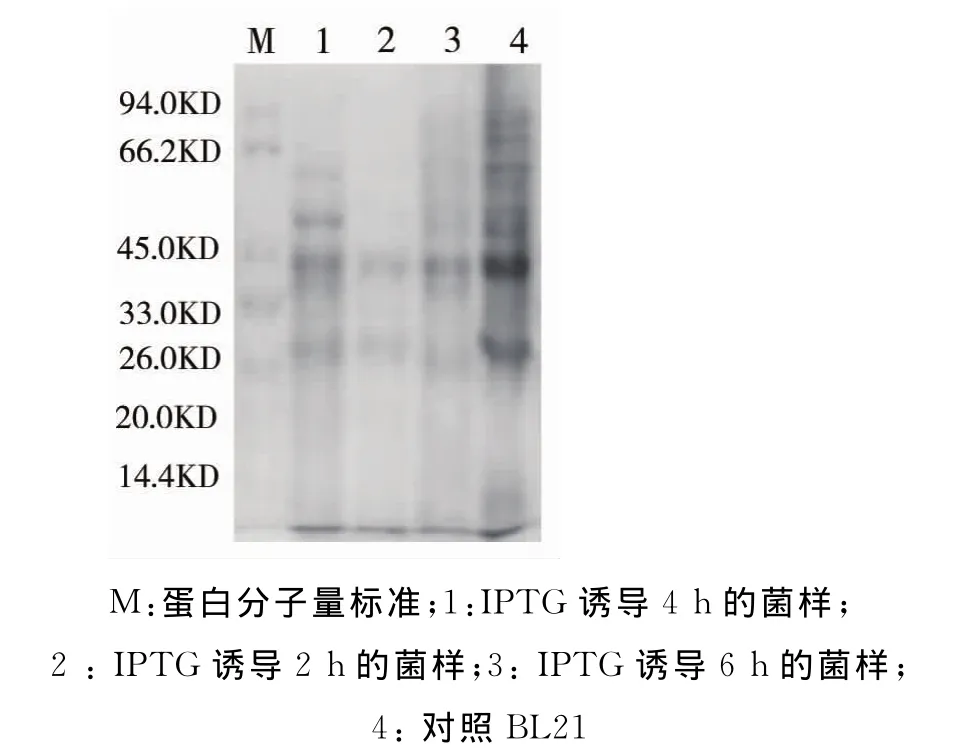
图3 pQE81L-WspR在E.coli BL21菌株中的表达Fig.3 The expression of pQE81L-WspR in E.coli
2.4 c-di-GMP存在性检测
根据 c-di-GMP的检测步骤,当加入血红素时,pQE81L系列为无色,pQE81L-WspR系列为浅浅的红绿色,如图4所示;再加入吖啶黄时,pQE81L系列为浅浅的黄色,pQE81L-WspR系列为深黄色,如图5所示;所有药品加完时pQE81L系列为浅绿色,pQE81L-WspR系列为深绿色,如图6所示.
上述实验经多次反复操作,颜色变化保持一致,表明大肠杆菌BL21pQE81L-WspR参与合成了 c-di-GMP,并且c-di-GMP氧化ABTS 为ABTS+离子,是整个溶液表现出ABTS+离子的颜色,即绿色.而大肠杆菌BL21pQE81L虽然也合成了c-di-GMP,使溶液表现淡淡的浅绿色,但相比WspR基因存在下合成的量却很少.
综上所述,WspR受体蛋白能促进大肠杆菌合成第二信使c-di-GMP,并且大大加速了c-di-GMP的合成量.
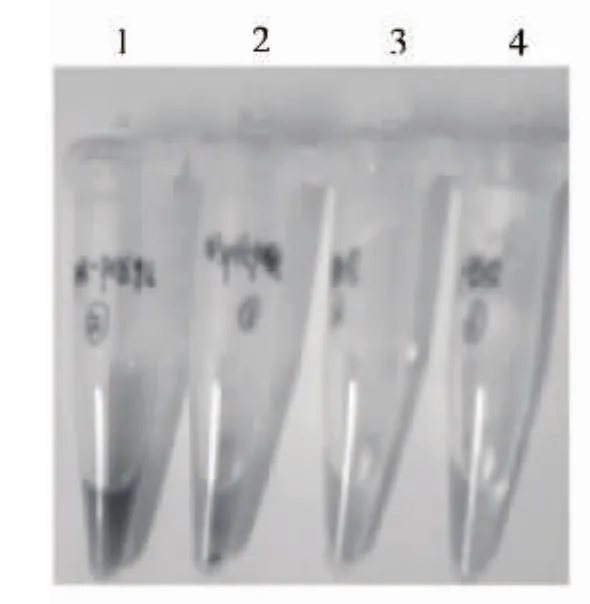
图4 加入血红素后的颜色变化Fig.4 The colour change after adding hemin
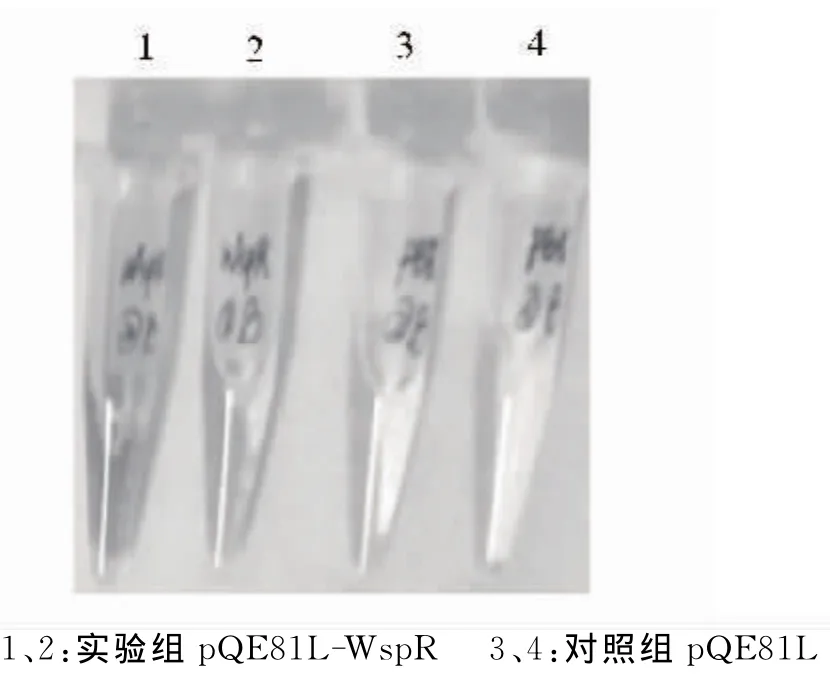
图5 加入吖啶黄后的颜色变化 Fig.5 The colour change after adding acriflavine
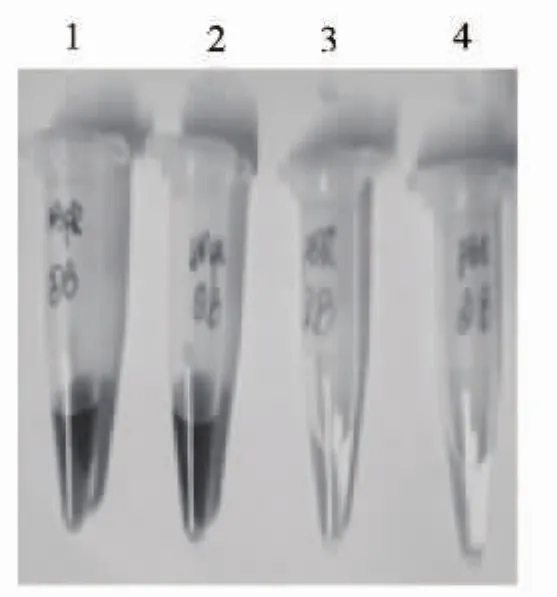
图6 加完ABTS和H2O2之后的颜色变化 Fig.6 The colour change after adding ABTS and H2O2
3 讨 论
作为一个广泛存在的第二信使-环二鸟苷酸(c-di-GMP),国内外在有关代谢调控、细胞功能和信号传导的作用等方面取得了重要的进展[19-23].但是目前对土壤农杆菌 ATCC31749中c-di-GMP的调控机制目前还不清楚,而我们通过研究验证WspR能在大肠杆菌中表达,并促进cdi-GMP大量表达,这为下一步研究 WspR在土壤农杆菌ATCC31749中促进c-di-GMP合成提供基础,进而为可得胶合成提供一定的依据.
虽然我们初步证实了WspR受体蛋白能在大肠杆菌中促进c-di-GMP大量表达,但相关研究还有许多问题尚待解决:①合成c-di-GMP的影响因素、最佳条件、调控机制;②WspR能否在土壤农杆菌ATCC31749中合成c-di-GMP并表达大量的胞外多糖可得胶;③寻找菌体内c-di-GMP作用的靶点,但是还有许多细菌并不含有GEMM RNA,那么这些细菌中c-di-GMP第二信使传导通路是否存在其他调节机制有待于进一步研究.未来的研究中,鉴定新的c-di-GMP调控是我们迫切需要解决的问题.
4 结 论
绿脓杆菌中得到的类趋化系统蛋白 WspR在大肠杆菌BL21中顺利促进合成c-di-GMP,并且合成量能大大增加.而大肠杆菌是大量高效表达纯化蛋白质的模式菌株,这就为后期研究WspR受体蛋白在土壤农杆菌ATCC31749中促进合成c-di-GMP,进而合成胞外多糖可得胶提供了确切可行的依据.
[1]丛峰松,张洪斌,张维杰.可得胶及其在食品和医药领域上的应用[J].食品科学,2004,25(11):432-435.
[2]ZHANG H,NISHINARI K,WILLIAMS M A K,et al.A molecular description of the gelation mechanism of curdlan[J].Mol Microbiol,2002,30(1):7-16.
[3]LAROCHE1C,MICHAUD P.New developments and prospective applications forβ(1,3)glucans[J].Recent Patents on Biotechnology,2007,1(1):59-73.
[4]GOODRIDGE H S,WOLF A J,UNDERHILL D M.β-glucan recognition by the innate immune system[J].Immunol Rev,2009,230(1):38-50.
[5]JENAL U,MALONE J.Mechanisms of cyclic-di-GMP signaling in bacteria[J].Annu Rev Genet,2006,40(2):385-407.
[6]RÖMLING U,AMIKAM D.Cyclic di-GMP as a second messenger[J].Curr Opin Microbiol,2006,9(2):218-228.
[7]RYAN R P,FOUHY Y,LUCEY J F,AND DOW J M.Cyclic di-GMP signaling in bacteria:recent advances and new puzzles[J].Nat Rev Microbiol,2007,188(24):8327-8344.
[8]TAMAYO R,TISCHLER A D,AND CAMILLI A.The EAL domain protein VieA is a cyclic diguanylate phosphodiesterase[J].Nat Rev Microbiol,2005,280(39):33324-33330.
[9]DOW J M,CROSSMAN L,FINDLAY K,et al.Biofilm dispersal in Xanthomonas campestris is controlled by cell-cell signaling and is required for full virulence to plants[J].Proc Natl Acad Sci USA,100(19):10995-11000.
[10]ROSS P,WEINHOUSE H,ALONI Y,et al.Regulation of cellulose synthesis in Acetobacter xyli-num by cyclic diguanylate[J].Nature,1987,325(6101):279-281.
[11]SIMM R,MORR M,KADER A,et al.GGDEF and EAL domains inversely regulate cyclic di-GMP levels and transition from sessility to motility[J].Mol Microbiol,2004,53(4):1123-1134.
[12]Hengge R.Principles of c-di-GMP signalling in bacteria[J].Nat Rev Microbiol,2009,7(4):263-273.
[13]吴林.Shewanella oneidensis鞭毛组装的分子特性及其非运动褶皱表型的形成机理[D].杭州:浙江大学,2011.
[14]JENNIFER R,CONNOR O,NATHAN J K,et al.Surface sensing and lateral subcellular localization of WspA,the receptor in a chemosensory-like system leading to c-di-GMP[J].Mol Microbiol,2012,86(3):720-729.
[15]HICKMAN J W,HARWOOD C.dentification of FleQ from Pseudomonas aeruginosa as a c-di-GMP-responsive transcription factor[J].Mol Microbiol,2008,69(2):376-389.
[16]KARATAN E,WATNICK P.Signals,regulatory networks,and materials that build and break bacterial biofilms[J].Microbio Mol Biol Rev,2009,73(2):310-347.
[17]KRASTEVA P V,FONG J C,SHIKUMA N J,et al.Vibrio cholerae VpsT regulates matrix production and motility by directly sensing cyclic di-GMP[J].Science,2010,327(5967):866-868.
[18]于丽珺.土壤杆菌ATCC31749合成热凝胶的氨调控机理及高产策略研究[D].南京:江南大学,2011.
[19]NAKHAMCHIK A,WILDE C,ROWE-MAGNUS D A.Cyclic-di-GMP regulates extracellular polysaccharide production,biofilm formation,and rugose colony development by Vibrio vulnificus[J].Appl Environ Microbiol,2008,74(13):4199-4209.
[20]NAKAYAMA S,ROELOFS K,LEE V T,et al.A c-di-GMP-proflavine-hemin supramolecular complex has peroxidase activity-implication for a simple colorimetric detection[J].Molecular BioSystems,2012,8(3):726-729.
[21]SUNDRIYAL A,MASSA C,SAMORAY D,et.al.Inherent regulation of EAL domain-catalyzed hydrolysis of second messenger c-di-GMP[J].J Biol.Chem,2014,289(18):6978-6990.
[22]HENGGE R.Novel tricks played by the second messenger c-di-GMP in bacterial biofilm formation[J].EMBO J,2013,32(3):322-323.
[23]LINDENBERG S,KLAUCK G,PESAVENTO C.The EAL domain protein YciR acts as a trigger enzyme in a c-di-GMP signalling cascade in E.coli biofilm control[J].EMBO J,2013,32(14):2001-2014.
