响应面法优化多刺绿绒蒿中总黄酮的提取工艺*
2014-11-23罗云演张秋龙丁晨旭
罗云演, 张秋龙, 丁晨旭
(1.青海民族大学 化学与生命科学学院,青海 西宁810007;2.青海省青藏高原植物资源化学研究重点实验室,青海 西宁810007;3.中国科学院 西北高原生物研究所,青海 西宁810001;4中国科学院 研究生院,北京100049)
多刺绿绒蒿(MeconopsishorridulaHook.f.& Thomson)为一年生罂粟科绿绒蒿属草本植物,高约15~20cm,全株包被黄褐色或淡黄色坚硬而平展的刺,主要分布于中国青海、西藏、云南和甘肃,缅甸、印度东北部、不丹、锡金和尼泊尔也有分布,生长于海拔3 000~5 000米的山坡石缝中.多刺绿绒蒿味苦,有活血化瘀、止痛功效,主要用于治疗头伤、跌打损伤等症[1-3].通过查阅相关文献[5-11],绿绒蒿属植物含有大量的黄酮类化合物,多刺绿绒蒿的化学成分主要为黄酮、生物碱和挥发油,其中以黄酮类化合物居多,而近年来的研究表明,黄酮类化合物具有广泛的生物学活性[12-14].
为了充分开发利用藏药多刺绿绒蒿,本文运用响应面分析法对多刺绿绒蒿总黄酮的提取条件进行优化.
1 材料与方法
1.1 仪器与试剂
T6新世纪紫外-可见分光光度计:北京谱析通用仪器有限责任公司生产;HH-6数显恒温水浴锅:国华电器有限公司;AL204电子天平:梅特勒-托利多仪器(上海)有限公司.
多刺绿绒蒿,采自青海省海北门源地区,由当地藏医鉴定;芦丁对照品:上海顺勃生物工程有限公司(含量大于98%),批号:201203;亚硝酸钠、硝酸铝、氢氧化钠和乙醇均为分析纯.
1.2 标准曲线的制备
1.2.1 芦丁贮备液配制
精密称取芦丁对照品8.75mg,用30%乙醇溶解于25mL容量瓶中,并稀释至刻度,摇匀,得浓度为0.35mg/mL贮备液.
1.2.2 制备标准曲线[4]
分别吸取贮备液0.0mL、0.5mL、1mL、1.5 mL、2mL、2.5mL,置于6个25mL容量瓶中,再分别用30%乙醇约定容至10mL,摇匀,随后加入5%NaNO2溶液1.0mL,摇匀,静置4min,加入 10%Al(NO3)3溶液1.0mL,摇匀,静置10 min,加入1mol/L NaOH 溶液5mL,摇匀,最后30%乙醇定容至刻度,充分混匀,放置15min,得相应浓度的对照品溶液.500nm处测吸光度值,以该系列中1号对照品液(0mg/mL)为参比,芦丁浓度C(mg/mL)为横坐标,相应的吸光度值A为纵坐标,作标准曲线,得标准曲线方程为:y=20.614x+0.000 1,R2=0.999 2.
1.3 多刺绿绒蒿中总黄酮的提取
称取多刺绿绒蒿药材粉末(过40目筛)1g,加入60%乙醇25mL,超声5min,后于70℃热回流70min,提取2次,合并滤液.浓缩滤液,并用30%乙醇10mL溶解,精密量取0.5mL于25mL容量瓶中,按“1.2.2”项下方法操作,测量吸光度.
1.4 多刺绿绒蒿中总黄酮的提取工艺设计
选择乙醇浓度(A)、液料比(B)和提取时间(C)等影响总黄酮提取率较大的因素,并根据影响多刺绿绒蒿中总黄酮提取因素考察试验的结果选择相应的实验水平.采用Design expert.V.8.0.6软件中Box-Behnken中心组合实验设计三因素三水平方案,以多刺绿绒蒿总黄酮提取率为考察指标,通过软件分析得出提取多刺绿绒蒿中总黄酮的最优工艺参数.实验设计见表1.

表1 中心组合设计表Table 1 The central composite design
2 结果与分析
2.1 影响多刺绿绒蒿中总黄酮提取因素考察试验
2.1.1 乙醇浓度考察试验
称取药材粉末1g,按“1.3”项下方法,于70℃,料液比1∶25的条件下,乙醇浓度分别为40%、50%、60%、70% 和 80%,热回流提取70min,考察试验结果如图1所示.
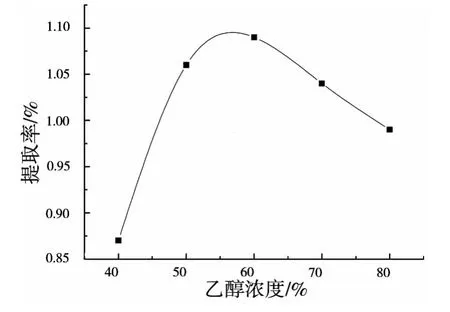
图1 乙醇溶液浓度考察试验结果Fig.1 The test results of ethanol concentration
由图1可知,在乙醇浓度小于60%时,提取率随着乙醇浓度的增大而增大,当乙醇浓度大于60%时,提取率反而随之下降,且叶绿素等物质的溶出增加,不利于测定,故选择乙醇浓度为60%左右.
2.1.2 液料比考察试验
称取药材粉末1g,按“1.3”项下方法,于70℃,乙醇浓度60%条件下,液料比分别为10∶1、15∶1、20∶1、25∶1和30∶1,热回流提取70 min,考察试验结果如图2所示.

图2 液料比考察试验结果Fig.2 The test results of ratio of liquid to solid
由图2可以看出,当液料比达到20∶1左右时,随着提取剂用量增加,提取率变化不大,而25∶1之后,可能是杂质的溶出增加,影响了总黄酮的溶出,提取率故略有所下降,所以选择液料比为25∶1左右.
2.1.3 提取时间考察试验
称取药材粉末1g,按“1.3”项下方法,于70℃,乙醇浓度60%,液料比25∶1条件下,分别热回流提取50min、60min、70min、80min和90min,考察试验结果如图3所示.
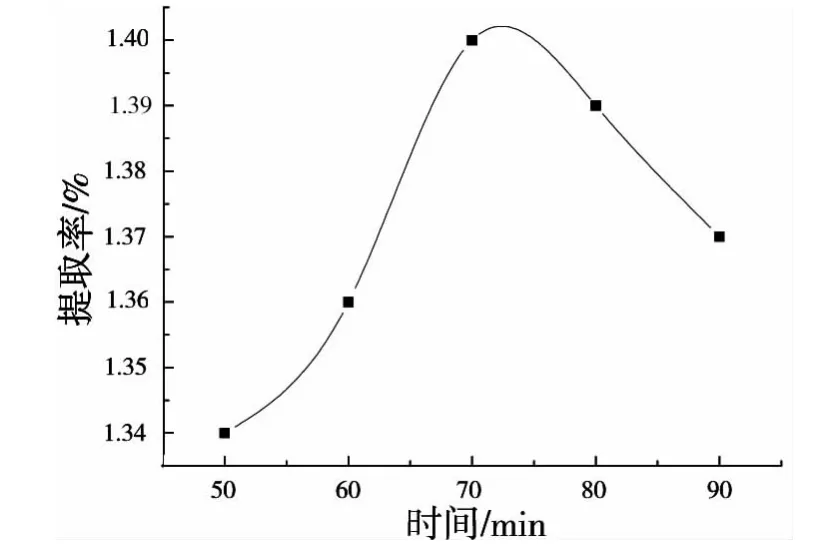
图3 提取时间考察试验结果Fig.3 The test results of extracting time
由图3可知,提取时间在由50min逐渐上升至70min时,总黄酮提取率显著增加,而70min后,随着提取时间的延长提取率有所下降,可能是多刺绿绒蒿中黄酮类物质结构对热具有一定的不稳定性,故选择提取时间为70min左右.
2.1.4 提取温度考察试验

图4 提取温度考察试验结果Fig.4 The test results of temperature
称取药材粉末1g,按“1.3”项下方法,于乙醇浓度60%,液料比25∶1条件下,分别于40℃、50℃、60℃、70℃和80℃水浴中浸提70min,考察试验结果如图4所示.
由图4可见,70℃以后,随着提取温度的升高,提取率有所下降,可能是多刺绿绒蒿中黄酮类物质结构遭到破坏所致,另一方面杂质的溶出量增加,影响测定,所以选择提取温度为70℃左右.
2.2 响应面实验方案与相关数据分析结果
本文采用 DesignExpert.V.8.0.6软件,对表2中响应面实验数据进行分析,得出回归方程方差分析表及相应的响应曲面图.
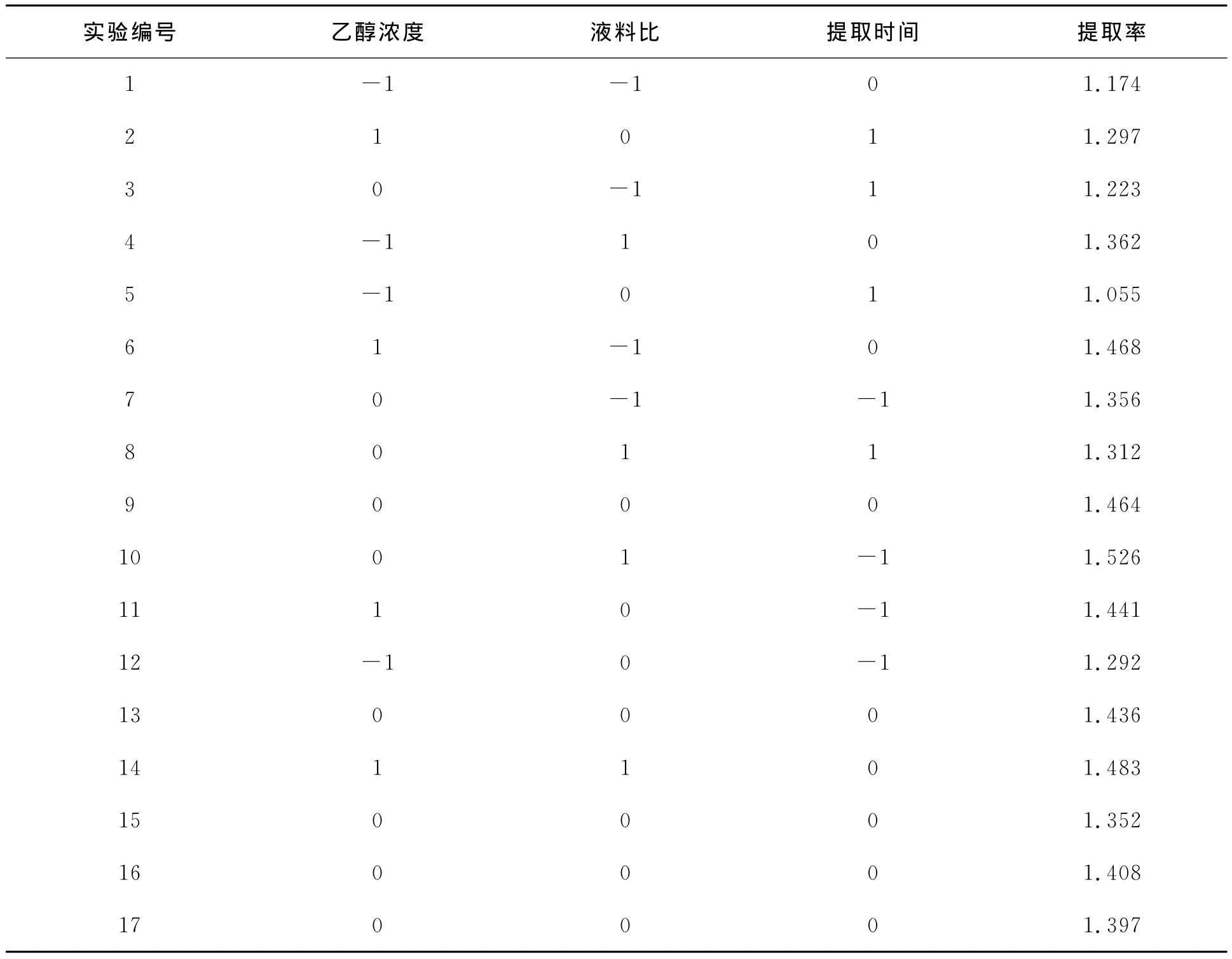
表2 响应面实验方案及实验结果Table 2 The experiment designs and results of RSM
响应面软件程序对表2中实验结果进行二次回归响应面分析,得到的回归方程:多刺绿绒蒿总黄酮的提取率=1.41+0.10*A+0.058*B-0.091*C-0.043*A*B+0.023*A*C-0.020*B*C-0.061*A2+0.022*B2-0.079*C2

表3 回归方程方差分析表Table 3 ANOVA for quadratic polynomial model
由表3可知,三个因素对提取率影响优先顺序为:乙醇浓度>液料比>提取时间,回归模型P值小于0.000 1达到极显著水平,方程相关系数R2=0.925 9,说明该模型拟合度较好,失拟项P=0.947 4(P>0.1)不显著,表明本实验所得二次回归方程高度显著,实验设计可靠.两因素交互作用对总黄酮提取率影响的响应面图如图5-7.

图5 乙醇浓度与液料比交互作用对总黄酮提取率影响的响应面图Fig.5 Response surface curve for extraction yield of total flavonoids showing interaction between concentration of ethanol and ratio of liquid to solid

图6 乙醇浓度与提取时间交互作用对总黄酮提取率影响的响应面图Fig.6 Response surface curve for extraction yield of total flavonoids showing interaction between concentration of ethanol and extracting time
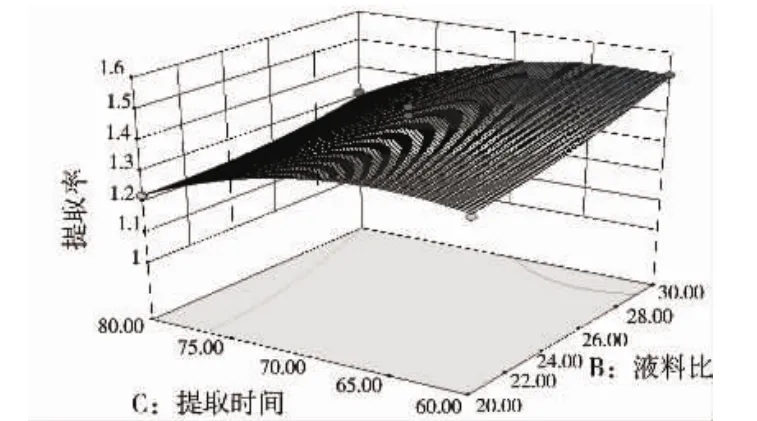
图7 液料比与提取时间交互作用对总黄酮提取率影响的响应面图Fig.7 Response surface curve for extraction yield of total flavonoids showing interaction between ratio of liquid to solid and extracting time
3 验证实验
为了验证根据模型优化条件得到的最佳理论工艺条件(乙醇浓度64.36%、液料比29.88∶1,提取时间66.01min时,总黄酮提取率理论值为1.530%)的可靠性,实际操作中将工艺修正为乙醇浓度64%、液料比30∶1和提取时间66min进行实验,总黄酮得率为1.521%(n=3,RSD=0.399%)与预测值相差不大.
4 结 论
采用响应面法优化乙醇热回流提取多刺绿绒蒿中总黄酮,得出最优工艺条件为乙醇浓度64%,液料比30∶1,提取时间66min,经检验,在此工艺条件下,总黄酮提取率为1.521%(n=3),与预测值相差不大,表明该模型是合理可靠的,具有一定的应用价值.
[1]孙红祥,奚镜清.多刺绿绒蒿的考释[J].中国中药杂志,1993,18(8):454.
[2]刘松渝.绿绒篙属植物的生物碱[J].华西药学杂志,1987(3):173-175.
[3]王彬,宋学华,蹼社班.藏药“欧贝”和“刺儿恩”的性状鉴定研究[J].江苏药学与临床研究,2003,11(3):23-25.
[4]张秋龙,梁永欣,李文聪,等.响应面法优化细果角茴香中总黄酮的超声提取条件[J].天然产物研究与开发,2013,25:841-845.
[5]马明芳,丁克毅,丁立生,等.多刺绿绒蒿的化学成分研究[J].华西药学杂志,2009,24(3):227-229.
[6]吴海妹,袁瑞瑛,小尼玛顿珠,等.多刺绿绒蒿的化学成分[J].药学与临床研究,2012,20(4):314-316.
[7]袁瑞瑛,旦欧,次登,等.藏药多刺绿绒蒿化学成分研究现状[J].西藏科技,2012,230(5):64-66.
[8]李启发.通关藤和多刺绿绒蒿的化学成分研究.西南民族大学硕士学位论文[D].成都:西南民族大学,2007.
[9]吴海峰,潘莉,邹多生,等.3种绿绒蒿挥发油化学成分的GC-MS分析[J].中国药学杂志,2006,41(17):1298-1300.
[10]吴海峰.五种绿绒蒿藏药材化学成分研究[D].西宁:中国科学院西北高原生物研究所,2009.
[11]马应龙.多刺绿绒蒿化学成分的研究[D].西宁:青海师范大学,2008.
[12]云南蜂胶和山东蜂胶醇提物对小鼠学习记忆的影响[J].云南师范大学学报:自然科学版,2013,33(2):70-73.
[13]吕海英,林雨,潘云,等.黑果枸杞叶总黄酮抗氧化和降血脂成分测定[J].新疆师范大学学报:自然科学版,2012,31(2):43-48.
[14]孟庆华,于晓霞,张海凤,等.天然黄酮类化合物清除自由基机理及其应用进展[J].云南民族大学学报:自然科学版,2012,21(2):79-83.
