布鲁氏菌病补体结合酶联免疫吸附试验抗体检测试剂盒敏感性和特异性评价
2014-11-23姚学军马立峰王秀丽程君生蒋玉文赵心力毛开荣
王 楠,姚学军,马立峰,王秀丽,程君生,蒋玉文,赵心力,毛开荣*
(1.中国兽医药品监察所,北京100081;2.北京市昌平区动物疫病预防控制中心,北京102200;3.内蒙古动物疫病预防控制中心,呼和浩特010010)
布鲁氏菌(Brucella)是一种严重威胁人类健康的重要人畜共患病原菌,可感染人、多种家畜和野生动物,引起发热、流产与不育、慢性关节炎及神经损伤等病症[1]。布鲁氏菌病(布病)不但对动物的繁殖和生产性能构成严重危害,更重要的是,人感染布鲁氏菌后,往往难以治愈,造成严重的公共卫生问题。近十年来,布病在我国死灰复燃,畜群和人间布病感染率逐年上升[2-5],再次严重地威胁着我国公共卫生事业和畜牧业发展。本实验室建立的补体结合酶联免疫吸附试验方法是一种既保持了补体结合试验高特异性,又兼具ELISA高敏感性的布鲁氏菌病免疫学检测技术[6],本实验室在该方法的基础上研制了商品化的试剂盒。为了评价布病CF-ELISA试剂盒的敏感性、特异性及其与其他商品化抗体检测产品的符合率,本试验对经流行病学调查证实的感染地区牛、羊群血清,净化地区牛、羊血清进行抗体检测,同时与虎红平板凝集试验(RBT)、间接ELISA(iELISA)抗体检测试剂盒和胶体金检测试纸条(CGS)进行了敏感性、特异性和产品间的比较分析。
1 材料与方法
1.1 实验材料 血清样品为从内蒙古自治区经流行病学调查证实的感染地区采集的牛、羊血清各200份,净化地区采集牛、羊血清各100份,4℃保存备用。
CF-ELISA试剂盒由本实验室制备(批号:201301)。虎红平板凝集试验抗原(批号:201301)、布病阳性血清(批号:201301)和阴性血清(批号:201202)均由中国兽医药品监察所生产制备、鉴定和保存;iELISA试剂盒购自IDEXX公司(批号:p06906);CGS购自韩国 BIONOTE公司(批号:2303038)。
1.2 实验方法 本实验为了评价CF-ELISA试剂盒的敏感性,检测了感染地区采集的各200份牛、羊血清样品的布病抗体;为了评价CF-ELISA试剂盒的特异性,检测了净化地区采集的各100份牛、羊血清样品的布病抗体;同时用其他三种产品对上述血清样品进行了布病抗体的检测,将CFELISA试剂盒的检测结果与其他三种产品进行了比较,上述四种产品的实验方法如下:
1.2.1 CF-ELISA试剂盒 待检血清作1∶10稀释加入到包被好的检测板中,100 μL/孔,同时设立阳性、阴性和空白对照,室温孵育30 min。洗涤液250 μL/孔,洗涤4次;加入1∶40稀释的豚鼠补体,100 μL/孔,室温孵育30 min。洗涤4次后加入1∶1600稀释后HRP标记抗豚鼠补体C3抗体,100 μL/孔。室温孵育30 min。继续洗涤4次后,加入底物显色液,室温避光显色10 min;每孔加入终止液50 μL,酶标仪测定450 nm处光吸收值(OD值)。结果判定:试验成立条件为阳性对照血清OD450nm的平均值应 >0.60,阴性对照血清的OD450nm的平均值应<0.30。样品的S/P(%)值=100×(待检样品OD450nm值-空白对照OD450nm的平均值)/(阳性对照血清OD450nm的平均值-空白对照OD450nm的平均值)≥0.25,即为阳性。
1.2.2 虎红平板凝集试验抗原 按照说明书进行:备一块洁净玻璃板,画成若干个约4 cm2的小格。在方格中滴加被检血清和布鲁氏菌病虎红平板凝集试验抗原各一滴(约0.03 mL),等量混合均匀,在4 min内读取结果,同时做布病阳性血清和布病阴性血清对照。每份被检血清在规定时间内出现肉眼可见凝集反应者判为阳性(+),不出现凝集反应者为阴性(-)。
1.2.3 iELISA试剂盒 按照说明书进行:待检牛、羊血清作1∶10倍稀释加入到包被好的检测板中,200 μL/孔,同时设立阳性和阴性对照,室温孵育1 h,洗涤液300 μL/孔,洗涤 3 次;加入 1∶200倍稀释的酶标抗体,100 μL/孔,室温孵育30 min,洗涤液300 μL/孔,洗涤3次;加入底物显色液,室温避光显色20 min;每孔加入终止液50 μL,酶标仪测定450 nm处光吸收值(OD值)。结果判定,阳性对照血清OD450nm的平均值应≥0.35,且阳性对照孔OD450nm的平均值/阴性对照孔OD450nm的平均值应≥3.0时,测定结果有效。样品的S/P(%)值=100×(样品OD450nm值-空白对照OD450nm的平均值)/(阳性对照OD450nm的平均值-空白对照OD450nm的平均值)≥120%,即为阳性,否则110% <S/P(%)<120%,为可疑或S/P(%)≤110%为阴性。
1.2.4 胶体金吸附试纸条 按照说明书进行:取1滴血清样品加入检测孔中,加入3~4滴样品稀释液,10 min后肉眼观察结果。结果判定,C线处出现红线时试验成立,T线处出现红线时即为阳性,否则为阴性。
1.3 统计方法 采用x2检验(McNemar法)统计分析敏感性差异是否显著。采用Kappa一致性检验方法,按照 Landis和 Koch[7]等建立的划分标准判定一致性。
2 结果
2.1 CF-ELISA试剂盒对感染地区牛血清样品抗体检测结果及与其他产品的敏感性和符合率比较
对200份经流行病学调查证实的感染地区牛血清样品,CF-ELISA试剂盒RBT、iELISA试剂盒和CGS检测结果的比对分析可以得出:CF-ELISA试剂盒相对于RBT、iELISA试剂盒和CGS的敏感性分别为51%、86%和81%。CF-ELISA试剂盒与RBT、iELISA试剂盒和CGS的符合率分别为80%、95%和93%(表1)。
Kappa一致性检验分析表明,CF-ELISA试剂盒和iELISA试剂盒检测结果κ值>0.81,具有极高度的一致性,CF-ELISA试剂盒和CGS检测结果κ值>0.61,具有高度的一致性。各产品间检测结果的Mc-Nemar检验表明,CF-ELISA试剂盒与iELISA试剂盒和CGS的敏感性差异均不显著(P>0.05)。

表1 CF-ELISA试剂盒对感染地区牛血清样品抗体检测结果及与其他产品的敏感性和符合率比较

表2 CF-ELISA试剂盒与其他产品比较敏感性和符合率的统计结果
2.2 CF-ELISA试剂盒对净化地区牛血清样品的检测结果及与其他产品的特异性和符合率比较对100份经流行病学调查证实的净化地区牛血清样品,CF-ELISA试剂盒与RBT、iELISA试剂盒和CGS检测结果的比对分析可以得出,CF-ELISA试剂盒相对于RBT、iELISA试剂盒和CGS的特异性均为100%。CF-ELISA试剂盒与RBT、iELISA试剂盒和CGS的符合率均为100%(表3)。
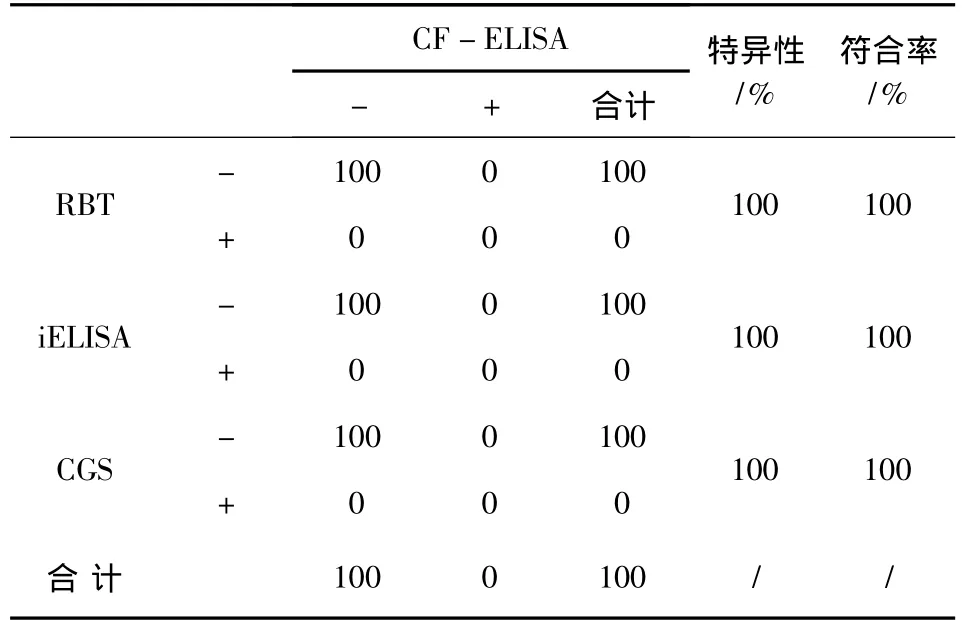
表3 CF-ELISA试剂盒对净化地区牛血清样品的检测结果及与其他产品的特异性和符合率比较
2.3 CF-ELISA试剂盒对感染地区羊血清样品的检测结果及与其他产品的敏感性和符合率比较对200份经流行病学调查证实的感染地区羊血清样品,CF-ELISA试剂盒与RBT、iELISA试剂盒和CGS检测结果的比对分析可以得出,CF-ELISA试剂盒相对于RBT、iELISA试剂盒和CGS的敏感性分别为44%、70%和57%。CF-ELISA试剂盒与RBT、iELISA试剂盒和CGS的符合率分别为80%、89%和85%(表4)。
Kappa一致性检验分析表明,CF-ELISA试剂盒和iELISA试剂盒检测结果κ值>0.6(表5),具有高度的一致性。各方法间的McNemar检验结果表明,CF-ELISA试剂盒与RBT、iELISA试剂盒、CGS的敏感性和符合率差异均不显著(P>0.05)。
2.4 CF-ELISA试剂盒对净化地区羊血清样品的检测结果及与其他产品的特异性和符合率比较对100份经流行病学调查证实的净化地区羊血清样品,CF-ELISA试剂盒与RBT、iELISA试剂盒和CGS检测结果的比对分析可以得出,CF-ELISA试剂盒相对于RBT、iELISA试剂盒和胶体金试纸条的特异性均为100%。CF-ELISA试剂盒与 RBT、iELISA试剂盒和CGS的符合率均为100%(表6)。
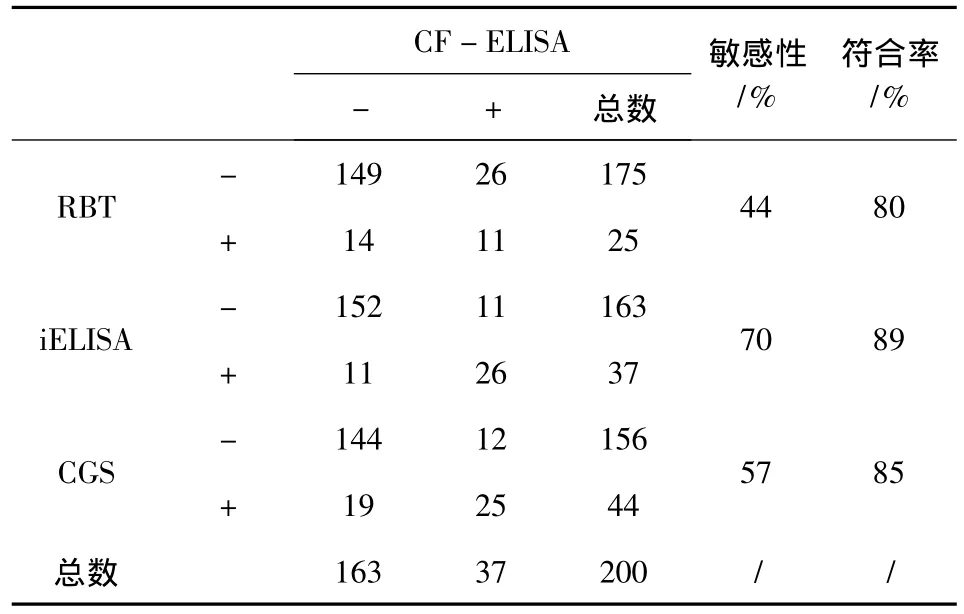
表4 CF-ELISA试剂盒对感染地区羊血清样品的检测结果及与其他产品的敏感性和符合率比较

表5 CF-ELISA试剂盒与其他产品比较敏感性和符合率的统计结果
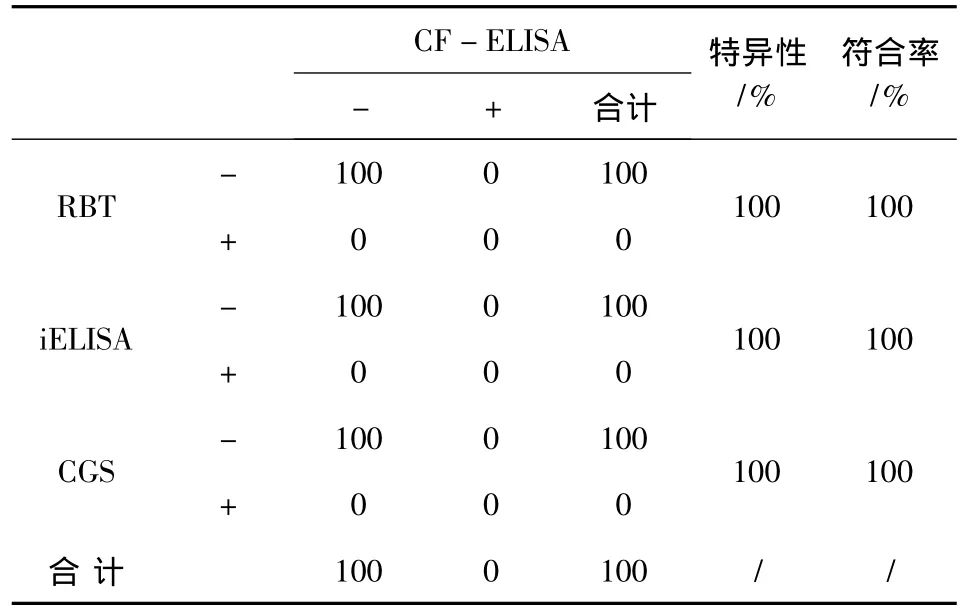
表6 CF-ELISA试剂盒对净化地区羊血清样品的检测结果及与其他产品的特异性和符合率比较
3 讨论
3.1 目前我国的布病防治工作,按照畜间布病发生和流行程度,将全国分为布病重度流行区、轻度流行区和净化区,对不同流行区分别采取不同措施管理,并实施分类指导。本实验通过对感染地区和净化地区分别进行敏感性和特异性的比较分析得出,在感染地区CF-ELISA试剂盒与iELISA试剂盒和CGS敏感性无显著差异,在净化区CF-ELISA试剂盒与RBT、iELISA试剂盒和CGS特异性也无显著差异。而且,CF-ELISA方法与作为OIE推荐的国际贸易的iELISA方法之间具有高度的一致性。上述结果表明,CF-ELISA试剂盒是一种可以筛选感染地区阳性动物,同时也可以监测净化地区是否有布病感染的快速、高通量血清学检测方法。
3.2 由于标记抗体的种属特异性制约了iELISA试剂盒、cELISA试剂盒和CGS等产品只能检测特定动物的血清,本实验中采用的商品化试剂盒和试纸条在检测牛和羊血清时分别使用的是检测相应血清的两种试剂盒。CF-ELISA方法特点在于补体参与了抗原抗体反应,针对补体制备的标记抗体无种属特异性,所以CF-ELISA试剂盒可以同时检测牛血清和羊血清,而且两种血清的检测结果显示,CF-ELISA试剂盒分别和两种iELISA试剂盒检测结果都具有高度的一致性。理论上推测,CFELISA试剂盒同样可以应用于猪血清、狗血清和其他野生动物的布病抗体检测,这些有待于进一步的研究证实。
3.3 检验医学研究工作中,用于评估两种检测方法检测结果是否一致的统计方法很多,例如:x2检验、t检验和贝叶斯评估法等,事实上这些统计方法都存在局限性和不足,在某些情况下甚至应用不同的统计方法对同一资料进行分析可能得出完全相反的结论。本研究采用x2检验中配对计数资料的McNemar检验法分析两种方法之间检测结果的差异显著性;采用Kappa一致性检验分析两种方法之间的一致性,而且根据参考判断指标能对一致性分析“量”值化[7,9],同时应用这两种统计学方法可以更科学地评价本研究中的产品。当然,实验中检测血清的样本数量对统计学结果有影响,为了进一步评价CF-ELISA试剂盒的敏感性和特异性,合理扩大检测样本的数量将是下一步的研究重点。
[1]Mehmet Doganay,Bilgehan Aygen.Human brucellosis:an overview[J].Int J Infect Dis,2003,(7):173-182.
[2]崔步云.中国布鲁氏菌病疫情监测与控制[J].疾病监测,2007,22(10):649-651.
[3]尚德秋.布鲁氏菌病再度肆虐及其原因[J].中国地方病防治杂志,2001,16(1):29-34.
[4]Mohamed N Seleem,Stephen M Boyle,Nammalwar Sriranganathan.Brucellosis:A re-emerging zoonosis[J].Veterinary Microbiology,2010,140:392-398.
[5]齐景文.2002-2008年沈阳市畜间布鲁氏菌病监测分析[J].中国动物检疫,2010,27(2):53-54.
[6]毛开荣,王 楠,李文平,等.补体结合酶联免疫吸附试验方法的建立[J].中国兽药杂志,2011,45(11):4-8.
[7]Landis J R,Koch G G.The measurement of observer agreement for Gategorical data[J].Biometrics,1977,33:159-174.
[8]吴泰相,刘关键,王家良.医学检验方法学研究的设计和文献评价原则[J].中华检验医学杂志,2000,6:58-60.
[9]夏邦世,吴金华.Kappa一致性检验在检验医学研究中的应用[J].中华检验医学杂志,2006,29(1):83-84.
