青年甲状腺功能亢进症合并脑梗死、脑萎缩1例及文献复习
2014-11-21王科文张亚萍赵明利
王科文,张亚萍,张 洋,赵明利
(中国人民解放军第三医院内分泌科,宝鸡 721004)
甲状腺功能亢进症(简称甲亢)是指甲状腺合成与分泌过量甲状腺激素而引起的神经、循环、消化等系统兴奋性增高和代谢亢进为主要表现的一组疾病的总称。临床上以高代谢症候群、甲状腺肿大、突眼症、神经及心血管系统功能紊乱为主要特征,而引起脑梗死、脑萎缩特别是青年脑梗死、脑萎缩者较为罕见。青年缺血性脑梗死大多指40岁以下脑卒中患者,而短暂性脑缺血发作(TIA)约占中青年脑血管病病例的1/3,其发展成脑梗死的几率较小,故在卒中人群中所占比例不高,但近年来发病率呈增高趋势,青年(15-45岁)缺血性脑卒中发病率约为(2-10)/10万人口,40岁以下脑卒中发病占全部脑卒中的10%-20%[1]。了解和掌握其致病病因和相关危险因素对指导治疗和预防具有重要意义。我们现报道1例青年甲亢合并脑梗死、脑萎缩的病例资料,结合学习国内外相关文献,以进一步了解和熟悉它的临床特点和发病机制。
1 病例资料
患者,男性,24岁,主因“乏力、消瘦4年,间断性左侧肢体抽搐4 d”入院。患者4年前活动时突然出现双下肢无力症状,发作时不能站立,休息后可缓解。同年参军后在部队训练时多次出现四肢无力症状,口服氯化钾溶液后症状逐渐好转,后在长春市人民医院检查发现甲状腺功能高于正常,诊断为“甲状腺功能亢进症”,给予口服“他巴唑片”抑制甲状腺素合成及分泌治疗,但患者依从性差,间断口服药物治疗,未定期复诊。近4年来出现消瘦、心慌、手抖症状。20d前因“他巴唑”供应中断,自行停药治疗,4 d前出现发作性左侧肢体抽搐、蜷缩不适,无大小便失禁、意识不清,每次持续约5 min后自行缓解。患者既往身体一般,无烟酒嗜好。入院查体:T 36.6 ℃,P 112 次/min,R 19 次/min,BP 140/80 mmHg,双侧甲状腺Ⅱ度肿大,可闻及血管杂音,心肺腹查体未见明显异常。神经科查体:意识清醒,言语清楚、理解力、记忆力、定向力、计算力、判断力及逻辑思维力基本正常,四肢肌力肌张力基本正常,感觉功能正常,生理反射对称存在,左下肢Babinski征及其他病理反射(+),右下肢病理反射及脑膜刺激(-)。Glassgow意识评分14分。入科后再次出现左侧肢体抽搐症状,伴舌根发硬,不能言语,头颅CT示:①右侧额叶深部及半卵圆区多发性腔隙性脑梗死;②脑白质脱髓鞘改变;③脑萎缩。辅助血常规:中性粒细胞比率38.3%(参考值54%-62%);碱性磷酸酶221.00 U/L(参考值42-128 U/L);肾功测定:肌酐29.00 μmol/L(参考值44-133 μmol/L)、葡萄糖6.8 mmol/L(参考值3.9-6.1 mmol/L);同型半胱氨酸28.00μmol/L(参考值0-15 vmol/L);甘油三酯0.50 mmol/L(参考值0-1.71 mmol/L),总胆固醇2.46 mmol/L(0-5.17 mmol/L),高密度脂蛋白胆固醇0.91 mmol/L(参考值 0.83-2.80 mmol/L),低密度脂蛋白胆固醇 1.45 mmol/L(参考值 2.07-3.1 mmol/L)。甲状腺功能测定:T33.433 ng/ml(0.72-1.9 ng/ml),T4212.378 ng/ml(41.0-120.2 ng/ml),FT311.833 pmol/L(3.3-8.5 pmol/L),FT4>200.000 pmol/L(10-24 pmol/L),hTSH 0.083 μU/L(0.4-4.0 μU/L),促甲状腺受体抗体 TRAb 26.90 U/L(<5 U/L),抗甲状腺微粒体抗体 TM-Ab 29.%(<15%),甲状腺球蛋白抗体TG-Ab 54.00%(<30%),甲状腺过氧化物酶抗体85.0%(<20%)。尿常规、粪常规、电解质、血凝四项、D-二聚体等均未见明显异常。心电图示:窦性心动过速。甲状腺彩超检查示:甲状腺声像图改变符合甲状腺功能亢进改变。颈部血管彩超:双侧颈动脉及椎动脉血流通畅。经颅多普勒超声(TCD)检查发现脑血管轻度狭窄。头颅MRI(增强)示:①右侧额叶异常强化影,考虑缺血性改变;②双侧侧脑室后角周围及左侧半卵圆中心脑白质点状脱髓鞘;③脑萎缩(见图1)。脑电图检查示:正常。
2 结果
2.1 疗效
入院后给予抗甲状腺药物抑制甲状腺素合成与分泌、改善循环、营养神经、抗血小板聚集等对症支持治疗,半月后病情好转出院,出院时Glassgow意识评分:15分。出院后继续给予口服抗甲状腺药物等对症支持治疗,定期门诊复查甲状腺功能、血常规、头颅CT等相关实验室检查,病人最终痊愈。
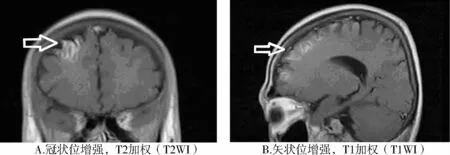
图1 患者入院时行头颅MRI(增强)示:脑梗死、脑萎缩
2.2 不良反应
患者在院外治疗期间曾发生一过性白细胞计数减少,给予口服升白细胞药物治疗后白细胞计数恢复正常,之后复查血常规均在正常范围,未发现其他明显不良反应。
3 讨论
甲状腺是人体最大的内分泌腺,其分泌的甲状腺激素在促进人体正常生长发育、物质能量代谢及维持神经系统的兴奋性等方面发挥着极其重要的作用,其功能异常可导致多系统多器官受损。早在1988年Petersen等报道甲亢与卒中发病可能相关[2],此后亦有研究表明甲亢可能增加老年人心源性卒中的风险[3]。但由于其发病机制的复杂性,甲亢与脑梗死之间的关系长期未能明确。青年甲亢合并脑梗死最早由Kushima等[4]于1991年报道,近年来随着国内外对甲亢特别是青年甲亢合并脑梗死关注度的提高以及相关研究报道的增多,对甲亢与脑梗死二者之间关系的认识不断提高,新的研究成果亦不断涌现。近年研究发现甲亢患者患脑血管病的风险增高,2010年Sheu等[5]前瞻性调查研究大样本的甲亢和不伴甲亢而因其他疾病为主诉就诊的青年患者时发现5年内甲亢组脑梗死的发病风险是非甲亢组的1.44倍,由此可以看出甲亢明显增加青年脑梗死的风险。2011年Brandt等报道甲亢同时还会增加脑卒中的死亡率[6]。尽管目前广大学者对甲亢合并脑梗死有了初步的了解和掌握,但由于其发病机制长期以来未完全明确,故仍需进一步探讨研究。
3.1 发病机制
甲亢合并缺血性脑梗死、脑萎缩的发病机制极为复杂,可能有以下几个主要方面的原因。
3.1.1 自身免疫因素 甲亢是一种自身免疫性疾病,而近年来研究发现脑血管病也存在免疫功能异常改变,因此推测免疫介导是甲亢合并脑梗死发病的一个重要因素。免疫紊乱导致的动脉炎症可能是甲亢患者颅内血管狭窄或呈烟雾样改变的关键因素,而由免疫紊乱所产生的自身抗体可导致血小板活化聚集,激活某些淋巴因子以及免疫调节蛋白、细胞间黏附分子等,最新研究认为这些免疫因子与心脑血管病血栓形成有关,与Hwang等[7]研究报道甲亢患者有形成上矢状窦血栓的潜在发病趋势结果基本一致。在既往的机制研究中,Tendler等[8]研究认为甲亢合并脑血管狭窄或闭塞的患者,血管调节异常和细胞的增殖与甲状腺激素的免疫刺激有关,而这种免疫刺激主要通过T细胞实现,同时这种免疫机制也可以用来解释脑梗死患者常合并其他免疫疾病(如抗磷脂综合征、系统性红斑狼疮等)的原因。Shi等[9]研究发现甲状腺自身抗体与年轻中风患者颅内动脉狭窄之间存在一定的联系,潜在免疫发病机制有助于了解颅内动脉狭窄形成的免疫机制。本文患者也存在明显的免疫紊乱证据,其甲状腺自身抗体明显高于正常水平。以上这些都表明自身免疫因素可能在甲亢合并缺血性脑梗死、脑萎缩的发病中起着重要作用。
3.1.2 交感神经兴奋性增加 颈交感神经兴奋性增加导致颅内动脉痉挛,同时也是脑血管病的致病因素之一。甲亢患者过高的甲状腺激素水平可能增强了颅内血管对交感神经的反应,促进了颅内血管的病理改变。甲状腺素分泌增加导致交感神经兴奋性增高,血中儿茶酚胺转变为去甲肾上腺素增加,致使小动脉痉挛,血黏度增高。血黏度增高且小动脉痉挛易引起血管内膜损伤,黏附血小板随之聚集,形成栓塞,引起脑血管病的发生。Czarkowski等[10]研究发现甲状腺激素加速了甲亢患者的血管硬化,导致血管的韧性降低。动脉痉挛和血管硬化均为脑血管病的重要致病因素,可导致患者颅内血管的多发狭窄或闭塞,最终导致多发脑梗死。本例患者发生了右侧额叶深部及半卵圆区多发性腔隙性脑梗死、脑萎缩,可能因甲状腺素长期过高导致颈交感神经兴奋性增加,从而促进了脑血管病的发生、发展,最终导致了脑梗死、脑萎缩的发生。
3.1.3 动脉粥样硬化因素 既往研究结果表明,甲亢时因甲状腺激素分泌过多导致交感神经兴奋性增高,在加速糖吸收的同时增加糖原分解和糖异生作用,导致患者血糖增高或糖耐量异常,甚至发生糖尿病。糖耐量异常是脑梗死的重要危险因素之一,高血糖可进一步加重梗死后脑损害。同时甲亢患者过高的甲状腺激素水平可能促使患者形成高同型半胱氨酸血症。而糖耐量异常、高同型半胱氨酸血症促使动脉粥样硬化的形成和发展,所以临床上对那些糖耐量异常或伴高同型半胱氨酸血症等代谢异常的动脉粥样硬化患者,尤其是青年患者,应特别注意其血液中游离甲状腺素水平。本例患者辅助检查结果提示高同型半胱氨酸血症和空腹血糖高于正常,空腹血糖受损,提示发生脑动脉粥样硬化风险较大。Ran等[11]在研究未经治疗的甲亢患者颈动脉僵硬度时发现,在去除年龄、血脂水平等因素影响后,所有导致动脉僵硬的参数与血浆甲状腺激素水平呈正相关,支持甲亢对动脉粥样硬化有促进作用。脑萎缩指因各种原因导致脑组织本身发生器质性病变而产生萎缩的一类神经精神性疾病,由遗传、脑外伤、中毒后遗症、脑梗死、脑炎脑膜炎、脑缺血、缺氧、脑血管畸形、脑部肿瘤、脑中风、癫痫长期发作、烟酒过度、营养不良、甲状腺功能病变、脑动脉硬化、煤气中毒、酒精中毒等多种病因引起,导致脑实质破坏和神经细胞的萎缩、变形、消失,其中最主要的致病因素是脑血管长期慢性缺血而造成的,CT及MRI(核磁共振)等影像学检查可发现。本例患者甲亢病情长期未控制,我们根据其病史特点,初步考虑为甲亢未控制,长期慢性脑供血不足所致脑梗死、脑萎缩。
3.1.4 心源性因素 甲亢时甲状腺素分泌增加,增加心脏正性变时变性改变,除引起心肌收缩力加强、兴奋性增高、耗氧量增加外,还可导致心脏瓣膜和心肌受累,引起心肌肥大,心脏负荷过重,心功能减退,瓣膜病变,可造成心律失常和附壁栓子形成或脱落而发生脑栓塞。
3.1.5 甲状腺素增高因素 既往许多学者研究发现甲状腺素增高会加重脑损伤,Rastogi等[12]研究发现诱导处于甲亢状态的大鼠发生短暂性脑缺血发作,再灌注3 d后处死,甲亢组大鼠神经功能缺损增加,病死率明显高于非甲亢组,梗死面积的增加与甲状腺素增高的剂量有关,这些研究支持甲状腺素增高是独立的危险因素。可能因过高的甲状腺素明显增加基础代谢率,使包括大脑、心脏、肝脏等在内的多器官处于高代谢、高消耗状态,脑部能量代谢和氧消耗明显增加,特别是血管狭窄的患者脑血管本身灌注储备能力已有所下降,进一步加重脑损伤。
3.1.6 血管狭窄因素 血管狭窄是疾病发生的另一重要因素,但目前病因尚不清楚,Wakamoto等[13]报道了1例甲亢伴发脑出血的病例,血管造影发现颈内动脉末端血管狭窄,给予相应治疗1年后复查血管造影显示血管狭窄恢复,推测血管狭窄是由血管痉挛引起的。此外研究发现血液中超量的甲状腺素可以改变血管的顺应性,使血管收缩,增加交感神经系统的敏感性,影响血管自身调节,最终发生血流动力学改变,并通过增加颈动脉硬度,进一步加重血管损伤,血管硬度受血中甲状腺素水平的影响,血中FT3和FT4浓度越大,血管越僵硬,控制甲亢后血管硬度明显下降,说明甲亢时血管壁受到损伤。
此外,还有学者报道甲状腺功能失调会导致凝血-纤溶系统平衡障碍。国内有学者研究发现甲亢患者凝血、抗凝及纤溶等系统均有不同程度的异常,表现为不同程度的凝血功能增强,但目前甲亢患者出现凝血功能异常的机制尚不清楚。甲亢患者往往体内抗血友病因子(vWF)、凝血因子Ⅷ、组织型纤溶酶原激活物t-PA等促凝因子明显增高,红细胞比积增加,血小板黏附作用增强,导致血流动力学异常,血流淤滞,使脑灌注量下降,并促进脑血栓形成[14]。
3.2 诊断及治疗
综上所述,甲亢与脑梗死、脑萎缩之间有着密切的关系。自身免疫因素、交感神经兴奋性增高、动脉粥样硬化因素、心脏因素、甲状腺素增高及血管狭窄等因素可能促进了甲亢合并脑梗死、脑萎缩的发生与发展。因此对于中青年甲亢患者,当突然出现肢体无力、四肢抽搐等神经系统症状时,要想到脑梗死的可能,可先行脑CT检查,必要时行头颅MRI(增强),因MRI可以显示更多的解剖结构,相应的疾病诊治范围也明显得到了拓宽。有条件的医院,可视病情进一步行血管造影术和单光子发射计算机断层成像术(SPECT)。对脑梗死患者,尤其是血管造影提示血管狭窄的患者,在寻找病因时要考虑到甲亢的可能。
临床上遇到青年脑梗死患者,未发现有其他卒中原因时,需要明确是否合并有甲亢,若有应及时行针对性治疗。在治疗脑梗死的同时,也要积极控制甲亢。抗甲状腺药物通过抑制甲状腺过氧化物酶,进而抑制酪氨酸的碘化及耦联而影响甲状腺激素的代谢,同时还具有免疫调节作用,直接抑制甲状腺细胞活性,并影响甲状腺抗原表达,使自身抗体产生减少,从而缓解甲亢症状。对于那些血管造影术和SPECT显示有严重脑灌注损伤和脑血管储备能力下降的高危患者,要根据病情及时进行手术或介入治疗[14],血运重建和抗甲状腺药物治疗对于高危甲亢患者防止病情加重都是必需的。对于同时患有多发颅内动脉狭窄和甲亢的患者应积极控制甲状腺素水平,预防脑血管病。若伴有颅内血管的狭窄或闭塞,据Ohba等[15]研究报道可以选择单纯药物治疗和/或在药物治疗的基础上行颈浅动脉-大脑中动脉吻合术,至于手术治疗有无必要,取决于患者血管狭窄或闭塞的形成机制。如果患者颅内血管的改变是因免疫因素导致或起主要作用,手术治疗可能是必要的。此外,有国外学者[16]研究发现甲亢患者的甲状腺素水平经治疗恢复正常后,血管造影结果显示狭窄部位已恢复正常,患者神经系统损害也因甲亢病情的控制而呈可逆性转归,预后良好,这说明治疗甲亢是关键所在。如治疗及时,患者大多可获得较满意疗效,治疗后神经功能恢复也较好,不遗留有严重神经功能缺损[15]。
[1]Jovicevic M,Divjaki,Slankamenac P,etal.Non-atherosclerotic arteriopathy as the cause of ischemic stroke among young adults[J].Med Pregl,2010,63(5-6):324-332.
[2]Petersen P,Hansen JM.Stroke in thyrotoxicosis with atrial fibrillation[J].Stroke,1988,19(1):15-18.
[3]Squizzato A,Gerdes VE,Brandjes DP,etal.Thyroid diseases and cerebrovascular disease[J].Stroke,2005,36(10):2302-2310.
[4]Kushima K,Satoh Y,Ban Y,etal.Graves’thyrotoxicosis and moyamoya diseases[J].Can J Neurol Sci,1991,18(2):140-142.
[5]Sheu JJ,Kang JH,Lin HC,etal.Hyperthyroidism and risk of ischemic stroke in young adults:a 5-year follow-up study[J].Stroke,2010,41(5):961-966.
[6]Brandt F,Green A,Hegedus L,etal.A critical review and metaanalysis of the association between overt hyperthyroidism and mortality[J].Eur J Endocrinol,2011,165(4):491-497.
[7]Hwang JU,Kwon KY,Hur JW,etal.The role of hyperthyroidism as the predisposing factor for superior sagittal sinus thrombosis[J].J Cerebrovasc Endovasc Neurosurg,2012,14(3):251-254.
[8]Tendler BE,Shoukri K,Malchoff C,etal.Concurrence of Graves’disease and dysplastic cerebral blood vessels of the moyamoya variety[J].Thyroid,1997,7(4):625-629.
[9]Shi Z,Zhang X,Chen Z,etal.Elevated thyroid autoantibodies and intracranial stenosis in stroke at an early age[J].Int J Stroke,2013,10(9):2171-2177.
[10]Czarkowski M,Hilgertner L,Powalowski T,etal.The stiffness of the common carotid artery in patients with Graves’disease[J].Int Angiol,2002,21(2):152-157.
[11]Ran Lee,Kihye Sung,Yong Mean Park,etal.A caseof moyamoya disease in a girl with thyrotoxicosis[J].Yonsei Med J,2009,50(4):594-598.
[12]Rastogil,Gupta S,Godbole MM.Pathophysiological basis for thyrotoxicosis as an aggravating factor in post-ischemic brain injury in rats[J].JEndocrinol,2008,196(2):335-341.
[13]Wakamoto H,Ishiyama N,Miyazaki H,etal.The stenoses at the terminal portion of the internal carotid artery improved after initiation of antithyroid therapy:a case report[J].No Shinkei Geka,2000,28(4):379-383.
[14]Erem C.Thyroid disorders and hypercoagulability[J].Semin Thromb Hemost,2011,37(1):17-26.
[15]Ohba S,Nakagawa T,Murakami H.Concurrent Graves’disease and intracranial arterial stenosis/occlusion:special considerations regarding the state of thyroid function,etiology,and treatment[J].Neurosurg Rev,2011,34(3):297-304.
[16]Nakamura K,Yanaka K,Ihara S,etal.Multiple intracranial arterial stenoses around the circle of Willis in association with graves’disease:report of two cases[J].Neurosurgery,2003,53(5):1210-1215.
