香菇子实体中水溶性多糖LFI和LFII的分级精制及其结构表征*
2014-11-19张洪涛赵小亮范尊晓罗宸朱莉毛江川詹晓北毛延卿
张洪涛,赵小亮,范尊晓,罗宸,朱莉,毛江川,詹晓北,毛延卿
1(江南大学生物工程学院糖化学与生物技术教育部重点实验室,江苏无锡,214122)
2(中国海洋大学医药学院海洋药物教育部重点实验室,山东青岛,266003)
3(江苏瑞光生物科技有限公司,江苏无锡214000)
4(杭州众芝康菇生物技术有限公司,浙江杭州,310015)
香菇多糖(lentinan,简称LNT)最初是由Chihara等人从香菇中分离得到β-1,3/6葡聚糖,因其生物活性强、安全性高、来源广泛而引起人们的重视,近年来更是在国内外形成了一股开发香菇多糖的热潮[1-3]。武汉大学的张俐娜教授在国内较早开展了香菇多糖的结构与流变学特性的研究,通过采用不同的溶剂实现了水溶性多糖和水不溶性多糖的分离与分级制备,并对不同组分的单糖组成进行了分析[4],对水不溶性多糖中α-1,3葡聚糖的结构进行了表征[5],但是对水溶性多糖组分进行结构表征方面的研究至今仍鲜有报道。
在阐明食品中功能因子的量效与构效关系研究日益强化的今天,对香菇子实体中水溶性多糖的结构进行表征将有助于深入地挖掘其功能,理解其功效机制。ZHANG等对纯热水提取的水溶性多糖进行了结构表征[6],将其鉴定为含有 β-1,3/6 和 α-1,4/6 键的葡聚糖;WANG等用水提法对香菇子实体进行提取,获得的多糖为β-1,3/6葡聚糖[7];Jeff等在水提的基础上,用DEAE-Celluose柱子依次用水,0.5 mol/L和1 mol/L NaCl溶液进行洗脱,结果表明:水洗脱液中多糖为含有葡萄糖、半乳糖和甘露糖组成的α-杂多糖[8],NaCl流动相中的多糖则为含有葡萄糖、半乳糖和甘露糖组成的β-杂多糖[9]。大量研究表明,不同提取流程获得的多糖,其组成有差别[3]。因此,对不同的提取流程,仍需要进行多糖的结构分析与表征。
课题组在进行香菇多糖组分与组成分析过程中,主要采用了张俐娜教授所用的分离提取方法,如图1所示。但是到目前为止,对水提取部分多糖LFI和LFII的结构、组成进行表征的工作仍然没有进行。针对这一问题,本文主要利用IR,甲基化分析(GC-MS)和NMR技术对LFI和LFII的结构进行了表征与分析。此外,考虑多糖提取液中有色素、蛋白质、无机盐、低分子量物质等杂质,针对这一问题,本文也对利用不同树脂来除去香菇中提取多糖的色素方法进行了探索。本研究将为香菇子实体中可溶性多糖的提取、质量控制、功能挖掘与构效关系分析提供有用的信息与数据。
1 试验材料与方法
1.1 水溶性多糖的分级提取
将香菇子实体真空干燥2.5 h,然后再在常温下进行干燥,直到水分低于7%,用气流粉碎机进行粉碎,粉碎物直接过120目振动筛,收集备用。水溶性多糖的提取参照ZHANG[5]等的方法,(1)称取香菇多糖粉末 100 g,按 1∶20(g∶mL)溶于 0.9%NaCl水溶液中,60℃溶解12 h后8 000 r/min离心10 min,得到上清液LFⅠ;(2)沉淀按1∶20(g∶mL)比例加入到80℃水中,处理10 h后8 000 r/min离心10 min得到上清液LFⅡ。具体流程如图1所示。
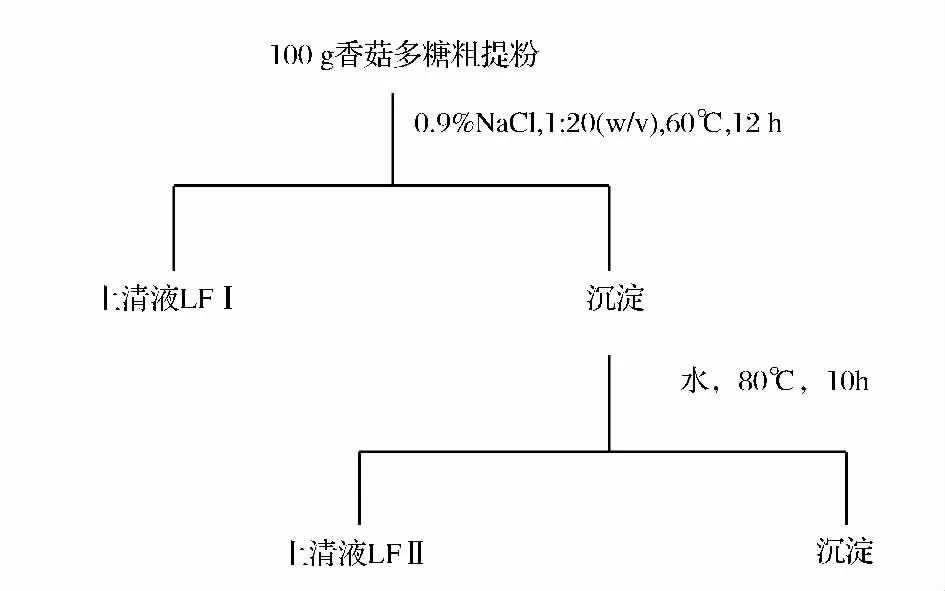
图1 水溶性多糖的分级提取流程Fig.1 The procedure of water-soluble polysaccharides extracted from Lentinus
1.2 色素的去除
树脂的预处理。AB-8和DA201:按1∶1.5将树脂浸泡在95%乙醇中,24 h后装柱水洗至无醇味。JK008:先用质量分数为5%的HCl浸泡,12 h后装柱洗脱至中性;再用质量分数为5%的NaOH浸泡,12 h后洗脱至中性。
树脂的选择。分别量取20 mL上清液LFI和LFII,每份上清液中各加入 3 mL AB-8、DA201、JK008三种树脂,确定了对提取液LFⅠ用6 mL AB-8树脂/10 mL提取液,LFⅡ用2 mL AB-8树脂/10 mL提取液进行色素脱除。
使用旋转蒸发的方法浓缩脱色素的上清液LFI和LFII。将浓缩液置于磁力搅拌器上,分别缓慢加入95%的乙醇至乙醇终体积分数为75%,混合均匀后于4℃冰箱隔夜,4 500 r/min离心10 min,收集沉淀。将沉淀溶于水后,置于截流量为7 000 Da的透析袋中,用离子水透析,每12 h更换1次水,透析2天。将透析液减压冷冻干燥后备用。
1.3 分子质量分布测定
冻干后的LFI和 LFII溶于水中,配成1 mg/mL(含0.2 mol/L NaCl)溶液,经过0.45 μm醋酸纤维素膜过滤(Whatman,Maidstone,UK),然后用于高效凝胶色谱(HPSEC)-多角度光散射联用 (MALLS)(DAWN HELEOSII,Wyatt Technology,USA),SHODEX OHpak SB-803-HQ(8 mm×300 mm,Showa Denko K.K.,Tokyo,Japan)柱(SB-804-HQ 作为保护柱)于25℃进行分离。激光光源为He-Ne laser,658 nm线性偏振激光,检测角度18个。0.1 mol/L NaNO3(含有0.02% 的叠氮化钠)作为流动相,流速为0.5 mL/min。数据处理用Wyatt Astra software软件。Mw(weight-average molecular weight)表示质均分子质量,Mn(number average molecular weight)表示数均分子量,分子质量分布指数(polydispersity index,PDI)用Mw/Mn来计算。
1.4 多糖LFI和LFII的傅里叶变换红外光谱(IR)分析
采用KBr圆盘法处理[10]:在红外灯照射下,取少许多糖和3~4勺KBr(多糖∶KBr质量比约为1∶50)于研钵中研细,取适量压成透光薄片,上样,使用Nicolet Nexus 470 FT-IR红外光谱仪在4 000~400 cm-1范围内进行检测分析,分辨率设置为32 scans/4 cm-1,分析软件为 Omnic software(version 7.0)。
1.5 多糖LFI和 LFII的核磁共振(NMR)分析
NMR分析样品的准备:将50 mg多糖LFI和LFII分别在P2O5真空干燥箱中充分干燥后溶解于0.5 mL D2O中,真空冷冻干燥,重复3次,最后将样品用0.5 mL DMSO-d6溶解转移至核磁管中,在25℃下进行一维1H-NMR分析和13C谱NMR分析,采用MestReNova软件进行数据辅助解析。
1.6 多糖LFI和 LFII的甲基化及气质联用(GC/MS)分析
甲基化:充分干燥的LFI和 LFII多糖样品2 mg置于微量反应管中,加入搅拌子,N2保护下加入1 mL无水DMSO,超声波助溶5 min,搅拌使其充分溶解。随后加入处理后NaH约50 mg,室温搅拌反应1 h,缓慢滴加0.5 mL CH3I反应1 h,加入1 mL ddH2O终止反应。向反应混合物中加入1 mL氯仿萃取,4 500 r/min离心10 min收集氯仿层,经减压浓缩至干,用少量氯仿溶解转移至安瓿瓶中干燥后中加入2 mol/L三氟乙酸振荡溶解后于110℃水解4 h。将水解产物转移至微量反应瓶,加入0.5 mL dd H2O完全溶解后,加入0.5 mL 0.1 mol/L NaOH溶液(含0.48 mol/L NaBD4)室温反应4 h。反应结束后加入20%的醋酸水溶液(约100 μL)至反应液pH呈中性。反应物经减压浓缩至干后于真空减压干燥箱中干燥。再加入0.5 mL无水吡啶溶解,搅拌溶解后,加入0.5 mL乙酸酐反应1h后,加入1 mL ddH2O淬灭,反应物加入二氯甲烷萃取3次,合并萃取液后再用2 mL ddH2O萃取4次,弃去水相,收集二氯甲烷层,减压浓缩至干后于真空干燥箱中干燥后备用。
GC-MS分析:样品用适量二氯甲烷溶解后进样GC-MS分析。参照 CCRC(complex carbohydrate research center,http://www.ccrc.uga.edu/specdb/ms/pmaa/pframe.html)数据库进行数据分析。
2 实验结果
2.1 树脂用量对脱色率和多糖保留率的影响
AB-8、DA201两种树脂的用量对香菇多糖提取液脱色率和多糖保留率的影响如图2所示(由于JK008脱色效果极弱,数据未展示)。从图2可以看出,与DA201树脂相比,AB-8树脂对提取液LFⅠ、LFⅡ中的色素吸附效果较好,AB-8对多糖的吸附率也高于DA201树脂。优化结果为:对提取液LFI用6 mL AB-8树脂/10 mL提取液,LFII用2 mL AB-8树脂/10 mL提取液进行色素脱除,此条件下色素脱除率分别为72%和53%,多糖保留率分别为43%和62%。AB-8有着较好的脱色和脱蛋白效果。
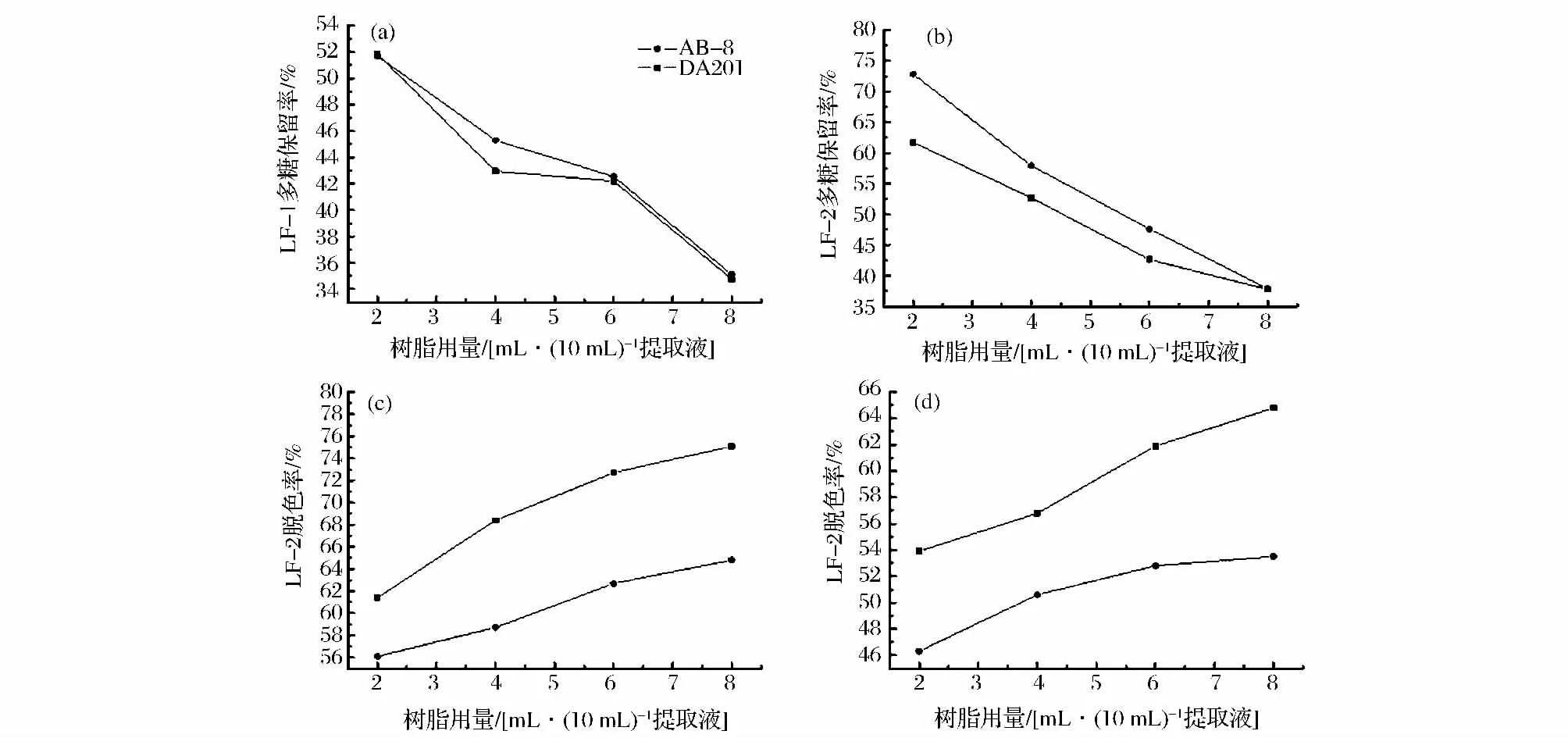
图2 AB-8和DA201树脂用量不同对LFI(LF1)和LFII(LF2)中色素脱出和多糖保留的影响Fig.2 The effect of amount used AB-8 and DA201 on pigments removing and polysaccharides keeping
2.2 分子质量分布分析
LFI和LFII分子质量如表1所示。从表1可以看出,LFI的Mw是1.350×106g/mol,LFII的 Mw 是2.771×106g/mol。LFII的分子质量比LFI大,这是由于LFII的提取温度较高造成的,因为温度越高,多糖的溶解性越好。Mw/Mn是衡量分子均一的指标,比值接近1支链越少,支链比较多的甚至高达20~50。LFI和 LFII的Mw/Mn分别是1.010和1.029。
2.3 IR光谱分析
LFI和LFII的红外光谱如图3所示。图3中在2 931 cm-1和1 362 cm-1处有2组吸收峰,该吸收峰分别代表了糖类化合物C—H伸缩振动和变角振动,而在3 390~3 420 cm-1吸收峰则代表了糖类化合物O—H 伸缩振动[11],为多糖特征吸收峰[12],1 249 和1 643 cm-1处也为多糖的特征吸收峰,这些峰在LFI和LFII的IR图中均可以看到,这说明两者均为多糖。950~1 250 cm-1有强吸收峰,表示其为呋喃单体,在LFI和 LFII中均可以看到,说明LFI和LFII的单糖组成为呋喃单体类型。

表1 LFI和LFII分子量Table 1 Experimental results of the Mw and Mn of LFI and LFII at 25℃
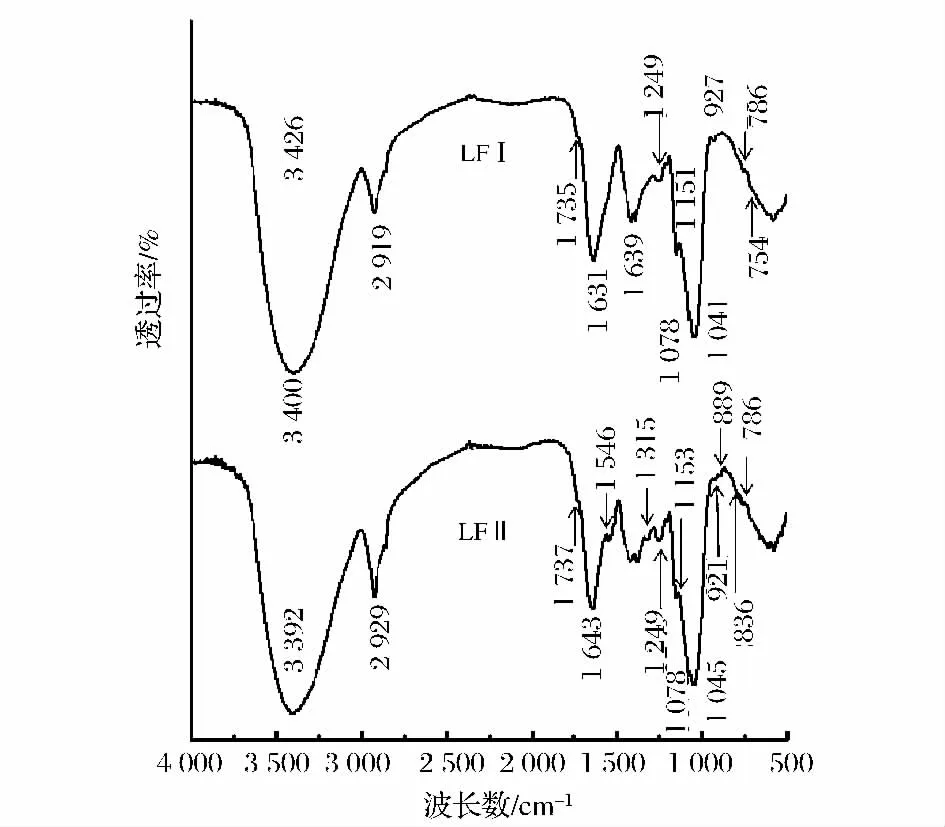
图3 LFI和 LFII红外光谱Fig.3 IR spectra of LFI and LFII
1 732 cm-1处为-COOH中 C=O的特征吸收峰和1213 cm-1处-COOH中OH变角振动吸收峰,LFI和LFII的红外光谱中均没有观察的该吸收峰,这表明LFI和LFII均不含葡萄糖醛酸。810 cm-1是甘露糖特征吸收峰[12],LFI和 LFII的IR图谱观察到810 cm-1,表明LFI和 LFII均含有甘露糖。
在926 cm-1、844 cm-1和822 cm-1处有吸收峰为α-(1→3)-D-葡聚糖的特征吸收[5]。920 cm-1是 α-D-葡聚糖的特征吸收峰,LFI的红外光谱图中观察到927 cm-1吸收峰,这表明LFI含有α-D-葡聚糖单元。
890 cm-1处吸收是 β-吡喃糖苷键的特征峰[11,13-14],从 LFII的 IR 图中可以看到,在 889 cm-1有吸收峰,则表示LFII分子中有β-D-Glc的C—H差相异构吸收峰,即LFII中含有β呋喃构型糖单元。β型葡聚糖C—H直立键在(891±7)cm-1有弱吸收,LFII的IR图中可以看到在921 cm-1有吸收峰表明LFII含有β-D-Glc单元。
2.4 NMR分析
LFI和 LFII样品在 DMSO/D2O中的600 MHz1H-NMR图谱如图4所示。在1H-NMR图谱中,β-键在4.1~4.9 ppm范围内有峰,而α-键在5.0~5.6 ppm范围内有峰出现[15]。由图4知,LFI和 LFII均既含有β-键也含有α-键。对于13CNMR分析,C1的信号峰一般在100~104 ppm C2,C3,C4,C5和 C6的在60~80 ppm,如果含有糖蛋白则会在20~40 ppm 出现信号峰[16]。δ(C3)(86.7/86.8/86.9 ppm)和δ(C6)(68.8/68.9 ppm)表明多糖存在1,3-和1,6-键型的糖单元[17-18],LFI 和 LFII的均含有这 2 个特征峰,这表明LFI和 LFII均含有1,3-和1,6-键型。
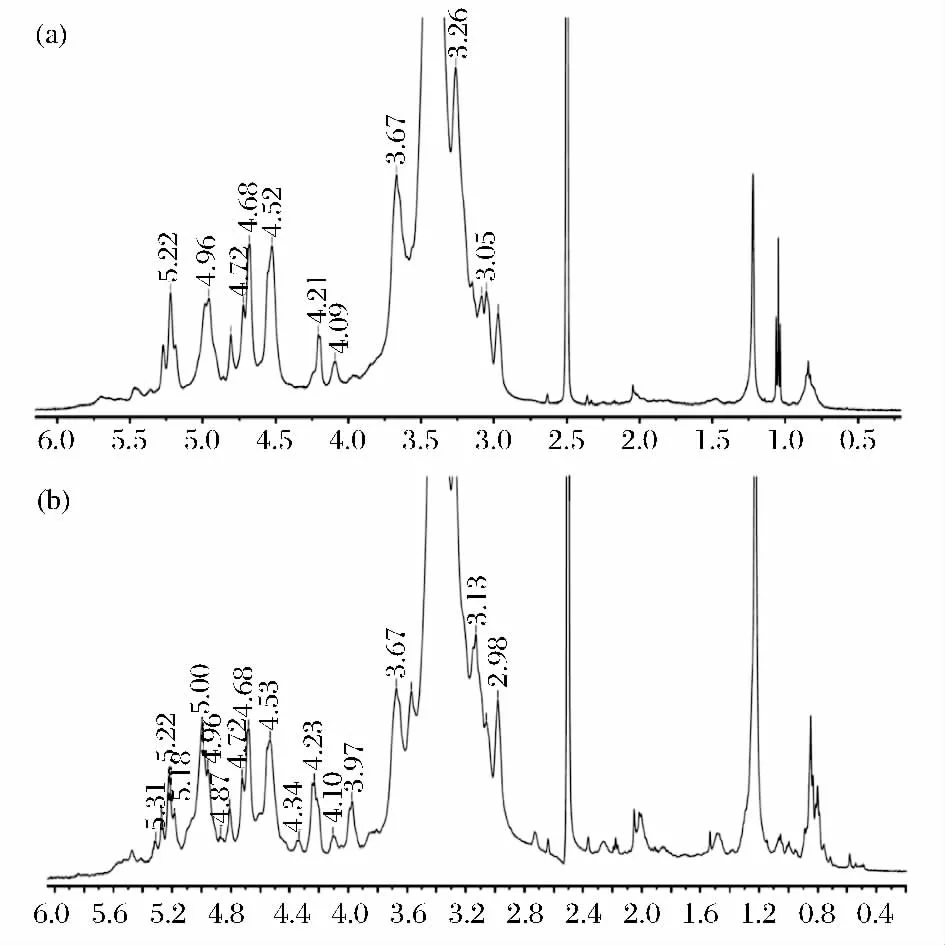
图4LFI(a)和LFII(b)的1H-NMR图谱Fig.4 1H-NMR chemical shifts of LFI(a)and LFII(b)
LFI和 LFII的1H-NMR谱图如图4所示,δ4.96 ppm为α-1Xyl的H1信号峰,δ4.72 ppm为β-1Xyl的H1信号峰,δ4.53 ppm 为β-1Glc6的H1信号峰 (参考http://cell.ccrc.uga.edu/world/xgnmr/)。
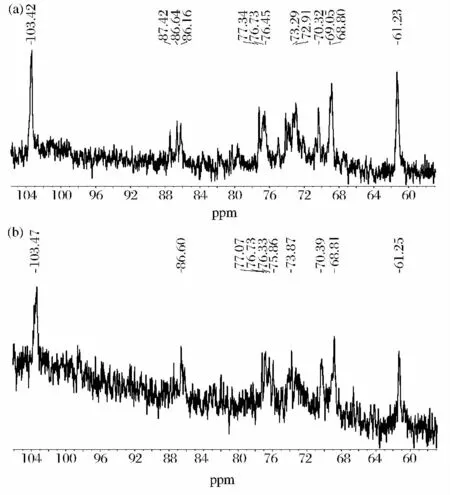
图5LFI(a)和LFII(b)的13C-NMRFig.5 13C-NMR chemical shifts of LFI(a)and LFII(b)
LFI和LFII的13CNMR分析如图5所示。从图5中可以看出,LFI和LFII均含有δ103.4的信号峰,这表明两者均含 β-键糖单元[19]。LFI的1H-NMR含有的 δ4.52为 β-1,3,6键连接的 Glc的1H 信号峰,δ4.68为β-1,3键连接的Glc的1H信号峰,δ4.96为α-1,6 键连接的 Glc的1H 信号峰[20],δ5.22 为 α-1Glc的1H 信号峰,δ5.47 为 α-1Glc4-键的1H 信号峰[21]。LFII的1H-NMR 含有的 δ4.53为 β-1,3,6键连接的Glc的1H信号峰,δ4.68为β-1,3键连接的Glc的1H信号峰,δ4.96为α-1,6键连接的Glc的1H信号峰,δ5.22 为 α-1Glc的1H 信号峰[7]。
2.5GC-MS分析
利用改良的Hakomori方法,样品LFI和LFII依次经甲基化、水解、还原、乙酰化后进行GC-MS分析所得的GC-MS图谱如图3所示。参照CRCC(complex carbohydrate research center,http://www.ccrc.uga.edu/specdb/ms/pmaa/pframe.html)数据库中的标准谱图进行数据分析。香菇中多糖成分主要由葡萄糖、木糖、甘露糖和半乳糖组成[4,8-9],结合 IR 和NMR数据,样品LFI的各单糖衍生物质谱数据如表2所示,样品LFⅡ的各单糖衍生物质谱数据如表3所示。1,6-Man和1,4,6-Man主要根据已经报道的香菇多糖水提取多糖中Man的键型为α,因而将其归为α-1,6-Man 和 α-1,4,6-Man[9,22-23]。
3 讨论
与WANG等[7]利用水提法从香菇子实体中获得的多糖为β-1,3/6-葡聚糖不同,本研究中的所提取、获得的水溶性多糖组份为由葡萄糖,半乳糖和甘露糖组成的杂多糖,这一结果与Jeff等的研究中关于水溶性多糖的单糖组成分析相一致[8-9],但是在Jeff等的报道中,纯水提取的多糖为 α型多糖,0.5 mol/L NaCl提取的多糖为α和β混合型多糖,本研究所获得的LFI和LFII均为α和β混合键型多糖;LFI多糖组分由 α-1Man,β-1Glc,α-1Gal,β-1,3-Glc-,α-1,6-Glc-,α-1,4-Glc-和 α-1,4,6-Man-糖单元组成。LFII多糖组分由 α-1Xyl,α-1Gal,β-1Glc,β-1,3-Glc-,β-1,6-Glc-,α-1,6-Man-,β-1,3,6-Glc,α-1,4,6-Man-和 α-1,2,6-Gal-糖单元组成。
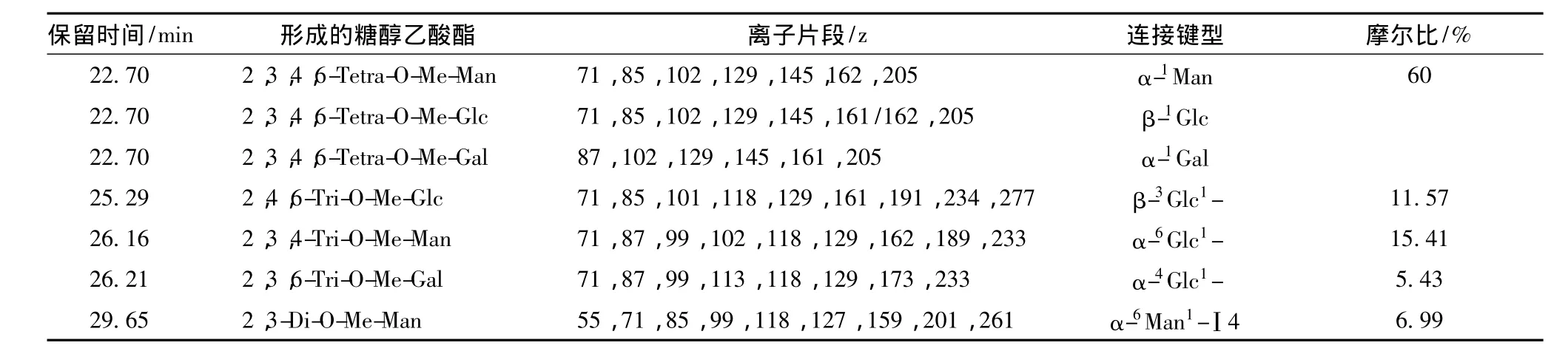
表2 基于GC-MS技术的LFI甲基化分析Table 2 GC-MS analysis of alditol acetates of LFI

表3 基于GC-MS技术的LFII甲基化分析Table 3 GC-MS analysis of alditol acetates of LFII
[1] Chihara G,Maeda Y,Hamuro J,et al.Inhibition of mouse sarcoma 180 by polysaccharides from Lentinus edodes(Berk.)sing[J].Nature,1969,222(5194):687-688.
[2] Shen J,Yao J-f,Tanida M,et al.An evidence-based perspective of Lentinus edodes(Shiitake mushroom)for cancer patients[M].Springer:Evidence-based Anticancer Materia Medica,2011:303-317.
[3] Xu X,Yan H,Tang J,et al.Polysaccharides in Lentinus edodes:Isolation,Structure,Immunomodulating activity and future prospective[J].Crit Rev Food Sci Nutr,2014,54(4):474-487.
[4] 张俐娜,张平义,李翔,等.香菇多糖的成分及其分子量研究[J].高等学校化学学报,1998,19(9):1 513-1 517.
[5] Zhang P,Zhang L,Cheng S.Chemical Structure and Molecular Weights of α-(1→3)-D-Glucan from Lentinus edodes[J].Biosci Biotechnol Biochem,1999,63(7):1 197-1 202.
[6] Yu Z,Ming G,Kaiping W,et al.Structure,chain conformation and antitumor activity of a novel polysaccharide from Lentinus edodes[J].Fitoterapia,2010,81(8):1 163-1 170.
[7] WANG Kai-ping,WANG Jun,LI Qiang,et al.Structural differences and conformational characterization of five bioactive polysaccharides from Lentinus edodes[J].Food Res Int,2014,62:223 -232.
[8] Jeff I B,Yuan X,Sun L,et al.Purification and in vitro anti-proliferative effect of novel neutral polysaccharides from Lentinus edodes[J].Int J Biol Macromol,2013,52:99-106.
[9] Jeff I B,Li S,Peng X,et al.Purification,structural elucidation and antitumor activity of a novel mannogalactoglucan from the fruiting bodies of Lentinus edodes[J].Fitoterapia,2013,84:338-346.
[10] 刘美琴,李建中.香菇菌丝体多糖的分离鉴定与免疫功能研究[J].生物化学与生物物理学报:英文版,1999,31(1):46-50.
[11] 于广利,王莹,赵峡,等.一种碱溶性灰树花菌丝体多糖GFM2A的制备和结构表征[J].高等学校化学学报,2007,28(1):87-91.
[12] 孙玉军,陈彦,王洵,等.蜜环菌胞外多糖的分离纯化及其性质研究[J].安徽大学学报:自然科学版,2005,29(5):87-91.
[13] Cael J J,Koenig J L,Blackwell J.Infrared and Raman spectroscopy of carbohydrates:Part IV.Identification of configuration-and conformation-sensitive modes for d-glucose by normal coordinate analysis[J].Carbohydr Res,1974,32(1):79-91.
[14] Gonzaga M L C,Menezes T M,de Souza J R R,et al.Structural characterization of β glucans isolated from Agaricus blazei Murill using NMR and FTIR spectroscopy[J].Bioactive Carbohydrates and Dietary Fibre,2013,2(2):152-156.
[15] Bluhm T L,Sarko A.The triple helical structure of lentinan,a linear β-(1→ 3)-D-glucan[J].Can J Chem,1977,55(2):293-299.
[16] Gonzaga M L C,Ricardo N M,Heatley F,et al.Isolation and characterization of polysaccharides from Agaricus blazei Murill[J].Carbohydr Polym,2005,60(1):43 -49.
[17] Agrawal P K.NMR spectroscopy in the structural elucidation of oligosaccharides and glycosides[J].Phytochemistry,1992,31(10):3 307-3 330.
[18] Ogawa K,Ikeda Y,Umemura K.NMR analyses of oligosaccharides from a new water-absorbing polysaccharide produced by the family oxalobacteraceae[J].Yakugaku zasshi:Journal of the Pharmaceutical Society of Japan,2009,129(4):503-512.
[19] Spies T,Praznik W,Hofinger A,et al.The structure of the fructan sinistrin from Urginea maritima[J].Carbohydr Res,1992,235:221-230.
[20] Maity K,Maity S,Gantait S K,et al.Structural characterization and study of immunoenhancing and antioxidant property of a novel polysaccharide isolated from the aqueous extract of a somatic hybrid mushroom of Pleurotus florida and Calocybe indica variety APK2[J].Int J Biol Macromol,2011,48(2):304 -310.
[21] Mizuno T,Hagiwara T,Nakamura T,et al.Antitumor activity and some properties of water-soluble polysaccharides from"Himematsutake",the fruiting body of Agaricus blazei Murill[J].Agric Biol Chem,1990,54(11):2 889-2 896.
[22] Allerhand A,Berman E.Systematic approach to the analysis of carbon-13NMR spectra of complex carbohydrates.I..alpha.-D-Mannopyranosyl residues in oligosaccharides and their implications for studies of glycoproteins and glycopeptides[J].J Am Chem Soc,1984,106(8):2 400-2 412.
[23] Allerhand A,Berman E.Systematic approach to the analysis of carbon-13NMR spectra of complex carbohydrates.2.Application to the high mannose glycopeptides of hen ovalbumin[J].J Am Chem Soc,1984,106(8):2 412-2 420.
