RGD功能化多肽纳米纤维的制备及其体内肿瘤靶向性研究
2014-11-17杨翠红张玉民刘金剑刘鉴峰吴红英褚丽萍
杨翠红,张玉民,刘金剑,刘鉴峰,吴红英,褚丽萍
(北京协和医学院&中国医学科学院放射医学研究所 实验核医学室,天津市放射医学与分子核医学重点实验室,天津 300192)
从20世纪90年代,自组装多肽由于其组成为氨基酸,具有合成简单、生物相容性好、易于进行功能基团的修饰,且可以根据需要自下而上地设计其序列组成,被广泛应用于组织工程、药物传输和再生医学等领域[1-3]。由多肽自组装形成的仿生纳米材料其三维结构可以是球形,囊泡结构,片层结构,纳米管和纳米纤维等。其中,由多肽自组装形成的纳米纤维已广泛用于三维细胞培养,修复与再生医学以及组织工程研究中[4]。
短肽序列精氨酸-甘氨酸-天冬氨酸(arginine-glycine-aspartic acid,RGD)是整合素αvβ3的结合基序。整合素αvβ3具有在正常细胞、成熟血管内皮细胞表面低表达,而在肿瘤新生血管内皮细胞表面和部分肿瘤细胞表面呈高水平表达的特性,这使其成为肿瘤新生血管显像及靶向治疗的主要靶点[5-8]。
本文旨在通过多肽固相合成技术合成RGD功能化的自组装多肽Nap-GFFYGRGD和非靶向的对照多肽Nap-GFFYGRGE,采用放射性同位素125I标记技术对多肽分子的体内分布以及肿瘤靶向性进行系统研究,以期为抗肿瘤药物载体提供数据支持。
1 材料与方法
1.1 材料
1.1.1 材料与试剂:BALB/c小鼠,雌性,平均体质量(20±0.5)g,购自北京军事医学科学院[许可证号:SCXK-(军)2007-004],所有动物实验均遵循《实验动物保护条例》。多肽合成用氨基酸和有机试剂均购自天津凯通化学试剂有限公司;电镜铜网、醋酸双氧铀购自北京中镜科仪技术有限公司;Na125I(放射性比活度为12.95 GBq/mL)购自美国PE公司;氯胺-T,偏重亚硫酸钠购自北京鼎国昌盛生物技术有限公司。
1.1.2 主要仪器:全自动 γ计数仪(2470 WIZARD2,PerkinElmer,美国);质谱仪(Finnigan LCQ AD,Thermo,美国);1H核磁共振(VARIAN Unity Plus 400 MHZ,Varian Instruments,美国);高效液相色谱(HPLC,绿绵科技有限公司,北京);透射电子显微镜(Tecnai G2 F20 系统,FEI,美国)。
1.2 方法
1.2.1 多肽合成及表征:利用2-氯三苯甲基氯树脂通过固相多肽合成方法制备Nap-GFFYGRGD和Nap-GFFYGRGE,具体合成方法参考徐宏艳等[9]。得到的粗产品使用反相高效液相色谱进行分离提纯,分离柱采用C18,流动相为甲醇(含0.05%三氟乙酸)和水(含0.05%三氟乙酸)。通过核磁共振和高分辨率质谱对多肽分子结构进行表征。
1.2.2 多肽自组装与形貌观察:用PBS溶液(0.01M,pH7.4)制备浓度为3mg/mL的RGD-肽和RGE-肽溶液,通过加入适量1M的NaCO3溶液调节pH值至7.4。将多肽溶液于玻璃小瓶中加热至沸腾,自然冷却至室温,静置2 h即得到稳定的RGD-纤维和RGE-纤维溶液。分别取多肽纤维溶液10μL至铜网上,用饱和醋酸双氧铀染液染色5s,用超纯水洗1次后置于干燥器中过夜,用于透射电镜观察。
1.2.3 多肽125I标记及纯化:采用氯胺-T法对多肽进行放射性同位素125I标记。配制2mg/mL的多肽溶液,向500μL多肽溶液中加入0.5 mCi Na125I和500μL氯胺-T溶液(1mg/mL),室温震荡反应2 min,再加入500μL偏亚硫酸盐钠溶液(0.2mg/mL)用以终止反应。标记多肽通过放射性HPLC进行分离纯化,流动相为乙腈和甲醇。
1.2.4 肿瘤模型的制备:选取4~5周雌性的BALB/c小鼠,前肢腋下注射小鼠乳腺癌细胞系4T1细胞悬液100μL(4×105细胞),SPF级环境中饲养,2周后筛选肿瘤体积约为200 mm3的小鼠用于实验。
1.2.5 组织分布:将荷瘤BALB/c小鼠随机分为125I-RGD-纤维组和125I-RGE-纤维组,每组12只;共分4个时间点取材,每个时间点 3只。将125I-RGD-纤维和125I-RGE-纤维溶液按2.0×104Bq/g剂量经尾静脉注射入小鼠体内,注射后1、3、6、12 h进行取材;具体操作为:摘眼球取血,将小鼠脱颈处死后取肿瘤组织和心、肝、脾、肺、肾、胃、大肠、小肠、肌肉和脑等器官,称重后利用γ计数仪检测各样品中的放射性活度,计算放射性摄取率——以每克组织放射性占注射量的百分比(%ID/g)表示。
1.3 统计学方法 应用SPSS 19.0进行分析,正态计量数据采用“±s”表示,以P<0.05为差异有统计学意义。
2 结果
2.1 多肽的分子结构及其自组装微观形貌 RGD多肽和RGE多肽的分子结构式见图1。透射电镜结果表明3mg/mL的RGD-肽和RGE-肽溶液自组装后的微观形貌均为纳米纤维,直径约为10~20 nm(见图2)。

图1 多肽分子Nap-GFFYGRGD(A)和Nap-GFFYGRGE(B)结构式Fig.1 Molecular structures of Nap-GFFYGRGD(A)and Nap-GFFYGRGE(B)

图2 多肽自组装纳米纤维RGD-纤维(A)和RGE-纤维(B)的透射电镜图Fig.2 TEM images of RGD-fiber(A)and RGE-fiber(B)
2.2 多肽125I标记及其纯化 为了研究多肽的体内分布情况,通过氯胺-T法对多肽序列中的酪氨酸(羟基苯环的邻位上)进行放射性同位素125I标记,利用放射性HPLC进行分离纯化。放射性HPLC图谱结果显示多肽的标记率约为70.3%(见图3)。纯化后可以用于后续体内分布实验。
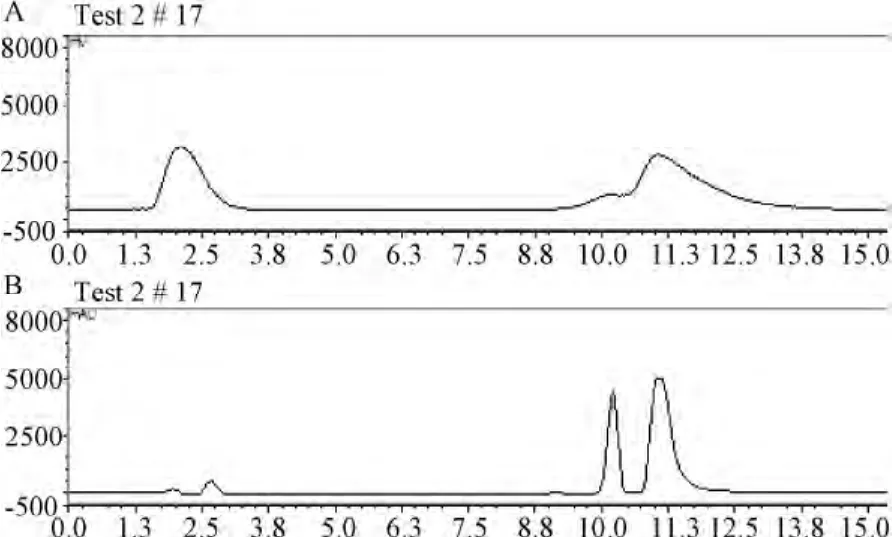
图3 125 I标记多肽的放射性HPLC图谱A:放射性信号通道;B:HPLC 214 nm通道最左边峰为游离同位素125 I峰;中间峰为未标记多肽峰;右峰为125 I标记多肽峰Fig.3 The Radioactive HPLC images of iodine-125 labeled peptidesA:radioactive channel;B:HPLC channel of 214 nm peaks from left to right was free 125 I,non-labelled peptide and 125 I-labelled peptide
2.3 组织分布 2种纳米纤维的体内分布结果见图4,由图4A和4B可以看出RGD纤维和RGE纤维在组织中的分布规律相似,均在胃中分布最高,且在注射后1 h分布最高,分别为33.1%ID/g和35.5%ID/g,其次为大肠、小肠和血液,且随着时间的延长逐渐被清除体外。值得注意的是,2者在肿瘤组织中的分布有差异。如图4C所示,在注射后1~6h期间,RGD纤维在肿瘤组织中的分布一直呈现逐渐增加的趋势,而RGE纤维从3 h开始降低,尤其是在6 h时RGD纤维的肿瘤蓄积量是RGE纤维的2.2倍(分别为6.25%ID/g和2.79%ID/g),差异有统计学意义(P<0.01)。

图4 125 I标记多肽纳米纤维的体内分布结果A:RGD-纤维的组织分布结果;B:RGE-纤维的组织分布结果;C:RGD-纤维和RGE-纤维的肿瘤组织分布结果**P<0.01,与RGE-fiber相比Fig.4 The in vivo distribution of iodine-125 labeled peptide nanofibers after i.v.administrationA:RGD-fiber;B:RGE-fiber;C:the tumor accumulation**P<0.01,compared with RGE-fiber
3 讨论
多肽自组装形成的纳米纤维在药物传输领域是一个崭新的研究方向,并且有非常好的应用前景[10]。Stupp课题组报道了由两亲性多肽分子自组装形成的纳米纤维可以作为疏水抗癌药物喜树碱的载体,并在小鼠体内明显抑制了肿瘤的生长[11]。本课题组之前研究发现多肽分子Nap-GFFYGRGD与疏水抗肿瘤药物10-羟基喜树碱共组装形成的载药纳米纤维在体内可明显提高10-羟基喜树碱的抑瘤效果[12]。
三肽序列精氨酸-甘氨酸-天冬氨酸(Arginine-Glycine-Aspartic acid,RGD)是最为广泛使用的肿瘤靶向短肽,已用于治疗基因、药物、脂质体、蛋白和显像剂等的肿瘤靶向传输[13-14]。RGD基序可以通过多肽固相合成技术在多肽合成过程中直接共价结合到自组装多肽的外层亲水序列中,合理地设计自组装多肽序列可以得到含活性RGD靶向基团的纳米结构。Zheng等[15]通过Nap-FFGRGD分子在疏水血管材料表面自组装得到了RGD功能化血管,原位移植后提高了兔颈动脉的血管再生和整合能力。
以上文献报道以及本课题组前期的研究结果都表明:自组装多肽纳米纤维用于药物载体在细胞及动物水平上均具有较好的治疗效果,但是尚无文献报道直接研究此类载体材料经尾静脉注射后的体内分布情况,尤其是肿瘤组织靶向情况。放射性同位素示踪技术是利用放射性核素作为示踪剂对化合物进行标记,通过对放射性信号的检测研究化合物最终去向的方法,可以实现在分子水平、细胞水平、组织乃至全身水平上的化合物定量示踪研究。因其具有示踪灵敏度高、定位准确等优点已经被大量应用于生物学、医学研究及临床诊断中[16]。
本研究通过合成含有肿瘤靶向基团RGD的多肽,并以125I为示踪剂对多肽进行标记,自组装后形成纳米纤维,经尾静脉注射后研究靶向多肽纤维的体内分布及肿瘤组织蓄积情况。实验结果表明RGD-纤维与阴性对照RGE-纤维相比在体内肿瘤部位的分布明显增加,显示出明显的体内肿瘤靶向作用,为其作为药物载体的体内及临床应用提供了理论依据。
[1]Gelain F,Bottai D,Vescovi A,etal.Designer self-assembling peptide nanofiber scaffolds for adult mouse neural stem cell 3-dimensional cultures[J].PLoSone,2006,1(1):e119.
[2]Horii A,Wang X,Gelain F,etal.Biological designer self-assembling peptide nanofiber scaffolds significantly enhance osteoblast proliferation,differentiation and 3-D migration[J].PLoSOne,2007,2(2):e190.
[3]Koutsopoulos S,Zhang S.Two-layered injectable self-assembling peptide scaffold hydrogels for long-term sustained release of human antibodies[J].JControl Release,2012,160(3):451-458.
[4]Hauser CA,Zhang S.Designer self-assembling peptide nanofiber biological materials[J].Chem Soc Rev,2010,39(8):2780-2790.
[5]Aluri S1,Janib SM,Mackay JA.Environmentally responsive peptides as anticancer drug carriers[J].Adv Drug Deliv Rev,2009,61(11):940-952.
[6]Temming K,Schiffelers RM,Molema G,et.al.RGD-based strategies for selective delivery of therapeutics and imaging agents to the tumour vasculature[J].Drug Resist Updat,2005,8(6):381-402.
[7]Mitra A,Mulholland J,Nan A,et.al.Targeting tumor angiogenic vasculature using polymer-RGD conjugates[J].J Control Release,2005,102(1):191-201.
[8]Holig P,Bach M,Volkel T,etal.Novel RGD lipopeptides for the targeting of liposomes to integrin-expressing endothelial and melanoma cells[J].Protein Eng Des Sel,2004,17(5):433-441.
[9]徐宏艳,杨翠红,刘金剑,等.氨基酸构型对多肽纳米纤维体内分布的影响[J].天津医药,2014,42(2):143-147.
[10]Ulijn RV,Smith AM.Designing peptide based nanomaterials[J].Chem Soc Rev,2008,37(4):664-675.
[11]Toft DJ,Moyer TJ,Standley SM,etal.Coassembled cytotoxic and pegylated peptide amphiphiles form filamentous nanostructures with potent antitumor activity in models of breast cancer[J].ACS Nano,2012,6(9):7956-7965.
[12]Liu J,Liu J,Chu L,etal.Self-assembling peptide of D-amino acids boosts selectivity and antitumor efficacy of 10-hydroxycamptothecin[J].ACSAppl Mater Interfaces,2014,6(8):5558-5565.
[13]Temming K,Schiffelers RM,Molema G,etal.RGD-based strategies for selective delivery of therapeutics and imaging agents to the tumour vasculature[J].Drug Resist Updat,2005,8(6):381-402.
[14]Park J,Singha K,Son S,etal.A review of RGD-functionalized nonviral gene delivery vectors for cancer therapy[J].Cancer Gene Ther,2012,19(11):741-748.
[15]Zheng W,Wang Z,Song L,etal.Endothelialization and patency of RGD-functionalized vascular grafts in a rabbit carotid artery model[J].Biomaterials,2012,33(10):2880-2891.
[16]Gíslason J,Iyer S,Hutchens TW,etal.Lactoferrin receptors in piglet small intestine:lactoferrin binding properties,ontogeny,and regional distribution in the gastrointestinal tract[J].J Nutr Biochem,1993,4(9):528-533.
