胡黄连苷Ⅱ药理研究进展
2014-11-17张文锐周微宋瑛世张四喜
张文锐,周微,宋瑛世,张四喜
(吉林大学第一医院 药品管理部,吉林 长春 130021)
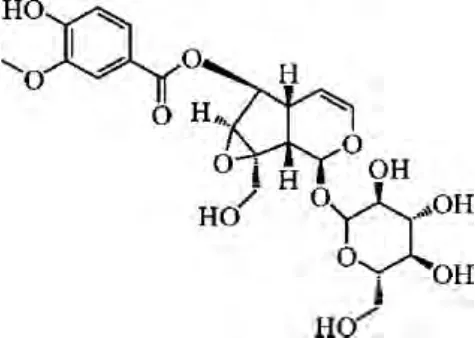
胡黄连苷Ⅱ(picrosideⅡ)为玄参科植物胡黄连根茎主要药用成分环烯醚菇类的主要有效成分,有明显的保护肝脏损伤、抗哮喘神经细胞保护、抗氧化作用等作用[1-3],分子式C23H28O13,分子量 512,解离常数为7.77[4],结构如下:
1 药理研究
1.1 保护肝损伤 胡黄连苷Ⅱ对肝细胞氧化应激损伤具有保护作用,其机制可能为通过减少膜脂质过氧化产物,提高机体清除氧自由基能力,强化抗氧化解毒系统,减少氧自由基,发挥抗脂质过氧化损伤作用,增强细胞本身抗氧化系统的功能,从而对肝细胞氧化损伤起到保护作用。通过保护细胞膜、线粒体膜的作用而达到阻断自由基损伤作用。胡黄连苷Ⅱ可抑制H2O2诱导肝细胞(L-02细胞株)细胞凋亡,增加H2O2损伤后的L-02生存率[2-3]。胡黄连苷Ⅱ对L-02细胞没有细胞毒性,在用胡黄连苷Ⅱ作用L-02细胞后,和正常培养的L-02细胞相比较他的凋亡率没有显著性差异[2]。
相关研究表明,胡黄连苷Ⅱ能明显减轻四氯化碳(CCl4)、D-氨基半乳糖,(D-Gal-N)、对乙酞氨基酚(AP)所致的肝细胞损伤,保护线粒体正常结构,提高机体清除氧自由基能力[5]。胡黄连苷Ⅱ显著抑制AP肝损伤模型引起的肝毒性,提高线粒体ATPase酶的活性,改善线粒体肿胀度并使肝脏能量代谢趋于正常。保肝作用的机制可能是胡黄连苷Ⅱ通过保护线粒体膜功能,提高线粒体ATPase酶的活性达到调整肝脏能量代谢紊乱的作用,其作用强于阳性对照药联苯双酯[6]。
另一项研究表明,胡黄连苷Ⅱ还可降低D-氨基半乳糖和脂多糖诱导急性肝损伤的丙氨酸氨基转移酶和天门冬氨酸氨基转移酶,同时减少丙二醛含量,增强超氧化物歧化酶活性。其机制可能与抑制细胞凋亡基因表达和增强抗氧化作用有关[7]。
1.2 对大脑的保护作用
1.2.1 神经细胞保护作用:胡黄连苷Ⅱ可通过多种途径改善神经损伤,保护神经细胞,起到神经细胞的保护作用[8]。
胡黄连苷Ⅱ提高大鼠脑组织的抗氧化能力、减少脑缺血再灌注所致的氧化性损伤,达到改善脑缺血再灌注损伤大鼠的神经行为功能[9-11]。
通过提高神经细胞内抗氧化酶活性而抑制自由基产生,发挥抗脂质过氧化损伤作用。可减轻H202所诱导的肾上腺嗜铬细胞瘤细胞12(adrenal gand pheoehromoeytoma,PC12)细胞损伤,提高神经细胞存活率[8,12-13]。相关实验表明,胡黄连苷Ⅱ能够抑制大鼠脑缺血再灌注后缺血半影区相关炎性因子表达和细胞凋亡,改善大鼠的神经行为功能[14-16]。胡黄连苷Ⅱ可减少乳酸脱氢酶(lactate dehydrogenase,LDH)的释放量,降低细胞内活性氧水平,提高细胞的存活率。陶移文等[13]通过建立神经细胞自由基损伤模型,对肾上腺嗜铬细胞瘤细胞12(PC12)损伤具有明显的保护作用。与下调脑内 N-甲基-D-天门冬氨酸受体(NMDARlmRNA)表达有关,减轻兴奋性氨基酸的神经毒性,从而改善大鼠脑缺血再灌注后损伤神经元的功能,起到神经保护作用。动物实验表明,使用胡黄连苷Ⅱ后缺血侧皮质区和纹状体区N-甲基-D-天门冬氨酸受体(NMDARl)mRNA的表达基本接近正常,并且明显低于对照组[17]。
神经生长因子(NGF)具有抗兴奋性氨基酸、抗自由基的神经毒性、抑制神经细胞凋亡、维持细胞内Ca2+的稳态等作用。杨学伟[18]通过复制大鼠大脑中动脉缺血再灌注模型,发现胡黄连苷Ⅱ使缺血再灌注NGF表达增加促进神经保护的作用;但实验同时表明,缺血性脑损伤时引起的NGF表达增加时间很短,且表达水平有限,所有难以对受损神经元起到全面而持久的保护作用。
胡黄连苷Ⅱ通过抑制炎性细胞因子Toll样受体4(TLR4)的表达,进一步下调更多的下游细胞因子产生,减轻脑缺血后引起的神经细胞的损伤和炎症反应,达到保护脑细胞的作用[19]。
神经元特异性烯醇化酶与缺血性脑损伤后的诊断、损伤程度、梗死体积、判断预后具有高度相关性。胡黄连苷Ⅱ可使脑缺血模型Wistar大鼠尼氏体损伤减轻,凋亡细胞减少,神经元特异性烯醇化酶蛋白表达以及mRNA反转录水平都有不同程度的降低,从而起到抗脑缺血损伤的神经保护作用[20]。
1.2.2 脑缺血损伤的保护作用:胡黄连苷Ⅱ可通过抑制下调大鼠脑缺血损伤后核转录因子κB(NF-κB)、炎性细胞因子Toll样受体4(TLR4)、半胱天冬酶-3(Caspase-3),以及肿瘤坏死因子α(TNF-α)的表达,减少其底物多聚腺苷酸二磷酸核糖聚合酶的降解,使多聚腺苷酸二磷酸核糖聚合酶利用缺血半暗带细胞内残存的能量,修复可逆性神经细胞损伤等多种途径抑制脑缺血损伤导致的细胞凋亡[16,21-23]。
大鼠脑缺血后缺血周围皮质区水通道蛋白4(AQP4)蛋白表达增强,AQP4对水进出BBB及脑、脑脊液屏障方面起重要作用,在脑脊液代谢、脑内水平衡的调节中扮演重要角色,大鼠脑缺血3 h后,梗死组织周围皮质区的AQP4蛋白表达升高,而胡黄连苷Ⅱ可下调 AQP4 的表达,减轻脑水肿程度[15,23-27]。
基质金属蛋白酶9(MMP9)属于明胶酶类,而在脑缺血时基质金属蛋白酶9表达增高,胡黄连苷Ⅱ可以通过抑制缺血后脑组织基质金属蛋白酶9的表达,降低血脑屏障基底膜细胞外基质的降解及血脑屏障的通透性,减轻脑水肿程度和炎性损伤[28]。
抑制环氧合酶2(COX2) 正常情况下,环氧合酶2可能与兴奋性氨基酸受体密度高有关,主要在谷氨酸兴奋的神经元表达,脑缺血损伤后神经元COX2表达显著增强,选择性COX2抑制剂对局灶性脑缺血小鼠具有神经保护作用[29],胡黄连苷Ⅱ可显著降低动物血清COX2含量[30]。
胡黄连苷Ⅱ能抑制脑缺血损伤后半胱天冬酶-3(Caspase-3)表达,减少其底物多聚腺苷酸二磷酸核糖聚合酶的降解,抑制脑缺血/再灌注损伤诱导的细胞凋亡,这可能有利于维持半暗带细胞内辅酶Ⅰ的水平,使PARP能利用残存的能量修复可逆性神经元的损伤,从而改善动物的神经行为功能[24]。
核转录因子(nuclear transcription factor kappa B,NF-κB)与炎症反应、免疫反应以及细胞的增殖、分化和凋亡等密切相关。存在于神经元、胶质细胞和脑血管内皮细胞等几乎所有细胞,并能与其他细胞基因启动子或增强子序列发生特异性结合而促进其转录和表达。内源性抑制蛋白(I-κB)是NF-κB的抑制物,通过抑制NF-κB的活性参与机体的炎症反应、免疫应答、细胞增生和凋亡等病理过程。胡黄连苷Ⅱ可能通过抑制NF-κB的磷酸化和降解,下调内源性抑制蛋白的表达及其激活靶基因作用,从而抑制炎症反应诱导的细胞凋亡,对脑缺血、再灌注损伤发挥一定的保护作用[31]。
胡黄连苷Ⅱ可通过减轻H2O2诱导的肾上腺嗜铬细胞瘤细胞12 细胞损伤[12-13,32-34],抑制细胞线粒体膜电位的降低[34],从而提高细胞存活率。胡黄连苷Ⅱ能通过调节诱导型一氧化氮合酶、超氧化物歧化酶和天冬氨酸特异性半胱氨酸蛋白酶-9(Caspase-9)的表达,抑制脑缺血再灌注损伤引起的细胞凋亡[11-12]。受到氧化应激损伤时,神经元激活诱导型一氧化氮合酶并使其高表达,产生大量的NO后对神经细胞造成严重的损伤。胡黄连苷Ⅱ通过多种途径降低脑缺血-再灌注神经细胞诱导型一氧化氮合酶表达,降低NO产生,抑制氧化应激反应诱导的细胞凋亡,从而对脑缺血-再灌注损伤发挥一定的保护作用[35-36]。
脑缺血大鼠脑脊液脑缺血后神经元特异性烯醇化酶浓度与梗死面积呈正相关。神经胶质细胞标志蛋白是一种酸性钙结合蛋白,细胞间存在大量神经胶质细胞标志蛋白时,可促进炎症反应因子表达并引起神经元凋亡。髓磷脂碱蛋白水平变化可以反映髓鞘损伤的程度,缺乏MBP时将导致髓鞘形成障碍。脑缺血后神经元特异性烯醇化酶和神经胶质细胞标志蛋白表达增强,并透过损伤的血脑屏障进入血液。经胡黄连苷Ⅱ治疗后,大鼠脑组织MBP含量较模型升高,而NSE和S100B含量较模型组显著降低,提示胡黄连苷Ⅱ对缺血脑组织和血脑屏障有一定的保护作用[37-38]。
胡黄连苷Ⅱ还可以通过增强内源性抗氧化酶的活性、清除体内过量的氧自由基,保护脑组织免受氧化损伤[39]。
1.3 肾缺血再灌注损伤的影响 胡黄连苷Ⅱ通过减少氧自由基的产生,减少肿瘤坏死因子相关受体6(TRAF6)的表达,减少细胞凋亡数,发挥减轻肾缺血再灌注损伤的作用。研究表明对肾缺血再灌注(I/R)损伤损伤具有抗氧化应激保护作用,与剂量大小有一定关系[40]。
1.4 心脏缺血再灌注损伤的影响 胡黄连苷Ⅱ能减轻心肌缺血再灌注损伤,其心肌保护作用机制可能与胡黄连苷Ⅱ提高机体抗氧化应激损伤的能力有关。胡黄连苷Ⅱ可抑制caspase-3活化,激活磷脂酰肌醇3-激酶/蛋白激酶反应结合蛋白信号通路,调配Bcl-2和Bax基因表达[41]。研究表明加快心率,提高左心室发展压,和左心室内压最大上升及下降速率,缩小心肌梗死范围,提高超氧化物歧化酶的活性,降低丙二醛含量[42]。
1.5 改善抑郁的作用 胡黄连苷Ⅱ通过拮抗下丘脑-垂体-肾上腺轴功能亢进,从而改善抑郁症状,发挥一定的抗抑郁作用。相关研究表明,胡黄连苷Ⅱ具有缓解抑郁模型行为学损伤的作用,可显著降低大鼠血浆中促肾上腺皮质激素和皮质酮的含量,可显著降低抑郁模型大鼠强迫游泳的不动时间[43]。
1.6 抗炎、平喘作用 胡黄连苷Ⅱ能减轻哮喘大鼠肺组织中炎细胞浸润程度,降低哮喘大鼠气道阻力和提高肺顺应性,减轻气道炎症,抑制支气管收缩,对哮喘大鼠有抗炎平喘作用。可以明显延长诱喘潜伏期、减轻哮喘症状,对整体动物引喘有保护作用[44]。并可以抑制哮喘大鼠气道局部炎症反应,改善气道局部和全身的Th亚群失衡[45-46]。
另一项研究结果表明,使用胡黄连苷Ⅱ大鼠诱喘潜伏期明显延长(P<0.01),诱喘反应减轻;基础呼气阻力降低(P<0.05);肺顺应性升高(P<0.05);支气管肺泡灌洗液中细胞总数和血管周围外周血嗜酸粒细胞计数明显减少(P<0.01);外周血EOS计数显著降低(P<0.01);血清及BALF上清中IFN-γ的水平显著升高(P<0.01),IL-4的水平显著降低(P<0.01);支气管壁炎性细胞浸润减少,支气管壁及EOS浸润明显减少[45-46]。
2 对肝微粒体CYP450酶的相互作用
胡黄连苷Ⅱ能抑制大鼠CYP2C19、2D6和2E1的活性,轻度诱导CYP2C9,对CYP1A2和3A4没有显著影响。胡黄连苷Ⅱ对CYP450具有一定的调节作用,应注意药物一药物相互作用的潜在可能性[47]。另一项研究表明,胡黄连苷Ⅱ对大鼠P450酶系中的CYP2C19有抑制活性,并且与给药次数有相关性,单次给药(10mg/kg)对P450活性几乎没有影响,而多次给药(10mg/kg,口服,一天2次,连续12天)对CYP2C19有显著抑制作用[48]。
3 体内代谢动力学研究
胡黄连苷Ⅱ亲水性较强,胃肠道吸收少,而且在胃肠道中容易水解,导致口服生物利用度低[49-54]。约不到20%的原型从胆汁和尿液中排泄,主要以葡萄糖酸苷和硫酸盐络合物形式代谢[55]。
大鼠静脉注射后,在体内可快速分布于血液中,消除迅速,在体内滞留时间短、不易蓄积。在大鼠体内的药物动力学行为均符合二室开放模型,T1/2β为(0.63±0.25)h,AUC0-t为(16 221.01±562.50)μg·h/L,清除速率为(1.67±0.02)L/(h·kg),平均滞留时间为(0.51±0.03)h[56]。
另一项研究显示,静注给予2.5、5.0、10.0mg/kg后,大鼠体内胡黄连苷Ⅱ浓度快速降低,平均消除半衰期仅为19.6 min。AUC与剂量呈现良好的线性相关性,提示胡黄连苷Ⅱ在大鼠体内的处置属于线性动力学。组织分布广泛,可分布于肾、肝、脾、血浆、子宫、皮肤、胃、肺、肌肉、脂肪等组织,心、肠、睾丸和脑组织也有少量药物存在。其中以肾脏和肝脏的分布最多,表明这两个器官可能为胡黄连苷Ⅱ的主要排泄器官,主要通过尿液和胆汁排泄,在尿液中的平均累积排泄百分率为11.79%;胆汁中平均累积排泄百分率为7.80%;粪便中未检测出胡黄连苷Ⅱ。胡黄连苷Ⅱ平均血浆蛋白结合率为30.0%[57]。
另一项研究显示,狗静脉注射5,10,20mg/kg药物后,药-时曲线符合二室模型,消除半衰期t1/2β分别为(27.8±5.1),(29.2±3.7)和(28.4±5.0)mg/kg。消除半衰期(t1/2β)、平均滞留时间(MRT0-∞)、清除率(Cl)、稳态评价分布体积(Vd)均和剂量无关[58]。
4 小结
胡黄连苷Ⅱ是从胡黄连中分离得到的7种环烯醚萜类化合物中含量最高的,为胡黄连主要有效成分。胡黄连苷Ⅱ药理作用确切,研究显示,有保护肝脏损伤、抗氧化、抗哮喘、保护神经等功效,值得作为一种潜在药物加以研究开发。
[1]王宁,刘汉清.胡黄连苷Ⅱ解离常数的的测定[J].西北药学杂志,2012,27(3):218-220.
[2]顾伟,范听建.胡黄连苷Ⅱ对H2O2损伤L-02细胞的保护作用[J].世界华人消化杂志,2008,16(29):3274-3278.
[3]Gao H,Zhou YW.Inhibitory effect of picroside II on hepatocyte apoptosis.Acta Pharmacol Sin,2005,26:729-736.
[5]Hua G,Ya WZ.Anti-lipid peroxidation and protection of liver mitochondria against injuries by picroside II[J].World J Gastroenterol,2005,11(24):3671-3674.
[6]高华,周亚伟.胡黄连苷Ⅱ抗脂质过氧化作用及对肝细胞线粒体损伤保护作用的研究[J].2014年第三届环境与职业医学国际学术研讨会论文集[C].2004,300-303.
[7]李晓丹,赵丽,郭云良,等.胡黄连苷Ⅱ对脑缺血损伤后血清自由基水平和抗氧化酶活性的影响[J].中华中医药学刊,2014,32(7):1617-1620.
[8]郭明川,曹艳,刘建文.胡黄连苷Ⅱ在谷氨酸诱导的PC12细胞损伤中的保护作用[J].中国临床药理学与治疗学,2007,12(4):440-443.
[9]Li P,Kimihiro M.Nerve growth factor potentiating compounds from rhitzoma[J].Biol Pharm Bull,2000,23(7):890-892.
[10]赵多明,张梓倩.胡黄连苷Ⅱ对脑缺血再灌注大鼠神经损伤的保护作用研究[J].国际药学研究杂志,2010,37(6):46l-468.
[11]Sun L,Li XD.The Anti-oxidant effect and the possible mechanism of picorsideⅡin cerebral ischemia[J].Neural Regen Res,2011,6(15):1141-1146.
[12]Li P,Matsunaga K.PicrosidesⅠand Ⅱ,selective enhancers of the mitogen-activated Protein kinase-dependent signaling pathway in the action[J].Life Sci,2002,71(15):1821-1835.
[13]陶移文,刘建文.胡黄连苷Ⅱ在体外对PC12细胞损伤的保护作用[J].中国临床药理学与治疗学,2003,8(1):27-30.
[14]李震,李琴.胡黄连苷Ⅱ对大鼠脑缺血再灌注损伤的干预作用[J].解剖学报,2010,41(l):9-12.
[15]Li Z,Xu XY.Protective mechanisms of picroside on AQP4 in rat model of MCAO/R[J].Neural Regen Res,2010,5(6):411-416.
[16]Li Q,Li Z.Neuroprotective properties of picroside II in rat model of focal cerebral ischemia[J].Int J Mol Sci,2010,11(11):4580-4590.
[17]张伟,银建军,杨建军,杜芳.胡黄连对缺血再灌注大鼠脑内NMDARlmRNA表达的影响[J].青岛大学医学院学报,2008,42(7):24-31.
[18]杨学伟,季旭明,郭云良,等.胡黄连对大鼠缺血脑组织神经营养因子的影响[J].青岛大学医学院学报,2008,44(1):69-71.
[19]李震.胡黄连苷Ⅱ对大鼠脑缺血再灌注损伤的干预机制[D].青岛大学,2010.
[20]赵丽,郭云良,李晓丹,等.胡黄连苷Ⅱ对脑缺血损伤后神经元特异性烯醇化酶表达的影响[J].中国药理学通报,2014,30(2):192-198.
[21]李红云,赵丽,宿希,等.胡黄连苷Ⅱ治疗脑缺血,再灌注损伤剂量和时间窗的初步探讨[J].中国药理学通报,2012,28(4):549-553.
[22]郭云良,沈卫,杜芳,等.胡黄连苷Ⅱ对大鼠脑缺血再灌注损伤后TLR4及NFκB表达的影响[J].中国中西医结合杂志,2011,31(1):58-61.
[23]李琴,郭云良,李震.胡黄连苷Ⅱ对大鼠脑缺血/再灌注损伤Caspase-3和PARP表达的影响[J].中国药理学通报,2010,26(3):342-345.
[24]Zheng L,Xin X,Qin L,etal.Protective mechanisms of picroside Ⅱon aquaporin-4 expression in a rat model of cerebral ischemia/reperfusion injury[J].Neural Regen Res,2010,5:411-417.
[25]敬乃鲁,李晓丹,赵丽,等.胡黄连苷Ⅱ对大鼠脑缺血损伤水通道蛋白4表达的影响[J].中国临床神经科学,2013,21(6):631-636.
[26]敬乃鲁,李晓丹,赵丽,等.胡黄连苷Ⅱ对大鼠脑缺血损伤AQP4、MMP9和COX2表达的影响[J].神经病学与神经康复学杂志,2013,10(3):158-161.
[27]赵丽,李晓丹,郭云良,等.胡黄连苷Ⅱ在大鼠脑缺血损伤中治疗剂量和时间窗的优化[J].中国脑血管病杂志,2013,10(7):373-378.
[28]Xiang L,Xin X,Zhen L,etal.Picroside Ⅱ down-regulates matrix metallo-proteinase-9 expression following cerebral ischemia/reperfusion injury in rats[J].Neural Regen Res,2010,5(18):1403-1407.
[29]Candelario-Jalil E,Fiebich BL.Cyclooxygenase inhibition in ischemic brain injury[J].Curr Pharm Des,2008,14(14):1401-1418.
[30]荣丽霞,张睿,赵丽,等.胡黄连苷Ⅱ治疗脑缺血的机制及最佳剂量和时间窗研究[J].临床医学工程,2013,20(10):1209-1211.
[31]李震,徐新颖,沈卫.胡黄连苷Ⅱ对大鼠脑缺血/再灌注损伤NF-κB和I-κB 的干预作用[J].中国药理学通报,2010,26(1):52-56.
[32]郭明川,曹艳,刘建文.胡黄连苷Ⅱ在谷氨酸诱导的PC12细胞损伤中的保护作用[J].中国临床药理学与治疗学,2007,12(4):440-443.
[33]Ping L,Kimihiro M,Tohru Y,etal.Potentiation of nerve growth factoraction by picrosides I and II,natural iridoids,in PC12D cells[J].European Journal of Pharmacology,2000,406:203-208.
[34]Jian WL,You Y,Pei YZ,etal.Synergistic protective effect of picroside II and NGF on PC12 cells against oxidative stress induced by H2O2[J].Pharmacological Reports,2007,59:573-579.
[35]李玲,房雷,孙丽,等.胡黄连苷Ⅱ对脑缺血-再灌注损伤后iNOS蛋白及mRNA表达的影响[J].脑与神经疾病杂志,2013,21(3):209-212.
[36]逄芳芳,张美增,张睿,等.胡黄连苷Ⅱ在大鼠脑缺血损伤中的抗氧化作用及其最佳治疗剂量和时间窗[J].中国中医药信息杂志,2013(11):40-43.
[37]王粤,宿希,逄芳芳,等.胡黄连苷Ⅱ对大鼠缺血脑组织神经元特异性烯醇化酶、S100B和髓鞘碱性蛋白表达的影响[J].中国临床神经科学,21(5):485-490.
[38]Li Z,Yun LG,Xiao JJ,etal.The neuroprotective effect of picroside II via regulating the expression of myelin basic protein after cerebral ischemia injury in rats[J].BMC Neuroscience,2014,15:25-34.
[39]李晓丹,王连庆,林荣海.胡黄连苷Ⅱ对脑缺血损伤大鼠抗氧化作用的时间窗及剂量选择[J].中国中医药科技,2014,21(1):33-36.
[40]许瑞瑞,张月月,徐岩.胡黄连苷Ⅱ对大鼠肾缺血再灌注损伤的保护作用[J].山东医药,2013,53(36):7-10.
[41]Fan JM,Su MJ,Bo Y.Picroside II protects cardiomyocytes from hypoxia/reoxygenation-induced apoptosis by activating the PI3K/Akt and CREB pathways[J].International journal of molecular medicular medicine,2012,30:263-270.
[42]吴楠,李雯娜,吕岩,等.胡黄连苷Ⅱ预处理对大鼠离体心脏缺血再灌注的影响[J].医学研究杂志,2013,42(12):46-49.
[43]周俊华,熊哲.胡黄连苷Ⅱ对慢性应激抑郁大鼠的治疗作用及其机制[J].医药导报,2011,30(12):1549-1551.
[44]何薇,林江涛.胡黄连苷Ⅱ对哮喘大鼠的抗炎平喘作用[J].中日友好医院学报,2005,19(2):233-235.
[45]何薇,林江涛.胡黄连苷Ⅱ对支气管哮喘大鼠气道炎症和支气管收缩反应影响的研究[J].中华医学会第五次全国哮喘学术会议暨中国哮喘联盟第一次大会论文汇编[C],2006,138-139.
[46]何薇,林江涛.胡黄连苷Ⅱ对支气管哮喘大鼠气道炎症和支气管收缩反应影响的研究[J].中华医学会第七次全国呼吸病学术会议暨学习班论文汇编[C],2006,363.
[47]李婷婷,陈西敬.胡黄连苷Ⅱ对大鼠肝微粒体CYP450酶的相互作用研究[J].第九届全国药物和化学异物代谢学术会议论文集[C],2009,225.
[48]Xiao YJ,Jiang ZZ,Yao JC,etal.Investigation of Picroside II's Impacts on the P450 Activities Using a Cocktail Method[J].Chinese Journal of Natural Medicines,2008,6(4):0292-0297.
[49]Hattori M,Kawata Y,Inoue K,etal.Transformation of aucubin to new pyridine monoterpene alkaloids,aucubinines A and B,by human intestinal bacteria[J].Phytother Res,1990,4:66-70.
[50]Wang CH,Cheng XM,He YQ,etal.Pharmacokinetic behavior of gentiopicroside from decoction of Radix Gentianae,Gentiana macrophylla after oral administration in rats:a pharmacokinetic comparison with gentiopicroside after oral and intravenous administration alone[J].Arch Pharm Res,2007,30:1149-1154.
[51]Wang CH,Wang ZT,Bligh SW,etal.Pharmacokinetics and tissue distribution of gentiopicroside following oral and intravenous administration in mice[J].Eur J Drug Metab Pharmacokinet,2004,29(3):199-203.
[52]Sun Y,Feng F,Yu X.Pharmacokinetics of geniposide in Zhi-Zi-Hou-Pu decoction and in different combinations of its constituent herbs[J].Phytother Res,2012,26:67-72.
[53]Park EJ,Lee HS,Ou SR,etal.Pharmacokinetics of verproside after intravenous and oral administration in rats[J].Arch Pharm Res,2009,32:559-564.
[54]Li HL,He JC,Bai M,et al.Determination of the plasma pharmacokinetic and tissue distributions of swertiamarin in rats by liquid chromatography with tandem mass spectrometry[J].Arzneimittelforschung,2012,62:138-144.
[55]Dilawar U,Ranjeet PD,Sheetal A,etal.Comparative pharmacokinetic profiles of picrosides I and II from kutkin,Picrorhiza kurroa extract and its formulation in rats[J].Fitoterapia,2013,85:76-83.
[56]张卫平,孙小成,王静,等.胡黄连苷Ⅰ和胡黄连苷Ⅱ在大鼠体内的药物动力学[J].沈阳药科大学学报,2013,30(9):724-728.
[57]俞巧玲,陈西敬,任伟超.胡黄连苷Ⅱ在大鼠体内的药代动力学[J].中国天然药物,2008,6(5):382-386.
[58]Fu CY,Shi LY,Li ZX.Determination of picroside II in dog plasma by HPLC and its application in a pharmacokinetics study[J].Biomed.Chromatogr,2005,19:279-284.
