金属-N-杂环卡宾催化前手性酮的硅氢化反应研究
2014-11-17李争宁
姜 岚,李争宁
(大连大学 环境与化学工程学院,辽宁 大连116622)
1 引言
硅氢化反应是硅氢化合物与不饱和键包括碳氧双键,碳氮双键,碳碳双键以及碳碳叁键等,在催化剂的诱导下进行加成反应,生成有机硅化合物。产物水解后,可生成醇、胺等化合物。利用手性催化剂催化前手性酮的硅氢化反应,是一类重要的合成手性醇的方法,反应通式如图1。其中手性醇是合成许多手性药物或手性化合物的重要有机中间体。如抗抑郁药物R-托莫西汀、S-氟西汀,抗哮喘药物R-沙丁胺醇、L-氯丙那林等。与催化加氢合成手性醇反应相比,硅氢化反应条件温和,无需高压条件,而且硅氢化合物化学性质相对比较稳定,易于使用和贮存。因此,从20世纪的60、70年代至今,一直受到研究者的关注。研究者对硅氢化反应高效、高选择性的催化剂的合成与研究,至今方兴未艾。
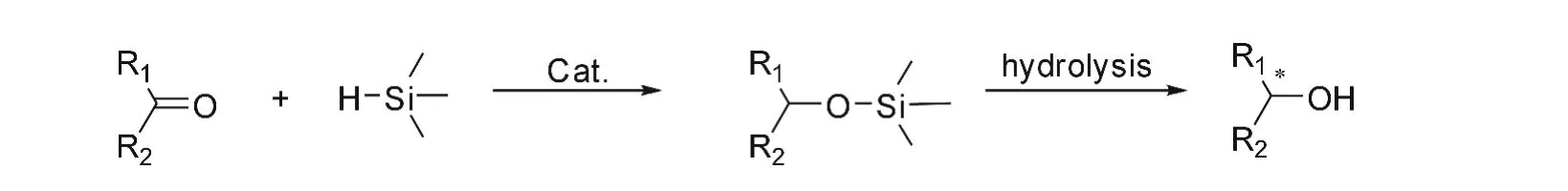
图1 酮与硅氢试剂的硅氢化反应通式
20世纪80年代,Brunner[1]研究小组首先报道合成了手性噻唑啉类配体1,其催化的硅氢化反应ee值首次达到了90%以上,对不同酮底物有很强的适应性。由此,结构不同的手性配体尤其是一些双齿膦配体等被不断被设计、合成出来,表现出很强的催化活性和立体选择性。如图2中化合物1-4为典型的硅氢化反应双齿配体。

图2 典型的硅氢化反应双齿配体
近年来,N-杂环卡宾(NHC)配体作为一种新型仿膦配体应用到多种均相催化反应中。NHC配体具有更高的稳定性和更好的给电子能力。结构多变,电子效应和空间效应易调控。目前已有研究发现多种金属如Rh[2,3,4],Ru[5],Ir[6],Cu[7,8],Pt[9],Ni[10],Ag[11]等均 可 参与催化硅氢化反应,其中金属Rh应用最广泛。许多手性NHC-金属催化剂的底物范围适应性广泛,能高效催化芳香酮和脂肪酮以及杂环芳香酮的硅氢化反应,日益成为一类不可替代的手性催化剂。鉴于硅氢化反应合成手性醇反应的重要性,本文将根据NHC的结构分类综述此类反应在近几年的应用。
2 金属-单齿NHC催化的硅氢化反应
1996年,Herrmann[12]小组合成了具有 C2对称性的Rh配合物5,首次报道了Rh-手性NHC催化的不对称硅氢化反应,反应式如图3。该反应具有高度的催化性能,但是产物的立体选择性不高,ee值最高为32%。作者认为原因可能是因为配体咪唑环的手性侧链会绕着C-N键快速的旋转,造成配位金属周围的手性环境难以固定。最近,该小组采用位阻更大的Rh-配合物6,在-20℃下催化丙酮酸丙酯的硅氢化反应,转化率最高达98%,ee值最高可达74%[13]。

图3 Rh-NHC化合物5和6催化的酮硅氢化反应
2005年,Ma和Andrus[14]等人合成了具有平面手性的基于[2.2]环仿化合物的NHC前体咪唑盐7,与RuCl2(PPh3)3可在室温下高选择性的催化芳酮的手性硅氢化反应,产物光学活性93%~97%ee,产率80~98%,反应式如图4。同时作者还提出了硅氢化反应可能的机理。

图4 Rh-NHC化合物7催化的酮硅氢化反应
自从 Nolan小组[15,16]开创了 Cu-NHC催化酮的硅氢化反应的先河,以IProHBF4、IMes·HCl、SIMes·HBF4、ICy·HBF4等咪唑盐为前体,催化芳香酮和脂肪酮的硅氢化反应。2011年,Gawley[17]等人将具有C2对称性、手性Cu-NHC配合物8引入到酮的硅氢化反应中。催化剂表现出很高的活性,不同底物的收率均较高,尤其是类似2-丁酮等更具挑战性的二烷基前手性酮底物,er(S/R)值最高达99∶1,是迄今该类底物硅氢化反应或氢化反应合成手性醇的最高结果,反应式如图5所示。甚至在较低的催化剂用量下(2mol%),仍然可以在室温下1h内完成反应。

图5 Cu-NHC化合物8催化的酮硅氢化反应
2012年,Sakaguchi[18]小组合成了Ir-苯并咪唑型NHC配体9,用于催化芳酮的硅氢化反应制备手性醇,反应式如图6。研究发现反应可在THF中室温条件下顺利进行,采用硅氧烷(EtO)2MeSiH作为硅氢试剂,ee%值仅为12%,而加入4mol%AgBF4后,反应收率和ee%值有大幅度提升。当改变反应溶剂为2-甲基四氢呋喃后,ee%值达到了令人满意的92%。反应对于不同结构的底物具有较好的适用性,对映体选择性达79%~91%。

图6 Cu-NHC化合物9催化的酮硅氢化反应
3 金属-双齿NHC催化的硅氢化反应
在双齿NHC配体的结构中,除了NHC与金属配位以外,一般还具有O、N等其他含有孤对电子的原子与金属配位,这一类金属配合物在催化反应时,一般能得到更高的立体选择性的结果。
Gade等人[2]合成的氮杂环联有噁唑啉取代基的咪唑盐10合成其Rh配合物11,该催化剂催化芳基甲基酮的硅氢化反应得到了产率90%~99%,光学纯度91%的结果,反应式如图7。对于烷基酮底物,对映体选择性达到79%~95%。研究发现,从20℃降低温度至-60℃,可将ee值由65%提高至90%,但是反应时间延长。
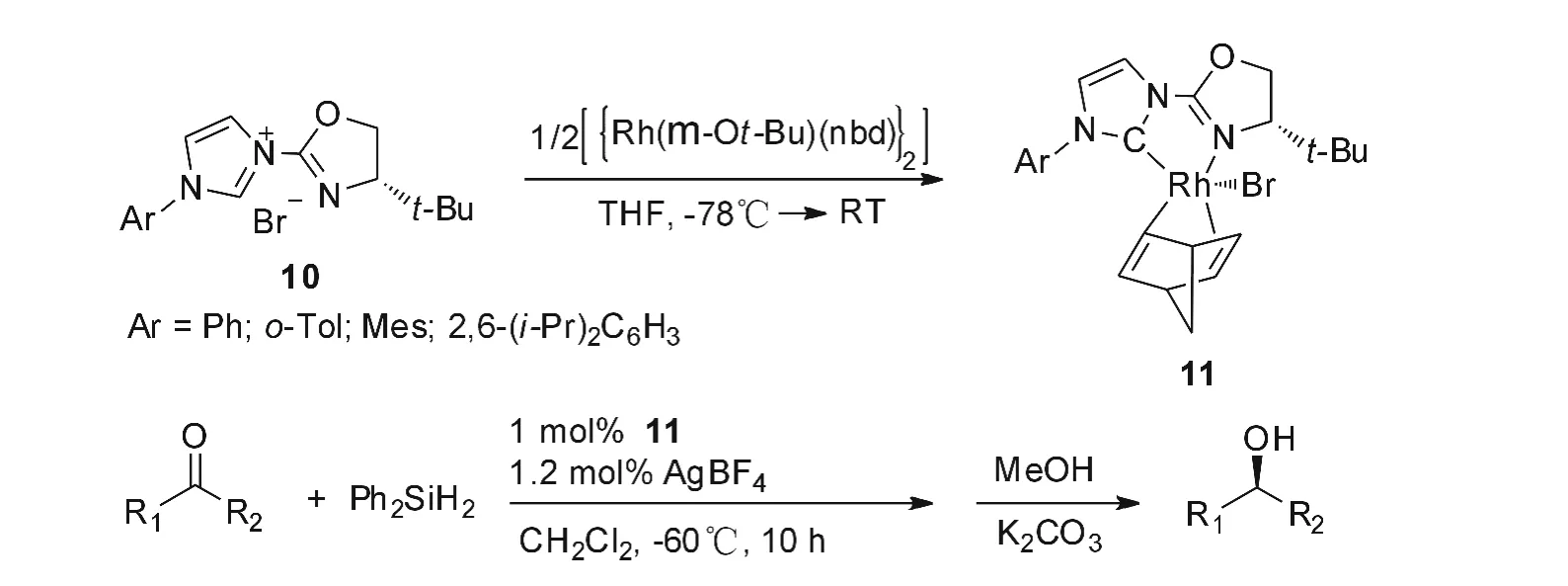
图7 Rh-NHC化合物11催化的酮硅氢化反应
上海有机所施敏的研究小组一直致力于研究NHC在均相催化方面的应用。2003年,该小组从(S)-BINAM出发,合成了具有轴手性联萘骨架的苯并咪唑型NHC-铑的金属配合物12,用以催化前手性酮与还原剂Ph2SiH2的硅氢化反应。反应有较好的收率(82~96%)和令人满意的对映体选择性(67%~98%ee),反应式如图8[19]。将该催化剂和具有轴手性的H8-联萘骨架化合物13催化芳基β-酮酸酯的硅氢化反应,反应可以选择性还原底物中的酮羰基,而酯羰基的不发生硅氢化反应[20]。产物的收率和光学活性均很高。与该类催化剂结构相似的联苯型Rh配合物14也被应用于催化此类反应,室温下反应48h,收到了良好的催化效果,3-氯苯乙酮硅氢化反应的手性醇产物ee值达到了98%[21]。
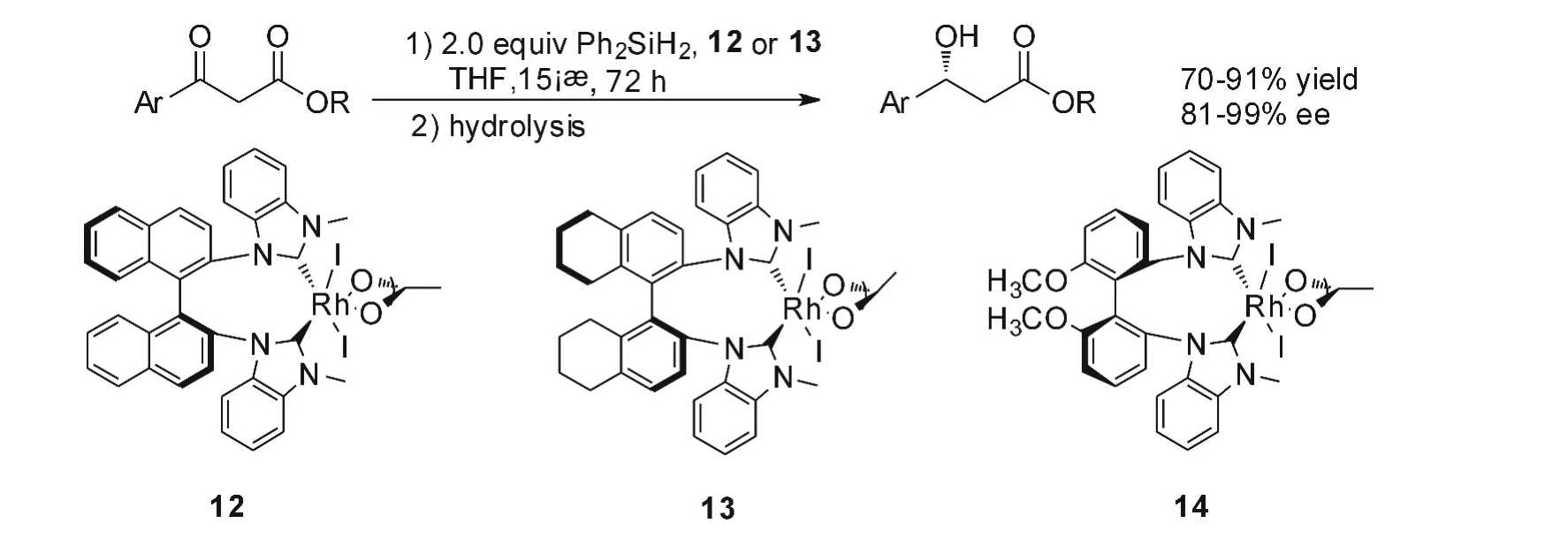
图8 Rh-NHC化合物12-14催化的酮硅氢化反应
此外,还有如图9所示 Bolm[22]等合成的15,Faller[23]的16以及 Crabtree[24]的17等催化剂,也可以在温和的条件下高产率催化硅氢化反应,但是只收到了低或中等的立体选择性。

图9 几种催化酮硅氢化反应的NHC前体及其配合物15-17
4 结语
众多的研究结果表明,NHC-金属配合物催化前手性酮的不对称硅氢化反应是一种越来越重要的合成手性醇类化合物的方法。随着研究的深入,将会有更多结构更加新颖的高效催化剂被合成出来。从文献报道内容中可大致归纳今后主要研究方向,包括:①由贵金属Rh催化的硅氢化反应逐渐变为Cu、Ni、Fe等非贵金属催化;②双齿或多齿的NHC配体能够与金属形成更稳定的金属配合物,如许多与NHC配体联接噁唑啉等手性诱导单元都取得了相当不错的结果,因此,开发新型的双齿或多齿配体是今后的研究工作的重要内容;③催化剂的回收和再利用问题。
[1]Brunner H,Becker R,Riepl G.Asymmetric syntheses.20.Enantioselective hydrosilylation of ketones with[Rh(COD)Cl]2/thiazolidine catalysts[J].Organometallics,1984(3):1354~1359.
[2]Gade L H,César V,Bellemin-Laponnaz S.A modular assembly of chiral oxazolinylcarbene-rhodium complexes:efficient phosphane-free catalysts for the asymmetric hydrosilylation of dialkyl ketones[J].Angew.Chem.Int.Ed,2004(43):1014-1017.
[3]Ohta H,Fujihara T,Tsuji Y.N-Heterocyclic carbene ligands bearing hydrophilic and/or hydrophobic chains:Rh(I)and Pd(II)complexes and their catalytic activity[J].Dalton Trans,2008(6):379~385.
[4]Schneider N,Kruck M,Bellemin-Laponnaz S,et al.Chiral oxazoline-NHC ligands with and without CR2bridges:a comparative study in rhodium hydrosilylation catalysis [J].Eur.J.Inorg.Chem,2009(11):493~500.
[5]Song C,Ma C,Ma Y,et al.Bis-paracyclophane N-heterocyclic carbene-ruthenium catalyzed asymmetric ketone hydrosilylation[J].Tetrahedron Lett,2005(46):3241~3244.
[6]Zanardi A,Peris E,Mata J A.Alkenyl-functionalized NHC iridium-based catalysts for hydrosilylation [J].New J.Chem,2008(32):120~126.
[7]Kaur H,Zinn F K,Stevens E D,et al.(NHC)CuI(NHC= N-heterocyclic carbene)complexes as efficient catalysts for the reduction of carbonyl compounds[J].Organometallics,2004(23):1157~1160.
[8]Díez-gonzález S,Kaur H,Zinn F K,et al.A simple and efficient copper-catalyzed procedure for the hydrosilylation of hindered and functionalized ketones[J].J.Org.Chem,2005(70):4784~4796.
[9]Buchan Z A,Bader S J,Montgomery J.Ketone hydrosilylation with sugar silanes followed by intramolecular aglycone delivery:an orthogonal glycosylation strategy[J].Angew.Chem.Int.Ed,2009(48):4840~4844.
[10]Buchan Z A,Bader S J,Montgomery J.Ketone hydrosilylation with sugar silanes followed by intramolecular aglycone delivery:an orthogonal glycosylation strategy[J].Angew.Chem.Int.Ed,2009(48):4840~4844.
[11]Wile B M,Stradiotto M.Silver-catalyzed hydrosilylation of aldehydes[J].Chem.Commun,2006(7):4104~4106.
[12]Herrmann W A,Goossen L J,Kocher C,et al.Chiral heterocylic carbenes in asymmetric homogeneous catalysis [J].Angew.Chem.Int.Ed.Engl,1996,35(23~24):2805~2807.
[13]Steinbeck M,Frey G D,Schoeller W W,et al.Synthesis and characterization of chiral mono N-heterocyclic carbene-substituted rhodium complexes and their catalytic properties in hydrosilylation reactions [J].J.Organomet.Chem,2011(696):3945~3954.
[14]Song C,Ma C,Ma Y,et al.Bis-paracyclophane N-heterocyclic carbene-ruthenium catalyzed asymmetric ketone hydrosilylation[J].Tetrahedron Lett,2005(46):3241~3244.
[15]Kaur H,Zinn F K,Stevens E D,et al.(NHC)CuI(NHC= NHeterocyclic Carbene)complexes as efficient catalysts for the reduction of carbonyl compounds[J].Organometallics,2004(23):1157~1160.
[16]Díez-González S,Kaur H,Zinn F K,et al.A simple and efficient copper-catalyzed procedure for the hydrosilylation of hindered and functionalized ketones[J].J.Org.Chem,2005(70):4784~4796.
[17]Albright A,Gawley R E.Application of a C2-symmetric copper carbenoid in the enantioselective hydrosilylation of dialkyl and aryl-alkyl ketones[J].J.Am.Chem.Soc,2011(133):19680~19683.
[18]Kawabata S,Tokura H,Chiyojima H,et al.Asymmetric hydrosilane reduction of ketones catalyzed by aniridium complex bearing a hydroxyamide-functionalized NHC ligand.Adv.Synth.Catal,2012(354):807~812.
[19]Duan W L,Shi M,Rong G B.Synthesis of novel axially chiral Rh-NHC complexes derived from BINAM and application in the enantioselective hydrosilylation of methyl ketones [J].Chem.Commun,2003(8):2916~2917.
[20]Xu Q,Gu X,Liu S,et al.The use of chiral BINAM NHC-Rh(Ⅲ)complexes in enantioselective hydrosilylation of 3-oxo-3-arylpropionic acid methyl or ethyl esters[J].J.Org.Chem,2007(72):2240~2242.
[21]Liu L,Wang F,Shi M.Synthesis of chiral bis(N-heterocyclic carbene)palladium and rhodium complexes with 1,10-biphenyl scaffold and their application in asymmetric catalysis[J].Organometallics,2009(28):4416~4420.
[22]Yuan Y,Raabe G,Bolm C.Novel rhodium complexes with ferrocene-based N-heterocylic carbenes:synthesis,structure and catalysis[J].J.Organomet.Chem,2005(690):5747~5752.
[23]Faller J W,Fontaine P P.Stereodynamics and asymmetric hydrosilylation with chiral rhodium complexes containing a monodentate N-heterocyclic carbene[J].Organometallics,2006(25):5887~5893.
[24]Chianese A R,Crabtree R H.Axially chiral bidentate N-heterocyclic carbene ligands derived from BINAM:rhodium and iridium complexes in asymmetric ketone hydrosilylation[J].Organometallics,2005(24):4432~4436.
