ET-1、CGRP在颅底肿瘤术后并发脑血管痉挛的水平变化及意义
2014-11-15陈俊武张振玖
陈俊武 张振玖
海南昌江黎族自治县人民医院内科 昌江 572700
颅底肿瘤术后并发脑血管痉挛是临床常见症状,主要是由于颅脑损伤造成患者蛛网膜下腔(自发性)出血引发痉挛威胁患者生命,临床中也称之为CVS。目前国内外对于颅底肿瘤术后并发CVS的研究都有待进一步深入,有不少临床研究资料表明ET-1(血浆内皮素-1)与CGRP(降钙素基因相关肽)的水平变化与CVS症状的发生有密切关系[1]。为更好提升颅底肿瘤手术患者的预后,提升其存活率降低并发症发生率与危险性,加强CVS相关方面的研究对临床治疗与实践有积极意义。选取2007-03—2012-04在我院进行治疗的颅底肿瘤手术患者40例为研究对象,并回顾性分析,现报告如下。
1 材料与方法
1.1一般资料选取2007-03—2012-04在我院进行治疗的颅底肿瘤手术患者40例为研究对象并回顾性分析,纳入研究患者均经临床确诊且排除不良影响因素(高血压、糖尿病、动脉硬化、肝肾功能异常等),签署同意书。研究组40例患者中男23例,女17例,年龄16~69岁,平均(45.2±5.1)岁,肿瘤部位分别集中在嗅沟、小脑桥脑脚区、鞍区、枕骨大孔区等。患者肿瘤病理学诊断结果显示:脑膜瘤10例,胆质瘤8例,脊索瘤1例,垂体腺瘤7例,髓母细胞瘤2例,听神经瘤6例,副神经鞘瘤1例,三叉神经鞘瘤2例,颅咽管瘤3例。所有患者均实施全麻行开颅手术,无死亡患者。术后患者临床症状表现以精神症状、意识障碍和视野缺损为主,共6例。同期选取在我院进行健康体检者20例为对照组,男10例,女10例,年龄20~48岁,平均(26.3±4.2)岁。
1.2分组40例患者临床症状表现和术后血管造影结果分为3组,分别为症状性痉挛组、无症状痉挛组与非痉挛组。TCD检查按Seiler-Aaslid标准显示大脑中动脉平均血流速度(VMCA)>120cm/s,即症状性血管痉挛的患者出现迟发性的神经损害表现,痉挛指数>3;没有迟发性神经损害表现有血管痉挛者为无症状性脑血管痉挛组;非痉挛组痉挛指数<3、VMCA<120cm/s[2]。症状性痉挛组9例,无症状痉挛组14例,非痉挛组17例。
1.3观察检测患者TCD动态监测选择迈瑞EXPORT 6.0及西门子凤凰彩色多普勒超声诊断仪,探头频率为5~9 MHz,选择患者同一颞窗,取样深度为5~6cm。动态监测分别于患者手术前一天和术后第1、3、5、7、14天进行。ET-1检测:所有患者在术后第1、3、5、7、14天清晨均采集空腹静脉血5mL,加入30μL EDT A-Na2(11g/L)和40μL抑肽酶摇匀在离心机中放置10min,转速3 000转/min,温度为4℃,在分离取出血浆之后进行保存。ET-1和CGRP的测定由本院同位素科进行,测定方法严格按照金山制药厂出品的试剂盒说明书进行操作。对照组健康受检者则在医院门诊期间进行一次TCD检查和ET-1检测。
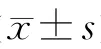
2 结果
3组患者并发脑血管痉挛情况:症状性痉挛组9例患者第1天均未出现痉挛,3例3~7d内出现,其余6例7~14d内出现;无症状性痉挛组14例患者第1天3例出现痉挛,5例3~7d内出现,其余7例7~14d内出现;非痉挛组17例患者均未出现痉挛症状。
2组患者ET-1、CGRP、痉挛指数水平动态变化比较情况见表1。研究组患者在术后第1天内ET-1开始呈现升高趋势,在第5~7天时达到峰值,此后开始下降直到第14天;研究组CGRP水平在术后第1天变化较小,在第2~7天呈现下降趋势,第7天为最低值,此后开始上升,在第14天时接近正常水平。与对照组相比,研究组患者在第3、5、7、14天时三种数据均具有显著差异,具有统计学意义(P<0.05)。见表1。
症状性痉挛组、无症状痉挛组、非痉挛组3组患者不同时间段血浆内ET-1含量和CGRP含量比较情况见表2与表3。在第1天内其与正常对照组无明显差异(P>0.05),但是在第3天开始开始呈现上升趋势,尤其是症状性痉挛组、无症状痉挛组较为明显,说明痉挛组水平ET-1含量上升水平高于非痉挛组,差异具有统计学意义(P<0.05),其中症状性痉挛组上升水平最高,三组上升期均集中在第3~7天,在第7~14天以下降趋势为主,但仍均高于正常水平,差异仍具有统计学意义(P<0.05)。
从表3来看,在第1天内其与正常对照组无明显差异(P>0.05),但是在第3天开始开始呈现下降趋势,尤其是症状性痉挛组、无症状痉挛组较为明显,说明痉挛组水平CGRP含量下降水平高于非痉挛组,差异具有统计学意义(P<0.05),其中症状性痉挛组下降水平最高,三组下降期均集中在第3~7天,第7天时各组均到达最低点,在第7~14天以上升趋势为主,但仍均低于正常水平,差异仍具有统计学意义(P<0.05)。
颅底肿瘤术后7d内患者ET-1水平的上升与患者并发脑血管痉挛之间的关系为正相关(P=0.003,r=0.563);术后7d内CGRP水平的降低与并发脑血管痉挛之间的关系为负相关(P=0.02,r=-0.482)。
表1 2组患者痉挛指数、ET-1、CGRP水平动态变化比较情况 (s,ng/L)

表1 2组患者痉挛指数、ET-1、CGRP水平动态变化比较情况 (s,ng/L)
注:与对照组相比,*P<0.05
1d 3d 5d 7d 14d ET-1 45.45±8.09 47.02±12.98 63.14±15.09* 70.01±18.12* 68.24±17.42* 63.37±14.63项目 对照组(n=20)研究组(n=40)*CGRP 30.52±7.76 30.62±5.89 23.56±6.49* 20.07±8.74* 18.75±9.67* 22.05±6.64*痉挛指数 2.15±0.40 2.46±0.23 2.98±0.54 3.46±0.41* 3.65±0.91*2.86±0.43
表2 3组患者不同时间段血浆内ET-1含量比较情况 (s,ng/L)

表2 3组患者不同时间段血浆内ET-1含量比较情况 (s,ng/L)
注:*P<0.05;与非痉挛组相比,#P<0.05;与无症状痉挛组相比,△P<0.05
组别 n 1d 3d 5d 7d 14d非痉挛组 17 46.95±13.31 49.64±15.52 51.58±9.47 52.01±8.41 47.59±6.78无症状痉挛组 9 47.62±10.34 66.41±8.76* 75.48±8.33* 74.96±11.24* 62.81±9.16*症状性痉挛组 14 48.74±9.16 72.04±7.59#△ 81.47±10.72#△ 79.84±13.29#△ 64.45±11.25#△
表3 3组患者不同时间段血浆内CGRP含量比较情况 (s,ng/L)

表3 3组患者不同时间段血浆内CGRP含量比较情况 (s,ng/L)
注:*P<0.05;与非痉挛组相比,#P<0.05;与无症状痉挛组相比,△P<0.05
组别 n 1d 3d 5d 7d 14d非痉挛组 17 30.91±6.97 26.70±5.56 28.37±5.52 28.61±5.94 29.06±6.16无症状痉挛组 9 29.87±6.84 24.18±7.14* 18.67±8.17* 17.16±9.64* 24.18±8.92*症状性痉挛组 14 28.54±5.21 22.15±6.09# 15.38±9.82#△ 14.02±7.56#△ 50.03±11.25#△
3 讨论
颅底肿瘤术后CVS的发生率据临床报告显示接近50%,是开颅术后威胁患者生存率和生存质量的典型性严重并发症之一,其主要是由于手术引起患者蛛网膜下腔出血引发缺血性脑损伤,可引起意识模糊、精神障碍、视野缺损等,是严重影响患者预后的关键性因素之一。临床研究表明,脑血管痉挛的发生主要是血管内部活性物质的聚集引发血管痉挛,ET-1作为目前最典型、最强的血管活性肽,是脑部调节、回流、收缩血管的关键性物质,其异常释放与脑血管痉挛的发生密切相关,本次研究结果显示ET-1水平的异常上升与痉挛的发生有着正相关关系,与临床同类文献研究成果一致。在改善颅底肿瘤患者术后预后的过程中,可选择性应用ET-1的受体阻滞剂,降低其在血液中的含量,降低脑血管痉挛的发生,尤其是在患者术后第3~7天是其异常性活跃的高峰期,更要加强监测。ET-1的高水平与CVS的严重程度呈正相关曲线,因此必须严格控制其水平以控制患者病情[3]。CGRP是广泛分布于人体体表和脑内的一种肽,有着保护中枢神经系统和周围神经系统的作用,可以通过释放维持细胞内部钙的稳定,降低细胞膜本身对于钙的通透性,在颅底肿瘤患者术后CGRP短时间的大量释放对于患者有着积极作用,但是随着时间的推移,血液内CGRP含量不断减低,将会造成患者脑血管收缩作用增强,致使脑血管痉挛危象的发生,CGRP含量降低是典型的危险讯号,与ET-1的异常上升一样,均需要严加注意,否则将会危及患者生命,尤其是在ET-1与CGRP频繁波动的术后第3~7天,将会成为治疗和保护患者的黄金时期,对于保护患者生命安全和健康有重要意义。综上所述,ET-1水平的上升和CGRP水平的降低是颅底肿瘤术后引发患者脑血管痉挛的重要危险因素,可作为防治患者术后并发症的重要指标,有利于积极改善患者预后,提升生存率。
[1]潘亚文,康笃伦,孟璇,等 .颅脑损伤后血浆内皮素-1与经颅超声多普勒的相关性研究[J].临床外科杂志,2010,10(1):23-25.
[2]Lan C,Das D,Wlosk owicz A,et al.Endothelin-modulaesh emoglobin-mediated signalin ginerebr ovascular smooth muscle via RhoA/Rh o kinase an d prot ein kin ase C[J].Am J Physiol Heart Circ Physiol,2004,286(1):165-173.
[3]许建强,田德棒,马普红,等 .颅内肿瘤术后脑血管痉挛的TCD监测[J].中华神经医学杂志,2004,3(6):442-444.
