进展期胃窦癌局部手术切除方式改进临床效果对比研究
2014-11-13邓振宇李荣江邱振雄何小科广东省深圳市宝安区西乡人民医院广东医学院附属西乡人民医院普外科广东深圳518102
邓振宇,李荣江,邱振雄,朱 涛,何小科[广东省深圳市宝安区西乡人民医院(广东医学院附属西乡人民医院)普外科,广东深圳 518102]
胃癌是最常见的恶性肿瘤之一,全球预计每年新发胃癌93万例,中国占其中的42%[1]。由于缺乏有效的普查机制,我国临床收治的胃癌病例绝大多数为局部进展期。胃癌的治疗历史悠久,迄今外科手术仍然是治疗胃癌最主要的手段,标准淋巴结清扫(D2)是提高胃癌治愈率的最主要手段[2]。胃窦是肿瘤的好发部位,约占50%,而小弯侧是肿瘤直接侵犯淋巴转移的重要部位,远端胃大部切除,虽然达到了肿瘤的切除范围,得到了阴性切缘,但残胃的微转移灶以及小弯侧的淋巴管网内微转移清扫并不彻底。在行远端胃癌根治时,采取切除胃的整个小弯,采用大弯侧Billorth Ⅰ吻合重建,对比传统远端胃大部切除方式,收到一定临床效果,现报告如下。
1 资料与方法
1.1 一般资料:选择2010年~2013年间本院收治的进展期远端胃癌102例手术患者作为研究对象。分为治疗组与对照组,其中治疗组合并高血压26例,2型糖尿病5例,幽门梗阻2例。组织学类型:低分化腺癌17例,溃疡型腺癌10例,印戒细胞癌5例,高分化腺癌9例,未分化腺癌4例,溃疡型髓样癌2例,黏液腺癌7例。对照组合并高血压16例,2型糖尿病2例,幽门梗阻5例。组织学类型:低分化腺癌20例,溃疡型腺癌9例,印戒细胞癌4例,高分化腺癌6例,未分化腺癌2例,溃疡型髓样癌2例,黏液腺癌5例。
1.2 纳入标准:①经胃镜检查,并经病理学确诊的胃癌。②临床病历资料真实可靠、术后病理学资料完整。③包括血常规、肝肾功能、心电图、腹胸部CT、超声胃镜在内的术前常规检查资料完整。④排除淋巴瘤、平滑肌肉瘤等胃的其他恶性肿瘤。⑤排除结直肠癌、原发性肝癌、肺炎、胰腺癌等合并有其他原发恶性肿瘤。⑥术前病理分期按2010年AJCC第七版病理分期标准,分期在T2~4aN+M0。
1.3 手术方式:所有患者采取全身麻醉气管插管,平卧位,经上腹正中切口入路,探查证实进展期,无远处转移。治疗组:①淋巴结清扫:按D2淋巴结廓清的原则,游离清扫。②重建方式:大弯侧胃左右网膜交界处采用60直线切割闭合离断,见图1。切割线下方胃前壁做横切口,以28吻合器从小弯侧进入,大弯侧尖端穿出与十二指肠吻合,见图2~3。③胃切除范围:采用先吻合后切除的方式,以80直线切割,切除胃小弯至贲门右侧,与大弯侧闭合线相接,完整移除标本,见图4。手术示意图见图5。
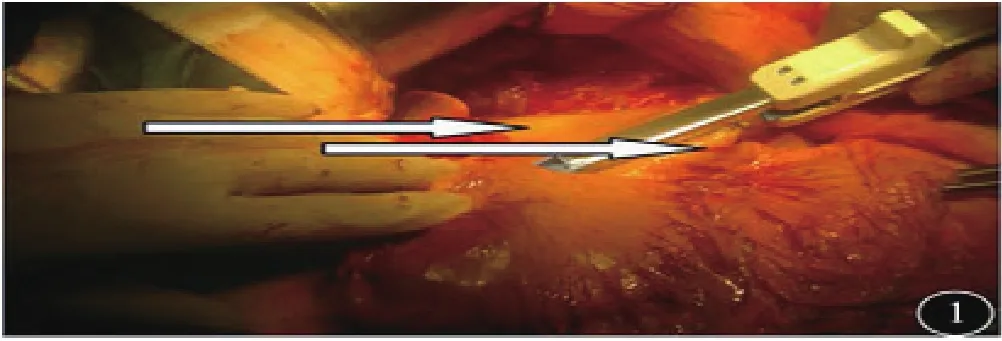
图1 大弯侧直线切割线
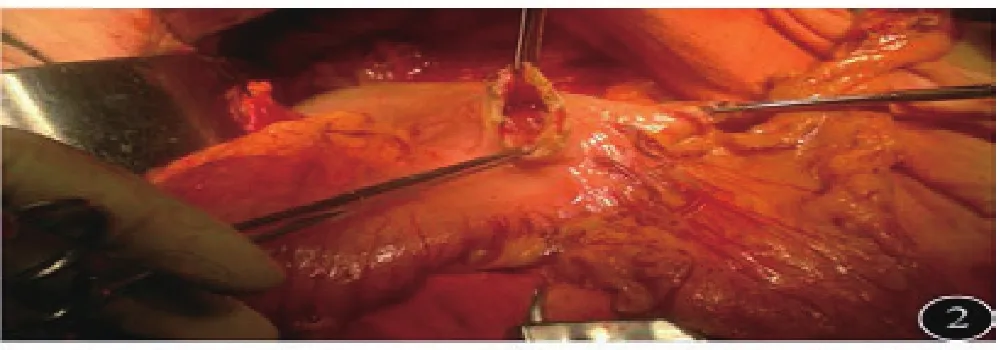
图2 大弯侧切割线下吻合器主体入口
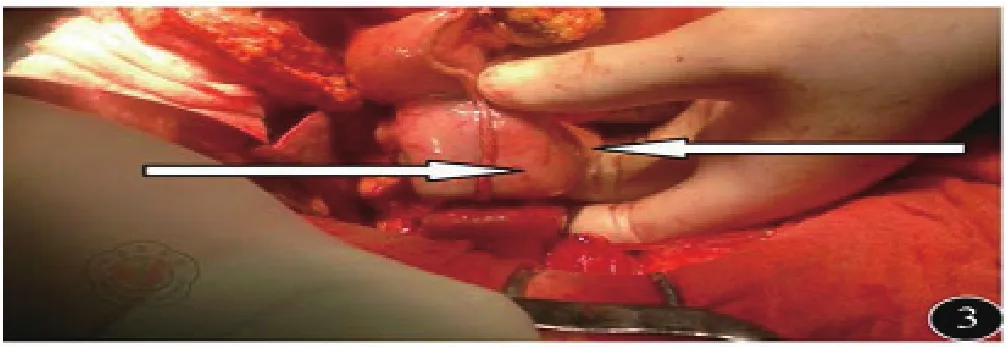
图3 吻合时切割线指向9点钟

图4 吻合后切除数个胃小弯
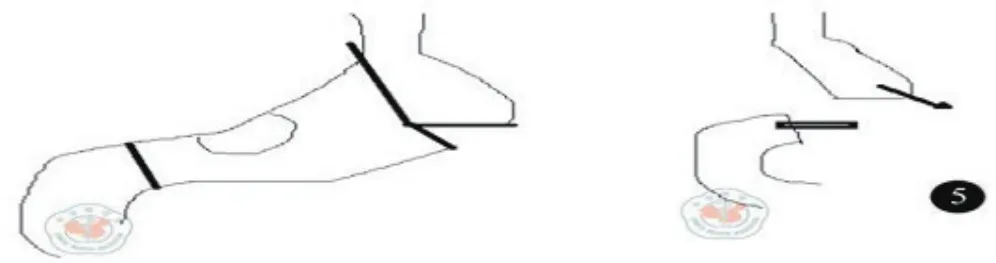
图5 小弯全切除范围
1.4 统计学方法:使用SPSS 17.0对各项资料进行统计、分析,以P<0.05为差异有统计学意义。
2 结果
所有患者治愈出院,无吻合口出血、瘘等并发症出现,治疗组手术时间120~150 min,平均135 min,术中出血量50~100 ml,平均(78.25±21.750)ml,术后恢复快,术后第2天流质饮食,术后住院时间7~11 d,平均8.5 d,5例糖尿病患者术后血糖恢复正常。小弯侧淋巴结清扫数目在15~35之间,平均(23.00±8.550),其中阳性淋巴结数目在10~22之间,平均(13.45±5.750),阳性率为(54.25±8.440)%,术后病理分期T2~4bN1~3bM0。对照组手术时间110~155 min,平均140 min,术中出血量50~120 ml,平均(80.35±24.665)ml,术后第2天流质饮食,术后住院时间7~12 d,平均9.0 d,2例糖尿病患者术后血糖恢复不明显。小弯侧淋巴结清扫数目在8~24之间,平均(16.25±6.440),其中阳性淋巴结数目在2~12之间,平均(8.45±3.685),阳性率为(44.45±6.225)%,术后病理分期T2~4bN1~3bM0。两组小弯侧淋巴结清扫数目及阳性率差异有统计学意义(P<0.05),治疗组优于对照组。
3 讨论
3.1 胃小弯侧全切的意义:胃窦是胃癌好发部位,由于胃的生理解剖的特性,小弯侧具有空间狭小,位置局限,有丰富的淋巴管网,是肿瘤侵犯和转移的重要部位。淋巴结的转移规律,多集中在胃小弯侧,淋巴引流是从胃的初级淋巴结逐步流向中间淋巴结(包括第Ⅱ站及第Ⅲ站淋巴结),最后到达腹主动脉旁的终术淋巴结(No.16),胃小弯区是胃癌淋巴结转移的重要部位,尤其是第3组淋巴结,任何部位的胃癌都受累,是转移率最高的一组淋巴结。在手术中,尽可能地切除过多的小弯侧组织,将第1组和第3组完整切除,治疗组中小弯侧淋巴结清扫数目在15~35之间,其中阳性淋巴结数目在10~22之间,术后完整病理分期T2~4bN1~3bM0,我们知道淋巴结总数以及淋巴结的转移比率是患者术后生存的影响因素,总数不足15枚不能准确地评估术后生存时间,尤其是早期胃癌,淋巴结的转移比率影响着患者术后5年的总生存[3-4]。在不影响胃生理机能的情况下,做到最大限度切除胃组织和淋巴组织,以达到肿瘤的R0切除,包括一些微转移灶,这些微转移(pNImi)枚数和转移度对预后有明显影响[5]。如果无论肿瘤部位如何,一味选择行全胃切除,小弯侧是全切了,但胃的生理机能不存在了,文献统计在胃癌行全胃切除、近端胃次全、远端胃次全术后,其术后患者生活质量(QOL),远端胃切除患者生活质量最高,这是因为保留了近端的残胃和迷走神经的完整性[6]。在5年生存率及术后并发症方面远端胃的优势对比全胃切除,更为突出。因此,胃切除的方式对患者术后生活质量以及近远期的营养状况是有很大影响的。小弯侧全切术,满足了切除的范围,有效避免了切缘残留,文献报道胃癌切缘癌细胞残留率在5.5%~13.0%,而切缘癌细胞一旦复发,及失去根治术手术意义,预后极差。对照组采用传统标准D2术式,并没有完全切除胃小弯,其淋巴结清扫数目与治疗组对比差异有统计学意义(P<0.05),说明完整剥离小弯侧仍有可能残留淋巴组织以及微转移灶。胃的排空是受交感神经、副交感神经、食物的刺激以及胃的容受性舒张协同作用,而且胃运动的电起搏点位于胃底近大弯侧的肌层。小弯侧全切术,切断了小弯侧的迷走神经,对胃排空功能影响不大,本组患者并未发现术后胃排空障碍,也没有相关证据说明迷走神经离断是影响胃排空障碍的主要因素。
3.2 胃小弯全切术后的重建:在远端胃癌术后的重建,经典的选择为:BillorthⅠ和BillorthⅡ吻合,吻合方式的不同,与远期残胃癌发生有一定的联系,行BillorthⅠ的吻合随访发生残胃癌多在残胃壁,而BillorthⅡ的发生多在吻合口附近[7]。但BillorthⅠ操作简单,胃肠道接近正常解剖生理状态,减少胆汁胰液反流如残胃,术后因胃肠功能紊乱而引起的并发症少,尤其是术后胃瘫综合征的发生明显减少,文献报道有胃瘫综合征发生的患者提示预后不良[8-9]。
BillorthⅡ的吻合,要干扰下腹腔,改变胃的生理通道,增加术后倾倒综合征的发生,甚至造成腹腔的种植转移。至于本组中糖尿病患者血糖情况术后恢复很好,与文献报道在行BillorthⅡ吻合术后血糖缓解率明显高于BillorthⅠ结论有出入,需大宗病例进一步证实[10]。
3.3 吻合的要点:在行重建时选择BillorthⅠ,并非是单纯的后壁与十二指肠的吻合,而是加以改良从大弯侧闭合口与十二指肠的吻合。给残胃吻合留有足够空间,进一步减少吻合张力。其操作要点为:①行远端胃癌根治术前,先行游离了Korcher切口,其目的有两方面,一为探查13组的淋巴结,因为13组淋巴结目前观点为区域外的转移,它的转移往往提示预后不良。二为松解十二指肠降部,为下一步的吻合提供机会。②在小弯侧全切后,残胃形同管状,选择常规的后壁与十二指肠吻合,增加吻合的张力,会导致术后的吻合口漏等情况出现。为避免上述并发症的发生,先行大弯侧直线闭合离断,改变吻合器的穿出路径,从大弯侧闭合线边缘穿出与十二指肠吻合,减少了吻合张力,保证了手术的安全。③在吻合时要保证吻合的方向,大弯侧切割线应在9点钟方向,否则会出现吻合的扭转。本组患者均成功吻合,没有出现吻合口瘘的和出血的发生。该术式同时满足淋巴结的清扫,又得到了足够的阴性切缘。
综上所述,远端胃癌行小弯全切术大弯侧 BillorthⅠ吻合,手术操作简便,在不影响胃的生理功能下最大限度切除胃组织,彻底清扫小弯侧淋巴结,降低切缘癌细胞残留,有助于术后病理分期的准确性,指导术后治疗。
[1] 梁 寒.胃癌转移规律及防治策略[J].中国普外基础与临床杂志,2012,19(1):8.
[2] Zhang MJ,Zhang GL,Yuan WB,et al.Risk factors analysis of postsurgical gastroparesis syndrome and its impact on the survival of gastric cancerafter subtotal gastrectomy[J].Chinese Journal of gastrointestinal surgery,2013,16(1):163.
[3] 杨 科,严 群,曹志新,等.胃小弯全切术在远端胃癌根治术中的应用[J].华中科技大学学报,2006,35(4):507.
[4] Son T,Hyung WJ,Lee JH,et al.Clinical implication of an insufficient number of examined lymph nodes after curative resection for gastric cancer[J].Cancer,2012,118(25):4687.
[5] Nelson R,Ko EB,Arrington A,et al.Race and correlations between lymph node number and survival for patients with gastric cancer[J].J Gastrointest Surg,2013,17(3):471.
[6] Han DS,Suh YS,Kong SH,et al.Nomogram predicting longterm survival after D2 gastrectomy for gastric cancer[J].J Clin Oncol,2012,30(20):3834.
[7] 黄 峰,周 东,应敏刚.伴有淋巴结转移的早期胃癌复发危险因素分析[J].中国肿瘤外科杂志,2011,3(1):197.
[8] 陈峻青.胃癌外科治疗几个问题的新进展[J].中国普外基础与临床杂志,2010,17(1):1.
[9] 邱文才,王维刚,王志刚,等.胃癌腹腔微转移检测及其临床意义[J].中国普通外科杂志,2007,16(5):872.
[10] 张 涛.胃癌手术患者生活质量影响因素分析[J].山东医药,2011,51(1):58.
