臭氧治疗对糖尿病大鼠视网膜细胞凋亡和VEGF、PEDF因子表达的影响
2014-11-13王清郭乔茜李琴谢婷玉陈雪艺
王清 郭乔茜 李琴 谢婷玉 陈雪艺
糖尿病视网膜病变(diabetic retinopathy,DR)是在氧化应激、炎症反应等[1]条件下产生的视网膜细胞因子改变、细胞凋亡、微血管损伤的一种血管性疾病。临床上尚无早期的预防措施。
臭氧治疗被证明可以作用于机体,影响血流变,改善供氧,抑制机体炎症反应、氧化应激反应,从而对相关疾病发挥作用[2]。研究表明臭氧治疗对糖尿病大鼠血管平滑肌和内皮细胞有保护作用,可延缓糖尿病及其并发症的发展[3],但臭氧治疗能否影响DR发展尚无报道。本研究通过建立糖尿病大鼠模型,观察臭氧治疗对糖尿病大鼠视网膜细胞凋亡及血管内皮生长因子(vascular endothelial growth factor,VEGF)、色素上皮衍生因子(pigment epithelium derived factor,PEDF)在视网膜表达的影响,对其作用机制进行探讨,为临床治疗提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康清洁级雄性 SD大鼠72只(新疆医科大学动物中心提供),鼠龄12~16周,体质量270~300 g。实验动物的使用均遵循国家科学技术委员会颁布的《实验动物管理条例》。并通过新疆医科大学第一附属医院伦理委员会审查。
1.1.2 主要试剂及仪器 高脂高糖饲料(新疆医科大学动物中心提供);体积分数10%臭氧混合气(臭氧与氧气混合,由德国HERRMANN臭氧发生仪制备);链脲佐菌素(streptozotoein,STZ;美国 Sigma公司);SumStep血糖仪(美国强生公司);石蜡切片机(瑞典);TUNEL凋亡试剂盒(瑞士罗氏);光学显微镜(瑞典Leica DM3000);Trizol、反转录试剂盒(美国Thermo公司);RT-PCR仪(美国BIO-RAD CFX96);SYBR Green real-time PCR试剂盒 (德国 Qiagen公司);VEGF上游引物:5’-AGAAAGCCCAATGAAGTGGTG-3’,下游引物:5’-ACTCCAGGGCTTCATCATTG-3’;PEDF 上 游 引 物:5’-AGAAAGCCCAATGAAGTGGTG-3’,下游引物:5’-ACTCCAGGGCTTCATCATTG-3’;β-actin 上游引物:5’-ACTGCCCTGGCTCCTAGCA-3’,下 游 引 物:5’-GCCAGGATAGAGCCACCAATC-3’(上海生工合成)。
1.2 方法
1.2.1 糖尿病大鼠模型的建立、分组及处理 72只大鼠适应性喂养1个月后,随机数字表法选出正常对照组(N组)大鼠18只,普通饲料喂养。其他54只用于糖尿病大鼠造模,高脂高糖饲料喂养45 d,禁食不禁水12 h后,用无菌的新鲜配制的0.1 mmol·L-1、pH 4.3~ 4.5 柠檬酸盐缓冲液稀释的 STZ(10 g·L-1),按 30 mg·kg-1体质量一次性腹腔注射诱导糖尿病大鼠模型。注射24 h后,断尾法取血测血糖,两次血糖平均值≥16.7 mmol·L-1视为达标,不达标大鼠重复注射一次,两次不达标者被剔除,最终52只SD大鼠造模成功(成模率90%)。
造模1个月后,造模成功的大鼠随机分为3组:糖尿病模型对照组(D组,17只):不给予任何干预;氧气干预对照组(D+O2组,17只):氧气灌肠作为对照;臭氧治疗组(D+O3组,18只):臭氧混合气灌肠。臭氧治疗以1个月为1个疗程,每周3次。臭氧发生仪制备臭氧混合气。大鼠排空直肠后,臭氧混合气缓慢灌入。按压肛门5 min,防止气体泄出。氧气灌肠方法同臭氧灌肠,气体体积换算至与臭氧等量。
1.2.2 取材 臭氧治疗1个疗程后,各组取7只大鼠腹腔注射麻醉后均摘除左侧眼球置于冰上,显微镜下沿角巩膜缘剪开,去除眼前节及玻璃体呈杯状置40 g·L-1多聚甲醛中固定48 h,用于细胞凋亡制片。剩余大鼠麻醉后摘除眼球去除眼前节,快速剥离双侧视网膜组织后置于一个冻存管中,液氮冷冻10 min后-80°保存备用。
1.2.3 视网膜细胞凋亡检测 TUNEL法检测视网膜细胞凋亡,标本常规逐级脱水,二甲苯透明,浸蜡包埋,沿视神经走行方向纵向连续切片,切片厚4 μm。石蜡切片常规脱腊至水化,体积分数3%H2O2室温处理 10 min;加入0.01 mol·L-1枸橼酸溶液微波修复10 min,室温冷却;滴加TUNEL MIX(TUNEL标记液与TUNEL酶按1∶30稀释),37℃湿盒内孵育60 min;滴加TUNEL过氧化物酶转化剂,37℃湿盒内孵育30 min;新鲜配制的DAB显色液显色,苏木素轻度复染,水洗、脱水、透明、封片;光学显微镜观察、摄片。计算凋亡指数(apoptotic index,AI):每张切片高倍镜下计数至少500个细胞,每100个细胞的棕色阳性细胞数,用百分数表示即细胞AI。
1.2.4 VEGF mRNA、PEDF mRNA 表达量的检测
取大鼠视网膜组织,液氮中研磨后加入1 mL Trizol,按照说明书步骤行 Trizol一步法提取总 RNA。总RNA反转录为cDNA,于-20℃保存。PCR反应体系为 20 μL:cDNA 2.0 μL、上下游引物各 0.3 μL、25 ×SYBR Green MIX 10 μL、去离子水 7.4 μL。以cDNA为模板行PCR扩增后,分别将VEGF、PEDF和β-actin的PCR产物纯化后10倍梯度稀释5~8个浓度梯度,作为模板行荧光定量PCR扩增,建立标准曲线。反应条件为预变性95.0℃ 3 min;变性95.0℃ 10 s;退火 30 s,VEGF、PEDF、β-actin 退火温度分别为61.7℃、68.4℃和62.6℃,分别持续40个循环,每个循环后采集荧光生成扩增曲线。扩增结束后65.0~95.0℃按0.5℃增值进行溶解曲线分析。每一样品VEGF、PEDF和β-actin的检测均做2个平行管。VEGF和PEDF与β-actin表达的比值为视网膜VEGF mRNA和PEDF mRNA的表达量。实验重复3次,取各组平均值用于结果分析。
1.3 统计学方法 采用SPSS 17.0统计软件包进行统计分析,数据以均数±标准差()表示。各组大鼠视网膜细胞AI、VEGF mRNA和PEDF mRNA的表达采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组视网膜细胞凋亡结果比较 凋亡细胞的特点是细胞核呈棕色,细胞体积较正常细胞稍小。4组大鼠视网膜切片TUNEL法染色均可看到凋亡细胞阳性表达,N组内核层偶见散在凋亡细胞,D组、D+O2组、D+O3组凋亡细胞表达量较多,主要表达在视网膜神经节细胞层及内核层,外核层偶见表达,同时血管内皮细胞处亦可见表达较多(图1)。N组、D 组、D+O2组、D+O3组 AI值分别为 1.97±0.53、34.43±5.56、34.68±5.80、19.22±3.30,各组间AI差异有统计学意义(F=89.070,P=0.000)。进一步两两比较结果显示:N组与D组、D+O2组、D+O3组比较差异均有统计学意义(均为P=0.000);D+O3与D组、D+O2组比较差异均有统计学意义(均为P=0.000);D组与D+O2组比较差异无统计学意义(P=0.913)。
2.2 各组视网膜VEGF mRNA、PEDF mRNA表达比较 RT-PCR法检测结果显示,溶解主峰单一表示扩增特异性好。VEGF、PEDF和β-actin溶解温度分别为84.5℃、83.5℃、82.0℃。扩增效率数值为95~100,相关性均接近1,斜率接近-3.3,表明可信度高。
大鼠视网膜中VEGF mRNA的相对表达量:N组、D 组、D+O2组、D+O3组分别为 4.22±1.18、11.60±3.42、10.75±2.81、7.40±2.13,各组间差异有统计学意义(F=23.923,P=0.000)。进一步两两比较结果显示:D组、D+O2组、D+O3组大鼠视网膜中VEGF mRNA的表达量均明显高于N组,差异均有统计学意义(均为 P=0.000);D+O3组VEGF mRNA的表达量低于D组和D+O2组,差异均有统计学意义(均为P=0.000);D组与D+O2组比较差异无统计学意义(P=0.386)。
大鼠视网膜中PEDF mRNA的表达量:N组、D组、D+O2组、D+O3组分别为 0.22±0.12、0.13±0.08、0.12±0.07、0.19±0.09,各组间差异无统计学意义(F=2.803,P=0.053)。进一步两两比较结果显示:N组与D组、D+O2组比较差异均有统计学意义(P=0.018、P=0.029),与 D+O3组比较差异无统计学意义(P=0.397);D+O3组表达量高于D组和D+O2组,差异无统计学意义(P=0.058,P=0.066);D组与 D+O2组比较差异无统计学意义(P=0.840)。
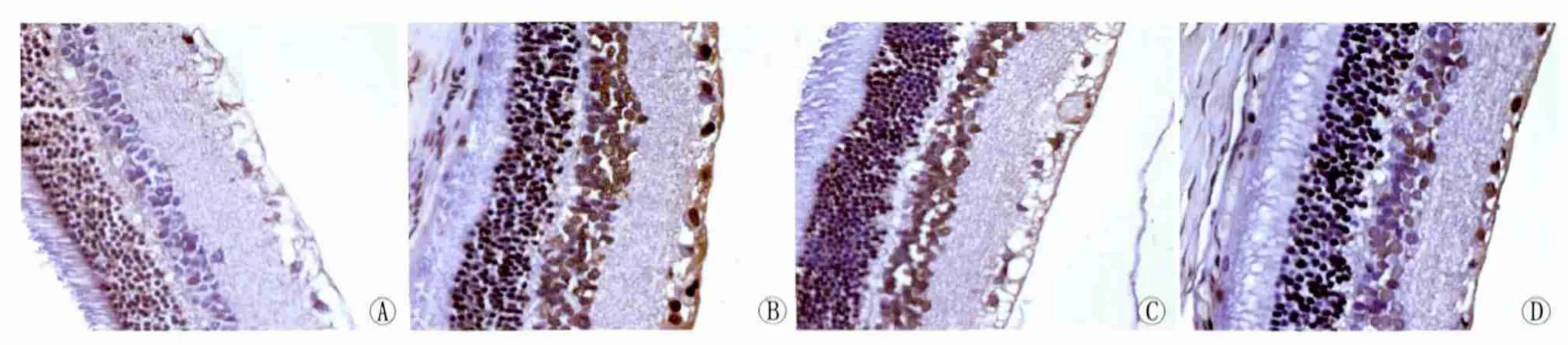
Figure 1 Retinal apoptosis cell detected by TUNEL technique(DAB ×400).A:Group N;B:Group D;C:Group D+O2;D:Group D+O3 TUNEL法检测视网膜细胞凋亡(DAB,×400):A:N组;B:D组;C:D+O2组;D:D+O3组
3 讨论
本研究着重于DR早期病变,使用SD大鼠高脂高糖喂养联合STZ腹腔注射方法造模,本次造模成功率96%。在DR发病过程中,高糖环境下引起的视网膜炎症反应发挥着关键作用,尤其在DR早期,代谢通路异常使视网膜细胞功能丧失而发生凋亡,进一步导致代谢紊乱,毛细血管变性、闭塞,继而出现视网膜组织缺氧,发生氧化应激损伤,促新生血管因子表达,新生血管形成[1,4]。由于臭氧治疗被证明在合适浓度下作用于机体可以发挥抗炎、改善供氧、防止氧化应激等治疗作用。本实验采用相对安全的臭氧灌肠治疗法治疗DR,效果理想[5]。
视网膜细胞凋亡是糖尿病开始出现的早期症状之一[6]。本实验中 TUNEL法检测视网膜细胞凋亡结果表明,D组、D+O2组、D+O3组大鼠视网膜组织中可见大量凋亡细胞,主要分布在神经节细胞层和内核层,这与董志军等[7]研究一致。糖尿病的高糖环境引起视网膜代谢功能紊乱,刺激视网膜促炎因子表达量增高,早期氧化应激反应激活多种代谢通路,破坏线粒体电子传递链功能,促使凋亡的发生[4,8]。本研究结果表明,D+O3组的 AI明显低于D组和 D+O2组(均为 P=0.000)。臭氧可发挥抗炎、抗氧化应激作用,当臭氧直肠灌注被肠壁黏膜吸收后,可通过调控炎症因子[9]、炎症介质及细胞因子表达减轻炎症损伤,引起全身轻度的氧化应激,激活机体抗氧化保护系统,保护细胞免受氧化和炎症反应刺激,同时可能逆转慢性氧化应激[2,10]。
本实验RT-PCR方法检测结果显示:D组、D+O2组、D+O3组大鼠视网膜VEGF mRNA的表达量明显高于 N组(均为 P=0.000)。VEGF是最直接的眼内新生血管形成因子,相对缺氧会促进 VEGF的分泌。本实验结果示,D+O3组 VEGF mRNA表达量在糖尿病发病早期即高于N组,但明显低于D组和D+O2组,说明D+O3组大鼠视网膜的相对缺氧状态得到改善。因为糖尿病会导致血液黏稠度增高,血管内皮损伤,臭氧可以增加脂质代谢酶活性,参与体内脂质的代谢,降低血脂[11];同时,臭氧与机体作用还能够发挥扩张血管等药理作用,促进毛细血管开放,改善血液流变学[12],提高三磷酸腺苷和2,3-磷酸甘油水平,并能降低氧合血红蛋白结合力,促进氧气的释放,增加血液携带氧量,改善糖尿病早期视网膜的供氧状态,从而相对减少VEGF的分泌量[13]。
PEDF作为一种多功能蛋白,有明显的神经营养、抗血管生成、抗血管通透、抗炎作用,越来越多的证据证明它对DR有保护作用。强烈的氧化应激是使 PEDF减少的原因之一[14]。本研究结果显示,D组和D+O2组PEDF mRNA表达量低于N组(均为P <0.05)和 D+O3组(均为 P >0.05)。通过变化趋势的观察发现,PEDF表达量随VEGF的升高而降低,这与吴晋晖等[15]的研究结果一致。由此我们推测,臭氧通过其抗氧化应激作用以及VEGF的抑制作用,可能对PEDF起保护作用,但这一推测仍需要更科学的实验验证。
综上所述,臭氧治疗作为一种新的治疗方法,可能在作用于全身的同时,抑制视网膜的炎症、氧化应激反应,改善视网膜供氧,从而延缓DR的发展。需要特别说明的是,臭氧使用时应避免呼吸道吸入,蚕豆病患者不能进行臭氧治疗,臭氧治疗还可能会引发极少的过敏反应。本研究也存在不足之处,臭氧灌肠的方法虽然容易操作,但对于剂量的控制性稍差。臭氧治疗干预时间较短,长期治疗效果需要继续深入研究。臭氧治疗能否作为一种临床可用的预防DR的治疗方法仍需要更多的研究和实践来证实。
1 Tang J,Kern TS.Inflammation in diabetic retinopathy[J].Prog Retin Eye Res,2011,30(5):343-358.
2 Sagai M,Bocci V.Mechanisms of action involved in ozone therapy:is healing induced via a mild oxidative stress[J]?Med Gas Res,2011,1:21-29.
3 Al-Dalain SM,Martínez-Sanchez G,Candelario-Jalil E,Menéndez S,Re L,Giuliani A,et al.Ozone treatment reduces markers of oxidative and endothelial damage in an experimental diabetes model in rats[J].Pharmacol Res,2001,44(5):391-396.
4 Li SY,Fu ZJ,Lo AC.Hypoxia-induced oxidative stress in ischemic retinopathy[J].Oxid Med Cell Longev,2012,2012:426769.
5 Calunga JL,Zamora ZB,Borrego A,Río Sd,Barber E,Menéndez S,et al.Ozone Therapy on rats submitted to subtotal nephrectomy:role of antioxidant system[J].Mediators Inflamm,2005,2005(4):221-227.
6 Fletcher EL,Phipps JA,Ward MM,Puthussery T,Wilkinson-Berka JL.Neuronal and glial cellabnormality as predictors of progression of diabetic retinopathy[J].Curr Pharm Des,2007,13(26):2699-2712.
7 董志军,陶相宜,郭立涛,张铁民,王海彬,付笑笑.菩人丹超微粉对糖尿病大鼠视网膜神经细胞凋亡过程中线粒体途径的影响[J].中华实验眼科杂志,2011,29(10):894-898.
8 Kowluru RA,Koppolu P,Chakrabarti S,Chen S.Diabetes-induced activation of nuclear transcriptional factor in the retina,and its inhibition by antioxidants[J].Free Radic Res,2003,37(11):1169-1180.
9 Fuccio C,Luongo C,Capodanno P,Giordano C,Scafuro MA,Siniscalco D,et al.A single subcutaneous injection of ozone prevents allodynia and decreases the over-expression of proinflammatory caspases in the orbito-frontal cortex[J].Eur J Pharmacol,2009,603(1-3):42-49.
10 Chen H,Xing B,Liu X,Zhan B,Zhou J,Zhu H,et al.Ozone oxidative preconditioning protects the ratkidney from reperfusion Injury:the role of nitric oxide[J].J Surg Res,2008,149(2):287-295.
11 Hemandez F,Menendez S,Wong R.Decrease of blood cholesterol and stimulation of antioxidative response in eardiopathy patients treated with endovenous ozone therapy[J].Free Radie Biol Med,1995,19(1):115-119.
12 Di Paolo N,Bocci V,Salvo DP,Palasciano G,Biagioli M,Meini S,et al.Extracorporeal blood oxygenation and ozonation(EBOO):a controlled trial in patients with peripheral artery disease[J].Int J Artif Organs,2005,28(10):1039-1050.
13 Borrelli E,Diadori A,Zalaffi A,Bocci V.Effects of major ozonated autohemotherapy in the treatment of dry age related macular degeneration:arandomized controlled clinical study[J].Int J Ophthalmol,2012,5(6):708-713.
14 Zhu XF,Zou HD.PEDF in diabetic retinopathy:a protective effect of oxidative stress[J].J Biomed Biotechnol,2012,2012:580687.
15 吴晋晖,高玉,柳林.不同病程糖尿病大鼠视网膜VEGF和PEDF表达的动态变化[J].眼科新进展,2010,30(9):809-814.
