糖尿病小鼠的角膜创伤修复以及神经改变△
2014-11-13贺司宇刘素素张红敏王丽娅
贺司宇 刘素素 张红敏 王丽娅
糖尿病能引起全身多器官并发症,其在眼部主要表现为糖尿病视网膜病变。近年来,随着糖尿病发病率的不断增加,对于糖尿病相关并发症的认识也不断深入,糖尿病引起的角膜改变正在逐渐引起人们的重视[1]。糖尿病能导致角膜上皮损伤后修复延迟[2],而角膜上皮缺损已经被证明可能诱发角膜基质混浊、结构紊乱以及感染性角膜炎,最终甚至危及视力[3]。目前,对糖尿病引起的角膜改变缺乏深入了解。小鼠与人类基因的同源性最高,糖尿病并发角膜改变的研究以兔、大鼠为主,对于糖尿病所引起小鼠角膜改变却知之甚少。因此,本研究对糖尿病小鼠角膜的创伤修复以及角膜神经是否发生改变进行了研究。
1 材料与方法
1.1 材料
1.1.1 实验动物与分组 8周龄雄性昆明白小鼠购自南京大学模型动物研究所。小鼠购回后,于18~20℃、明暗交替环境饲养;建模前将小鼠禁食(不禁水)12 h,称量空腹体质量,尾端取血测定血糖浓度。血糖浓度 ≤7.4 mmol·L-1的小鼠80只纳入实验。按照建模条件的不同,随机分为对照组和糖尿病模型组(模型组),每组各40只。
1.1.2 实验试剂与仪器 链脲佐菌素(streptozotocin,STZ)、柠檬酸钠均购自美国Sigma公司,DAPI购自美国Invitrogen公司,FITC-Gr-1大鼠抗小鼠抗体、PE-CD31大鼠抗小鼠抗体均购自美国eBioscience公司,Tubulin β-Ⅲ兔抗小鼠神经抗体购自美国 R&D公司,荧光显微镜及配套AR 3.2图像分析软件购自日本尼康公司。
1.2 方法
1.2.1 STZ 注射液配制 120 mg STZ 溶于0.1 mol·L-1pH 4.5柠檬酸-柠檬酸钠缓冲液,定容至6 mL,在冰浴条件下充分溶解,过滤消毒。现用现配,每次配制后15~20 min内用完。
1.2.2 动物模型建立 对照组常规饲养,注射无菌柠檬酸缓冲液。模型组空腹后12 h进行STZ腹腔注射,给药量为200 mg·kg-1,注射后第1天晚上给予100 g·L-1蔗糖水以避免低血糖,24 h后测定血糖。给予高糖高脂饮食,非禁食状态血糖≥11.1 mmol·L-1者为造模成功,并连续监测 0 h、24 h、2 d、3 d、4 d、5 d、6 d 血糖浓度、体质量。
1.2.3 角膜上皮创伤模型制作与愈合速率测定使用无菌手术刀片,只刮除上皮层,前弹力层尽量完整保留,在不同时间点,将小鼠放在体视显微镜下,用20 g·L-1荧光素钠滴眼,PBS冲洗染料,1 min内用相同的参数拍摄图像,用AR图像分析软件计算不同时间点(同1.2.2中时间点)的创伤面积。
1.2.4 中性粒细胞浸润情况观察与计数 创伤后48 h,分别采用PE-CD31和FITC-Gr-1抗体对血管和中性粒细胞染色。摘取完整小鼠角膜;20 g·L-1多聚甲醛固定45 min,PBS冲洗3次 ×5 min;1 g·L-1Triton 100-BSA破膜20 min;20 g·L-1BSA封闭20 min;加入 FITC-Gr-1(1 g·L-1Triton 100-BSA 300 μL+1.3 μL 抗体)、PE-CD31(1 g·L-1Triton 100-BSA 300 μL+1.5 μL 抗体)孵育4 ℃过夜,PBS避光冲洗3次 ×5 min;0.2 mg·L-1DAPI复染30 min;PBS避光冲洗3次×5 min;将角膜平铺于载玻片上,用镊子展开角膜片,吸水纸吸去多余PBS,采用荧光封片胶封片。荧光显微镜下观察,在整个角膜不同区域均匀随机选择16个视野拍照,进行中性粒细胞计数。
1.2.5 神经纤维染色与定量 于造模成功后9周分别取各组小鼠5只,取完整小鼠角膜,20 g·L-1多聚甲醛固定45 min,PBS冲洗3次×5 min;1 g·L-1Triton 100-BSA破膜20 min;20 g·L-1BSA封闭20 min;加入含4 μL Tubulin β-Ⅲ抗体的1 g·L-1Triton 100-BSA 1 mL,4℃孵育过夜,PBS避光冲洗3次 ×5 min;0.2 mg·L-1DAPI复染30 min,PBS避光冲洗3次×5 min;将角膜平铺于载玻片上,用镊子展开角膜片,吸水纸吸去多余PBS,采用荧光封片胶封片,在荧光显微镜下观察并拍照。在所得的角膜片共聚焦图片上随机叠加等距测点框,分别计数落在整个图片内及图片神经纤维上的测点数。根据以下公式计算[4]:Vfn= ∑Pfn/∑P;Vfn:神经纤维密度;∑Pfn:落在图片神经纤维上的测点数之和;∑P:落在整个图片内的测点数之和。
1.3 统计学方法 采用SPSS 17.0统计软件包分析数据,实验结果用均值±标准差表示,组间显著性差异分析使用One-way ANOVA。P<0.05为差异有统计学意义。
2 结果
2.1 小鼠血糖升高与体质量下降 在进行腹腔STZ注射之前,两组小鼠的血糖浓度均处于5.9~7.4 mmol·L-1的正常范围内,且组间差异无统计学意义(P=0.858,见表1)。对照组小鼠注射无菌柠檬酸缓冲液后24 h血糖浓度为(6.7±0.2)mmol·L-1,模型组升高至(17.1±0.5)mmol·L-1,2 d后模型组血糖浓度升高并维持在25~30 mmol·L-1范围内(表1),两组间造模后 24 h、2 d、3 d、4 d、5 d、6 d 血糖值差异均有统计学意义(均为P<0.05)。在体质量方面对照组小鼠维持了正常的体质量增长,在注射无菌柠檬酸缓冲液后6 d体质量为(38.4±0.4)g,增长了8.1%,模型组小鼠的体质量为(28.2±0.9)g,减轻了14.1%,仅为对照组小鼠的81.7%(表2)。除造模后0 h、24 h外,其余时间点两组间体质量差异均有统计学意义(均为P<0.05)。
2.2 角膜上皮创伤修复延迟 对照组小鼠角膜初始创伤面积为(264 277±940)μm2,模型组初始创伤面积为(282 140±506)μm2,两组间差异无统计学意义(P=0.376)。造模后24 h后对照组创伤面积为(185 550±792)μm2,模型组为(225 454±826)μm2,组间差异有统计学意义(P=0.026)。创伤后4 d时对照组完全愈合(385±44)μm2(图1),而模型组创伤面积为(119 877±529)μm2,和对照组间差异有显著统计学意义(P<0.01),至9 d后才可见创伤基本愈合(476±42)μm2,比对照组愈合延迟了5 d。2.3 角膜上皮创伤后中性粒细胞浸润情况 对照组小鼠角膜缘血管广泛分布,且中性粒细胞和血管伴行;而模型组小鼠角膜中血管分布稀少,中性粒细胞虽然仍与血管伴行,但是数量较少(图2)。对中性粒细胞计数显示,创伤后2 d对照组为(212.3±6.3)个/视野,而模型组为(184.7±3.2)个/视野,差异有统计学意义(P<0.05)。
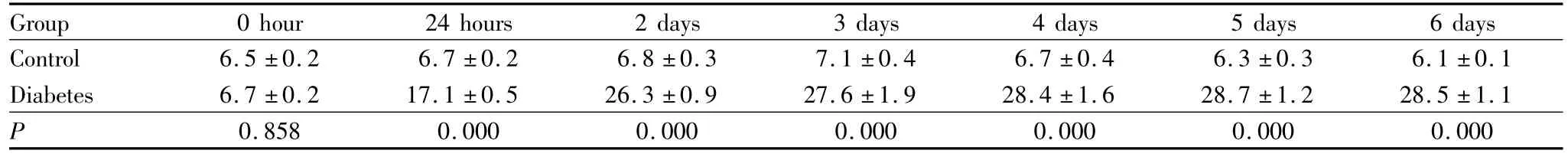
表1 各组小鼠的血糖Table 1 Blood glucose of each group(ˉx±s,n=5,c/mmol·L-1)
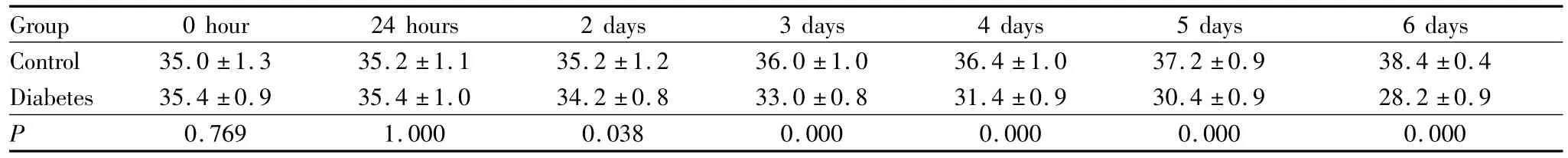
表2 各组小鼠的体质量Table 2 Body weight of each group(xˉ±s,n=5,m/g)
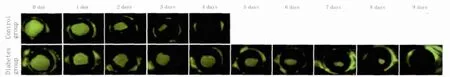
Figure 1 Cornea wound healing at different time points of two groups 两组创伤后不同时间角膜愈合情况
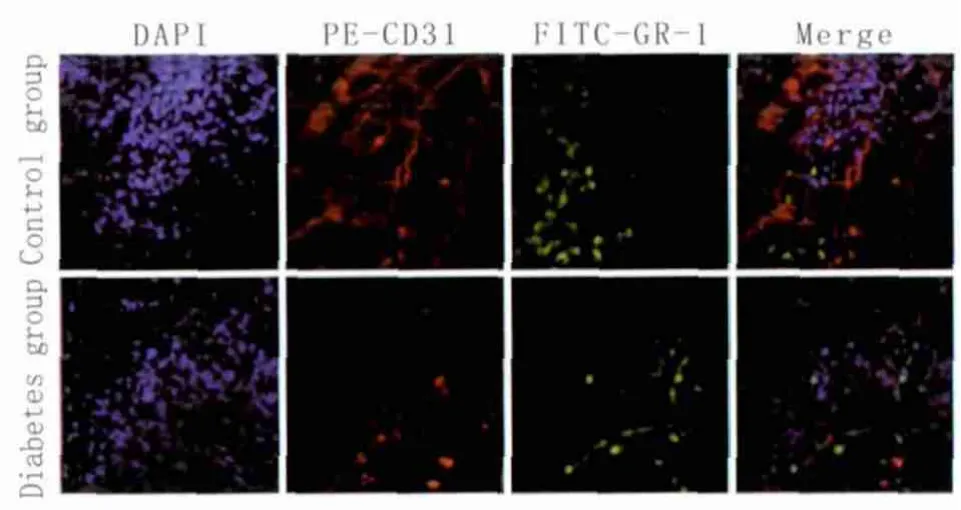
Figure 2 Distribution of blood vascular and neutrophils.A-D:Control group;E-H:Diabetes group 创伤后血管和中性粒细胞分布。A-D为对照组;E-H为模型组
2.4 糖尿病小鼠角膜神经分布 两组小鼠角膜Tubulin β-Ⅲ神经抗体染色结果显示,与对照组小鼠相比,模型组小鼠中央、旁中央、周边角膜都有神经纤维卷曲、水肿、变性甚至坏死,并且神经纤维减少(图3)。对神经纤维密度定量分析显示,与对照组相比,模型组小鼠角膜的各个区域均显著减少,差异均有统计学意义(均为P<0.05,见表3)。

表3 各组小鼠神经纤维密度Table 3 Nerve fiber density of each group(n=5,Nerve fiber density/μm3·mm-3)

Figure 3 Distribution of nerve fiber of two groups 小鼠角膜神经纤维分布
3 讨论
3.1 STZ诱导形成糖尿病小鼠并影响小鼠生长STZ对一定种属动物的胰岛β细胞有选择性破坏作用,能诱发特定动物发生糖尿病。一般用于大鼠和小鼠糖尿病动物模型的制备[5]。本实验采用腹腔注射STZ诱导小鼠发生糖尿病,腹腔注射STZ后24 h,我们开始对小鼠血糖水平进行监控,可见小鼠血糖迅速升高并在2 d后稳定在较高水平,其中造模后2 d、3 d、4 d、5 d、6 d,血糖值分别为(26.3±0.9)mmol·L-1、(27.6±1.9)mmol·L-1、(28.4±1.6)mmol·L-1、(28.7±1.2)mmol·L-1、(28.5±1.1)mmol·L-1,和对照组相比差异均有统计学意义(均为P<0.05)。随着糖尿病小鼠血糖维持在较高水平,其生长受到抑制,糖尿病小鼠的体质量从2 d开始呈现下降趋势,并且和对照组小鼠相比差异有统计学意义(P<0.05)。这和Daneshgari等[6]的报道结果一致,表明本研究糖尿病模型制作成功。
3.2 糖尿病小鼠角膜创伤愈合时间延迟分析 对照组小鼠角膜上皮可于创伤后4 d完全愈合。但是糖尿病小鼠创伤愈合时间显著延后,通过持续观察发现,模型组小鼠角膜上皮创伤愈合时间延迟5 d,5只糖尿病模型小鼠的创伤彻底愈合时间在9 d(图2)。从创伤后24 h开始糖尿病小鼠创伤愈合情况和对照组小鼠就存在明显差异(均为P<0.05)。本实验排除周龄、性别构成比等可能影响小鼠角膜上皮创伤愈合的因素,其主要原因就是观察糖尿病对组织创伤愈合的干扰。此结果不仅和糖尿病对全身创伤的表现一致,也和其他动物糖尿病模型角膜中所观察到的结果一致[7]。
基于上述结果,我们对可能引起角膜上皮创伤愈合延迟的因素进行了分析。分别采用PE-CD31、FITC-Gr-1抗体和DAPI对血管、中性粒细胞染色,在荧光显微镜下观察角膜创伤后血管、中性粒细胞的分布情况。对照组角膜缘血管分布均匀,可见中性粒细胞位于血管内或者与血管伴行,模型组小鼠角膜缘血管比对照组纤细、稀疏(图3)。中性粒细胞虽然仍分布于血管内或者与血管伴行,但是数量少于对照组,差异有统计学意义(P<0.05)。关于中性粒细胞在角膜上皮细胞创伤愈合中所起的作用已有报道[8],Marrazzo 等[9]认为中性粒细胞的浸润对角膜上皮创伤后的修复有积极意义。本研究结果和上述报道一致,据此推断糖尿病引起的血管数量的变化以及对中性粒细胞浸润的影响,有可能是糖尿病引起角膜创伤愈合延迟的原因之一。
3.3 糖尿病小鼠角膜神经分布改变 除与角膜创伤修复密不可分的中性粒细胞分布改变外,我们也观察到模型组小鼠维持高血糖9周之后角膜神经纤维分布发生了明显变化,出现形态异常的神经纤维(图4),这可能是神经退行性变化的表现。对神经纤维密度定量分析显示,与对照组相比,模型组小鼠角膜的各个区域均显著减少,差异均有统计学意义(均为P<0.05)。国内外在其他糖尿病动物模型中也有类似报道[10-11],Wang 等[12]研究认为糖尿病引起神经细胞内cAMP和cGMP下调,从而改变角膜组织中神经纤维分布的规则性,这和本研究观察到的神经纤维分布一致。此外有报道认为神经营养性减退会导致角膜溃疡的反复发生[13],也提示了本实验中所观察到的创伤愈合延迟和神经改变有某种内在关联。然而,糖尿病性神经病变的发病机制尚未完全阐明[14],这种改变对于角膜的影响还有待进一步研究。
此外,由于受实验条件、技术手段限制,未能对糖尿病小鼠角膜可能发生的诸如角膜面积、厚度、质地、角膜缘上皮细胞增殖与凋亡等进行分析。除了中性粒细胞之外,还有哪些局部因素也发生了变化还有待进一步研究证实。
综上所述,作为一种全身性疾病,糖尿病有可能导致多系统、多脏器的并发症发生,在角膜组织有可能导致角膜上皮的创伤愈合延迟,并且有可能损害患者视力。因此,糖尿病患者应该特别注意避免角膜创伤,尤其是接受DR手术治疗的患者应避免角膜并发症的发生。
1 张迪,翁孝刚,王涛,陈雪辉.不同途径移植人脐带间充质干细胞治疗糖尿病大鼠[J].新乡医学院学报,2013,30(5):347-352.
2 Bikbova G,Oshitari T,Tawada A,Yamamoto S.Corneal changes in diabetes mellitus[J].Curr Diabetes Rev,2012,8(4):294-302.
3 宁琳,高明宏.糖尿病2型患者眼表改变的临床特点[J].国际眼科杂志,2010,10(5):910-912.
4 李琛,杨姝,张伟,汪维伟,唐勇.应用新的体视学方法研究大鼠白质无髓鞘神经纤维老年性改变[J].中国体视学与图像分析,2006,11(4):288-291.
5 Szkudelski T.Streptozotocin-nicotinamide-induced diabetes in the rat.Characteristics of the experimental model[J].Exp Biol Med(Maywood),2012,237(5):481-490.
6 Daneshgari F,Leiter EH,Liu G,Reeder J.Animal models of diabetic uropathy[J].J Urol,2009,182(6 Suppl):S8-S13.
7 Xu K,Yu FS.Impaired epithelial wound healing and EGFR signaling pathways in the corneas of diabetic rats[J].Invest Ophthalmol Vis Sci,2011,52(6):3301-3308.
8 Zhang Y,Kobayashi T,Hayashi Y,Yoshioka R,Shiraishi A,Shirasawa S,et al.Important role of epiregulin in inflammatory responses during corneal epithelial wound healing[J].Invest Ophthalmol Vis Sci,2012,53(4):2414-2423.
9 Marrazzo G,Bellner L,Halilovic A,Li Volti G,Drago F,Dunn MW,et al.The role of neutrophils in corneal wound healing in HO-2 null mice[J].PLoS One,2011,6(6):e21180.
10 徐凯蒙,李一壮.2型糖尿病患者角膜知觉减退的研究进展[J].国际眼科杂志,2013,13(6):1137-1141.
11 Papanas N,Ziegler D.Corneal confocal microscopy:a new technique for early detection of diabetic neuropathy[J].Curr Diab Rep,2013,13(4):488-499.
12 Wang F,Gao N,Yin J,Yu FS.Reduced innervation and delayed re-innervation after epithelial wounding in type 2 diabetic Goto-Kakizaki rats[J].Am J Pathol,2012,181(6):2058-2066.
13 Rosenberg ME,Tervo TM,Immonen IJ,Müller LJ,Grönhagen-Riska C,Vesaluoma MH.Corneal structure and sensitivity in type 1 diabetes mellitus[J].Invest Ophthalmol Vis Sci,2000,41(10):2915-2921.
14 Misra S,Ahn HN,Craig JP,Pradhan M,Patel DV,McGhee CN.Effect of panretinal photocoagulation on corneal sensation and the corneal subbasal nerve plexus in diabetes mellitus[J].Invest Ophthalmol Vis Sci,2013,54(7):4485-4490.
