Cyt C和Caspase 3在STZ诱导糖尿病大鼠晶状体上皮细胞中的表达
2014-11-13李云刘菲
李云 刘菲
随着糖尿病发病率的上升及病程的延长,糖尿病患者发生各种慢性并发症日益增多。糖尿病性白内障已成为糖尿病并发症中仅次于视网膜病变的第二大眼病[1],是导致糖尿病患者视力下降甚至失明的重要原因[2]。研究发现,晶状体上皮细胞(lens epithelial cells,LEC)凋亡可能是各种非先天性白内障的共同细胞学基础,而Cyt C及Caspase 3在细胞凋亡中发挥了关键作用。本实验建立糖尿病动物模型,应用免疫组织化学方法和Western blot技术检测LEC中Cyt C及Caspase 3的表达情况,为糖尿病性白内障的发病机制提供新的线索。
1 材料与方法
1.1 材料
1.1.1 实验动物和主要试剂 60只 SD大鼠购自南昌大学医学院动物科学部,均为雄性,体质量(180±10)g。链脲佐菌素(STZ)购自美国 Sigma公司;Cyt C抗体、Caspase 3(Ab-150)抗体及生物素标记兔抗大鼠IgG购自Anbobio公司;免疫组织化学试剂盒购自美国Santa Cruz公司;线粒体提取试剂盒购自美国Keygen公司。
1.1.2 主要仪器 德国罗氏公司卓越型血糖仪,美国Biorad公司ChemiDoc-It化学发光成像分析系统及垂直电泳仪,德国 Eppendorf低温超速离心机,日本奥林巴斯倒置光学显微镜、裂隙灯眼前段照相系统。
1.2 方法
1.2.1 实验分组 将60只8周龄健康 SD大鼠随机分为对照组和实验组,每组各30只。
1.2.2 动物模型制作 实验组:大鼠禁食12 h,一次性腹腔注射 20 g·L-1STZ溶液(临用时用0.1 mol·L-1、pH 4.5 柠檬酸缓冲液配制,在 30 min 内注射完毕),剂量为60 mg·kg-1,3 d后在大鼠尾静脉采血检测血糖浓度,空腹血糖达到16.7 mmol·L-1为糖尿病大鼠。不达标者待血糖恢复至正常后再常规剂量注射。若出现死鼠则需按样本量补足。对照组:给予腹腔注射等量 0.1 mol·L-1、pH 4.5 柠檬酸缓冲液。
1.2.3 观测指标 造模后每4周取大鼠尾静脉血检测2组大鼠的空腹血糖浓度,并用裂隙灯观察2组大鼠晶状体的混浊情况。12周末,对照组和实验组随机选取10只大鼠(共20眼),取晶状体前囊膜行免疫组织化学染色;另对照组和实验组随机选取10只大鼠(共 20眼),取晶状体前囊膜行 Western blot检测胞浆及线粒体内Cyt C的表达;剩余10只大鼠(共20眼)取晶状体前囊膜行Western blot检测Caspase 3的表达。
1.2.4 方法
1.2.4.1 免疫组织化学法检测 Cyt C、Caspase 3的表达 12周末颈椎脱臼法处死大鼠,完整取出双眼球后娩出晶状体,用显微无齿镊撕取晶状体前囊膜,立即放入体积分数4%甲醛液中固定24~48 h,制成4 μm厚石蜡切片,应用免疫组织化学三步法检测LEC中Cyt C、Caspase 3的表达。一抗浓度均为1∶150,以PBS缓冲液代替一抗作为阴性对照。
1.2.4.2 Western blot检测Cyt C 的表达 将晶状体前囊膜组织剪成细小碎片,按线粒体提取试剂盒说明书制备线粒体蛋白样品与胞浆蛋白样品,BCA法测定蛋白浓度,SDS-PAGE凝胶电泳完毕后将蛋白转移至硝酸纤维素膜上,50 g·L-1脱脂奶粉封闭,用Cyt C抗体作用过夜,PBS液洗脱后与兔抗鼠IgG-过氧化物酶二抗结合,洗膜,ChemiDoc-It化学发光成像分析系统显影成像。
1.2.4.3 Western blot检测 Caspase 3 的表达 晶状体前囊膜组织碾磨成粉末,蛋白裂解液充分裂解后加入蛋白抽提剂,在4℃、12 000 r·min-1下离心10 min,保留蛋白膜,滴加1 mL纯乙醇后,在12 000 r·min-1、4 ℃条件下离心 3 min,制备蛋白样品,应用BCA法测定蛋白浓度,SDS-PAGE凝胶电泳,电泳完毕后蛋白转移至硝酸纤维素膜上,50 g·L-1脱脂奶粉封闭,用 Caspase 3抗体作用过夜,PBS液洗脱后与兔抗鼠IgG-过氧化物酶二抗结合,洗膜,Chemi-Doc-It化学发光成像分析系统显影成像。
1.3 结果判断 结果判断标准:胞浆中呈现棕黄色均匀着色,表明Caspase 3及Cyt C染色阳性。Western blot定量分析通过Quantity One软件测定灰度值。
1.4 统计学分析 本实验数据以均数±标准差表示,使用SPSS 17.0软件进行统计分析。两样本均数比较采用两样本t检验,重复测量设计资料的统计分析采用单变量方差分析(ANOVA法),重复测量数据不同时间点的两两比较采用 Bonferroni分析进行。P<0.05为差异有统计学意义。
2 结果
2.1 血糖监测结果 大鼠模型制作3 d后,实验组大鼠空腹血糖为(22.24±2.50)mmol·L-1,达到成模标准,至 12周末空腹血糖为(24.04±2.40)mmol·L-1,在实验过程中无明显波动。对照组大鼠血糖实验开始时为(5.13±0.52)mmol·L-1,实验结束时为(5.13±0.37)mmol·L-1,波动始终处于正常水平。
2.2 裂隙灯检查结果 整个实验过程中,可观察到实验组大鼠晶状体出现混浊(图1),对照组大鼠晶状体均透明(图2)。
2.3 免疫组织化学检测结果 实验组大鼠晶状体囊膜中Cyt C和Caspase 3呈阳性表达(图3-图4),但是在对照组表达呈阴性(图5-图6)。
2.4 Western blot检测结果
2.4.1 不同分组 Cyt C的表达特点 实验组大鼠LEC 线粒体 Cyt C 含量为0.510 5±0.026 4,对照组为0.846 0±0.033 5,2组比较差异有统计学意义(P<0.05);实验组大鼠胞浆Cyt C含量为0.928 0±0.029 7,对照组为 0.525 0±0.025 8,2 组比较差异有统计学意义(P<0.05)。实验组胞浆内 Cyt C含量增多,线粒体内Cyt C减少,说明在STZ诱导糖尿病大鼠LEC中Cyt C发生了位置转移,由线粒体释放到胞浆中。

Figure 1 Lens was trubid in experimental group 实验组大鼠晶状体混浊

Figure 2 Lens was transparent in control group 对照组晶状体透明
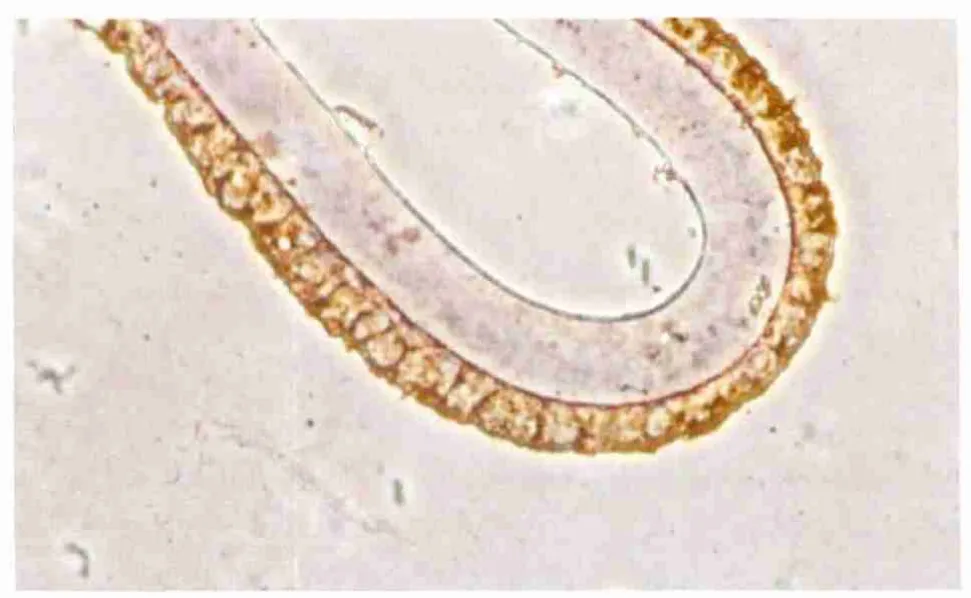
Figure 3 Expression of Cyt C in experimental group(×400) 实验组Cyt C表达情况(×400)
2.4.2 不同分组Caspase 3的表达特点 本实验结果显示,实验组大鼠 LEC中 Caspase 3表达量为0.906 0±0.027 6,对照组表达量为0.430 5±0.025 2,2组比较差异有统计学意义(P<0.05)。

Figure 4 Expression of Caspase 3 in experimental group(×400)实验组Caspase 3表达情况(×400)
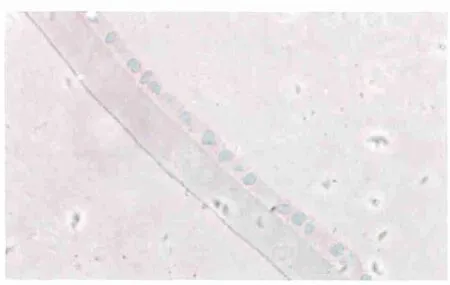
Figure 5 Expression of Cyt C in control group(×400) 对照组Cyt C表达情况(×400)

Figure 6 Expression of Caspase 3 in control group(×400) 对照组Caspase 3表达情况(×400)
3 讨论
糖尿病性白内障是糖尿病的主要慢性并发症之一[1],其主要的临床表现为晶状体发生混浊导致视力下降甚至失明,主要病理学改变是LEC的异常增殖、迁移、分化引起前后囊下的纤维化、混浊[2]。
LEC的凋亡可能是各种非先天性白内障的共同细胞学基础[3]。大量研究表明,将人晶状体上皮细胞(HLEC)培养于含高糖的培养基24 h后,细胞存活率显著下降,并能检测到细胞凋亡的发生[4-6];Nambu等[7]在大鼠 LEC中也观察到类似的结果。Takamura[8]在糖尿病动物模型亦发现LEC出现明显的凋亡特征。
由Fas/FasL介导的膜死亡受体通路和线粒体信号通路是细胞凋亡分子机制的关键信号转导通路。大量数据显示,线粒体不仅是真核细胞内主要的ATP生产中心,而且是调控细胞凋亡的中心环节。在凋亡信号的作用下,Bcl-2促凋亡蛋白被激活,形成线粒体外膜通道,使线粒体通透性转换孔(MPTP)呈不可逆的高水平开放状态,线粒体通透性发生改变,位于线粒体膜间隙的Cyt C等凋亡信号分子被释放入胞浆,与Apaf-1和Caspase 9前体结合形成凋亡体,随后激活Caspase 9,后者作为蛋白酶继续活化下游的凋亡效应分子 Caspase 3,激活 Caspase级联反应,发生DNA片段化、染色质浓缩等特征性改变,最终导致不可逆的细胞死亡[9-10]。
Caspase是一类以无活性前体酶原(pro-caspase)的形式存在于细胞中的蛋白水解酶家族。细胞受到凋亡刺激时,Caspase被激活并引发Caspase级联反应,最终导致细胞凋亡[11]。Caspase 3是细胞凋亡的主要效应因子,并与细胞凋亡的形态变化紧密相关[10]。Cyt C是一种由核基因编码的水溶性蛋白,位于线粒体内膜外侧呼吸链复合物Ⅲ与Ⅳ之间,是电子传递链复合体中的一个组成部分,在呼吸链中起电子传递的作用。研究表明[12],Cyt C不仅参与线粒体的能量代谢过程,而且是线粒体介导的细胞凋亡途径中不可或缺的重要因子,在凋亡过程中起着关键作用。当细胞受到凋亡刺激时,Cyt C mRNA表达上调,编码合成Cyt C增多,同时在凋亡刺激因子作用下,合成的CytC从线粒体释放入胞浆,激活Caspase级联反应导致细胞凋亡[13]。
本实验结果说明,STZ-糖尿病大鼠LEC中Cyt C由线粒体内释放到了胞浆中,通过激活Caspase 3从而启动细胞凋亡,导致白内障的发生。
1 Dedov I,Maslova O,Suntsov Y,Bolotskaia L,Milenkaia T,Besmertnaia L.Prevalence of diabetic retinopathy and cataract in adult patients with type 1 and type 2 diabetes in russia[J].Rev Diabet Stud,2009,6(2):124-129.
2 Brian G,Taylor H.Cataract blindness——challenges for the 21st century[J].Bull World Health Organ,2001,79(3):249-256.
3 Li WC,Kuszak JR,Dunn K,Wang RR,Ma W,Wang GM,et al.Lens epithelial cell apoptosis appears to be a common cellular basis for noncongenital cataract development in humans and animals[J].J Cell Biol,1995,130(1):169-181.
4 Wu ZM,Yin XX,Ji L,Gao YY,Pan YM,Lu Q,et al.Ginkgo biloba extract prevents against apoptosis induced by high glucose in human lens epithelial cells[J].Acta Pharmacol Sin,2008,29(9):1042-1050.
5 Zhang Z,Yao K,Jin C.Apoptosis of lens epithelial cells induced by high concentration of glucose is associated with a decrease in caveolin-1 levels[J].Mol Vis,2009,15(9):2008-2017.
6 Kim YS,Kim NH,Lee YM,Kim JS.Preventive effect of chlorogenic acid on lens opacity and cytotoxicity in human lens epithelial cells[J].Biol Pharm Bull,2011,34(6):925-928.
7 Nambu H,Kubo E,Takamura Y,Tsuzuki S,Tamura M,Akagi Y.Attenuation of aldose reductase gene suppresses high-glucose-induced apoptosis and oxidative stress in rat lens epithelial cells[J].Diabetes Res Clin Pract,2008,82(1):18-24.
8 Takamura Y.Apoptotic cell death in the lens epithelium of rat sugar cataract[J].Exp Eye Res,2003,7(1):51-57.
9 Fuchs Y,Steller H.Programmed cell death in animal development and disease[J].Cell,2011,147(4):742-758.
10 莫镜,崔其亮,姚君,张费通,谭小华.重组人白细胞介素-10对缺氧条件下人微血管内皮细胞凋亡的影响[J].实用儿科临床杂志,2012,27(14):1107-1110.
11 Garrido C,Galluzzi L,Brunet M,Puig PE,Didelot C,Kroemer G.Mechanisms of cytochrome C release from mitochondria[J].Cell Death Differ,2006,13(9):1423-1433.
12 Li K,Li Y,Shelton JM,Richardson JA,Spencer E,Chen ZJ,et al.Cytochrome C deficiency causes embryonic lethality and attenuates stressinduced apoptosis[J].Cell,2000,101(4):389-399.
13 Larsen BD,Rampalli S,Burns LE,Brunette S,Dilworth FJ,Megeney LA.Caspase 3/caspase-activated DNase promote cell differentiation by inducing DNA strand breaks[J].Proc Natl Acad Sci USA,2010,107(9):4230-4235.
