伴凝血障碍的隐源性脑缺血患者的预后分析
2014-11-12罗耀钦曾志磊张玉镇李金凤尹红蕾王运良
罗耀钦,曾志磊,张玉镇,李金凤,尹红蕾,王运良
对大部分缺血性卒中或短暂性脑缺血(TIA)患者来说,其卒中的病因学仍然未明。遗传性或获得性高凝状态的凝血障碍患者仅占脑缺血患者的很小一部分,虽然研究发现遗传学多态性如凝血因子Ⅴ(FVL)和凝血酶原G20210A基因突变与脑缺血有关[1],但对凝血障碍患者动脉缺血后的最佳二级预防措施仍缺乏必要的了解。与静脉血栓栓塞相比,动脉血栓复发的比例较高。有研究证实,具有血栓形成倾向的患者,在急性静脉血栓栓塞后6~12个月内口服抗凝药物是治疗的选择,对复发性静脉血栓栓塞或具有两种或两种以上血栓形成倾向,以及伴有抗磷脂抗体的患者推荐长期抗凝治疗,但对伴有凝血障碍的卒中患者不推荐抗血小板和抗凝治疗[2],也没有将凝血障碍的筛查作为卒中的常规检查项目,因此对成年缺血性卒中患者凝血障碍的发病率和预后结果存在较大争议。笔者的研究目的是以无明显原因的缺血性卒中或TIA患者为研究样本,筛查有无凝血障碍或其他特定的发病原因,探讨二级预防方案的选择,并对脑缺血事件进行前瞻性评估。
1 资料和方法
1.1 一般资料 2006年01月—2010年12月,选择入住解放军148医院、郑州大学第二附属医院神经内科诊断为急性缺血性卒中或TIA,年龄>18岁的成年患者。入院时经实验室检查、血液分析、常规血生化检查及凝血检查没有发现明显卒中病因学的隐源性脑缺血患者,排除出血性脑梗死、急性感染及入院后迅速恶化病死患者。入选306例患者,详细记录患者的人口学资料,心血管危险因素如高血压、糖尿病、高脂血症、吸烟史,存在的共病如TIA或卒中病史、房颤,口服抗凝药物或激素替代治疗等。入院时对每一患者应用美国国立卫生研究院卒中量表(NIHSS)评估卒中严重性,收集出院时二级预防治疗的临床资料。缺血性卒中定义是动脉供血区突发局部神经功能缺失≥24 h,TIA定义是动脉供血区突发局部神经功能缺失<24 h,CT或MRI排除颅内出血。神经血管成像包括颅内外动脉TCD检查、彩色超声多普勒、CT血管成像或血管造影检查。所有患者完成心电图、超声心动、经食管超声心动注射激活生理盐水评估心脏右向左分流。
1.2 方法 清晨抽取患者的肘静脉血检查患者的凝血功能,基因突变检查包括血浆凝血因子如G1691AFVL、抗活化蛋白C、G20210A凝血酶原突变,抗栓性血浆蛋白如蛋白S(PS)、抗凝血酶Ⅲ突变(ATⅢ),自身抗体诱导的凝血障碍如抗心磷脂IgG抗体和狼疮性抗凝物。隐源性卒中患者如上述检查一项或以上结果异常者归为凝血障碍组,检查完全正常者归为对照组。其中12例患者发现伴有左心房或左心室血栓形成,属于心源性卒中而排除在外,8例患者脑成像有血管炎表现也排除在外,共286例患者入组,所有患者或家属签署知情同意参与随访。该研究得到当地伦理委员会批准。
1.3 统计学分析 应用SPSS12.0统计程序软件包完成数据分析。患者的基本特征以百分比为分类变量,对连续变量以标准差或中位数表示。分类变量应用χ2检验,对NIHSS和Rankin分级应用Kruskal-Wallis检验。单变量分析用于复发性脑缺血事件的预测,Cox比例风险模型预测卒中复发的风险,以P<0.05为差异有统计学意义。
2 结 果
286例诊断为隐源性缺血性卒中或TIA患者进行特殊的凝血功能检查,其中225例(78.7%)患者无凝血功能异常,获得知情同意后作为对照组。61例(21.3%)患者至少1项凝血功能检查异常作为凝血障碍组,其中基因突变27例(44.3%),凝血蛋白缺乏 17 例(27.9%),自身抗体阳性 11 例(18%),基因突变伴凝血蛋白缺乏4例(6.5%),凝血蛋白缺乏伴自身抗体阳性2例(3.3%)。在27例基因突变患者中,FVL突变15例,抗活化蛋白C现象7例,凝血酶原G20210A基因突变3例,1例患者同时有FVL突变和抗活化蛋白C现象。17例凝血蛋白缺乏患者中蛋白C缺乏6例,蛋白S缺乏4例,7例为ATⅢ缺乏。11例自身抗体阳性患者7例存在抗心磷脂IgG抗体和4例有狼疮抗凝物。
两组间年龄无显著性差异。与对照组相比,凝血障碍组女性患者所占的比例较高,患有高血压、糖尿病和高脂血症比例高,女性口服避孕药比例也高。从发病情况看,凝血障碍组有卒中或TIA者高于对照组。两组间入院时Rankin分级也有明显不同,出院时接受抗凝作为二级预防的患者与对照组相比,凝血障碍基因突变的患者明显增多,伴有凝血蛋白缺乏或存在自身抗体,见表1。两组患者平均随访时间(3.0±1.2)年,凝血障碍组 11 例(18.0%)发生复发性缺血性脑血管事件,其中3例发生缺血性卒中,8例发生TIA,但没有发生出血性卒中。对照组19例(8.4%)患者发生复发性缺血性脑血管事件,见表2。其中12例缺血性卒中,7例TIA。3例发生脑出血。对凝血障碍组与对照组复发性缺血性脑血管事件的比例进行Log-rank检验,没有显示出统计学意义的差异。对3年后复发性缺血性卒中或TIA进行Kaplan-Meier评估,发现凝血障碍组为12.5%(95%CI,5.7%~21.1%), 而对照组为 8.2%(95%CI,5.2%~12.8%)。两组间调整潜在危险因素后,应用Cox回归分析复发性缺血性卒中的风险,没有发现明显不同,仅提示以前的脑缺血事件为两组患者复发性脑缺血事件的独立危险因素,凝血障碍亚型与抗栓治疗对复发性脑血管缺血事件无明显的预测作用,见表3。
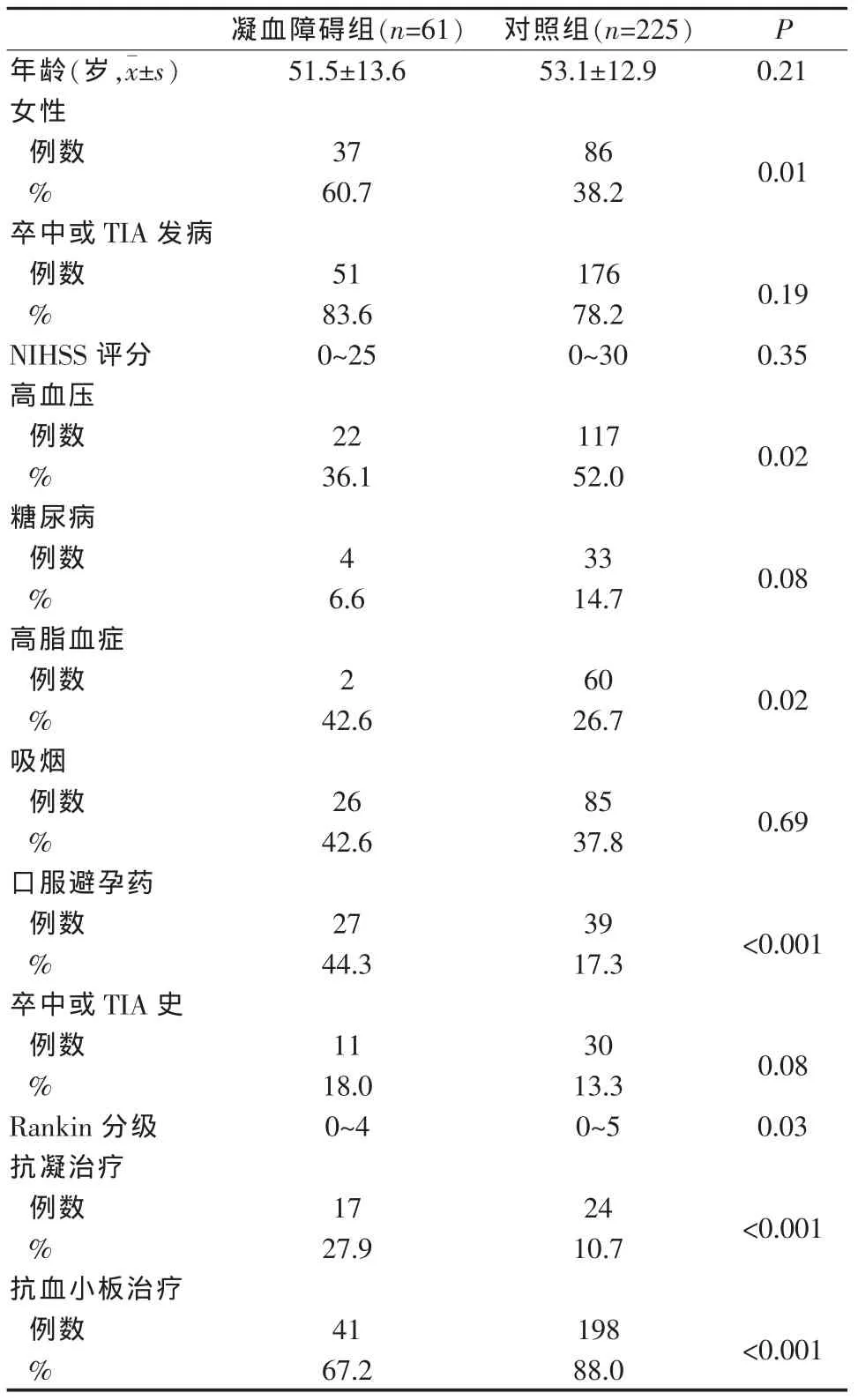
表1 两组隐源性缺血性患者的基本临床资料
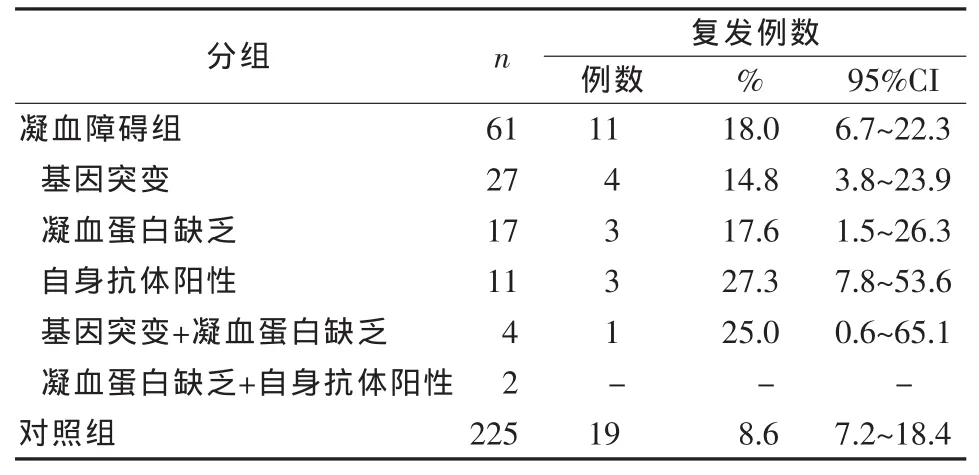
表2 两组隐源性缺血性患者的复发性脑缺血事件
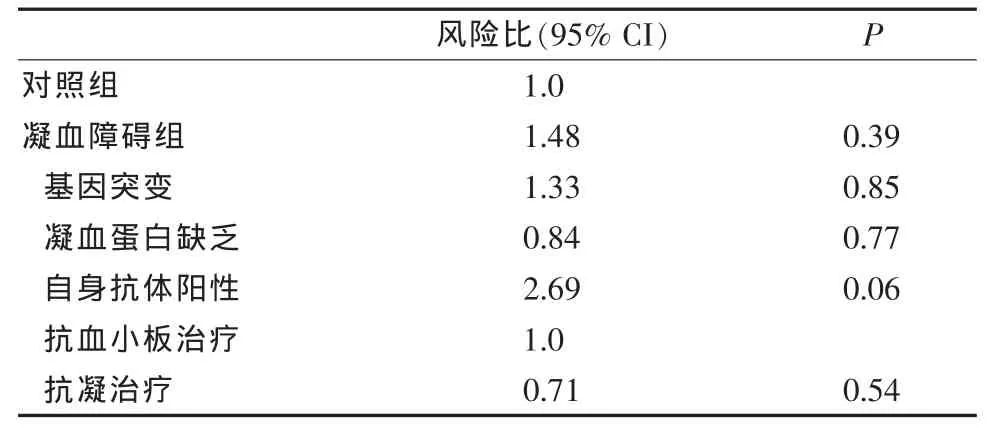
表3 Cox回归分析预测卒中复发风险
3 讨 论
缺血性卒中是临床上最常见的卒中类型,有关其病因、发病机制、临床治疗和预后国内外已进行大量研究,但对伴有凝血障碍的隐源性缺血性卒中患者二级预防过程中卒中复发的风险研究较少,国内还没见有详细的文献报道。本研究主要是观察伴有凝血障碍与无凝血障碍的缺血性卒中患者之间卒中复发的风险,对不明原因的缺血性卒中或TIA患者来说,伴有凝血障碍者没有增加复发性缺血性脑血管事件的风险,患者先前发生的缺血性卒中或TIA病史为复发性缺血性脑血管事件的独立危险因素。
在286例隐源性脑缺血患者中,21.3%的患者表现有遗传性或获得性血栓形成倾向的凝血障碍,低于国外的某些研究报道[3]。与无凝血障碍的缺血性卒中患者相比,凝血障碍组发病年龄相对较低。在凝血障碍亚型中,以基因突变最常见,其次为凝血蛋白缺乏和自身抗体阳性。与国外最近报道的55岁以下首次发生隐源性缺血性卒中以FVL因子或凝血酶原基因突变伴有卵圆孔未闭多见的研究相反[4],本研究发现卵圆孔未闭不是脑缺血复发的独立危险因素。最近一项对49岁以下首次发生缺血性卒中的患者对照研究发现,口服避孕药增加遗传多态性患者卒中的风险[5],但笔者发现妊娠、口服避孕药或绝经后激素替代治疗仅见于凝血蛋白缺乏患者,但很少见于基因突变患者,也可能是本研究的凝血蛋白缺乏患者受激素改变的影响,没能完全排除妊娠、口服避孕药或激素替代治疗女性的假阳性结果的缘故。笔者发现口服抗凝药物作为二级预防的患者基因突变明显增多,但抗栓治疗类型对以前的卒中或TIA复发无明显影响,抗血小板和抗凝治疗的缺血性脑血管事件复发的危险仅见于伴有抗磷脂抗体综合征的卒中患者。国外一项前瞻性随机双盲对照试验比较了华法林和阿司匹林对卒中的预防效果,在2年的随访期间,除抗磷脂抗体本身外,阿司匹林治疗组不增加血栓形成风险,但华法林治疗组也没有降低血栓形成的风险[6]。
据笔者所知,目前还没有对凝血障碍的成人缺血性卒中基因突变或凝血蛋白缺乏的前瞻性研究,以前的研究发现,伴有杂合性FVL因子阳性的缺血性卒中患者,与FVL因子阴性患者相比,5年内卒中复发率无明显不同[7]。笔者还发现FVL因子阳性的缺血性卒中患者接受华法林治疗多于阴性患者,但在阿司匹林或华法林作为二级预防期间,无论FVL因子阳性或阴性的缺血性卒中患者之间的卒中复发无明显不同。一项前瞻性研究观察324例缺血性卒中儿童,证实遗传性凝血障碍,包括FVL因子、凝血酶原、蛋白C、蛋白S和ATⅢ缺乏对卒中复发的影响,认为蛋白C缺乏和脂蛋白a升高是儿童缺血性卒中复发的独立危险因素[8]。最近开始的缺血性卒中风险与多态性研究(POLARIS)对缺血性卒中或TIA患者的复发性血管事件进行评估,内容包括FVL因子、凝血酶原、5,10亚甲基四氢叶酸还原酶突变等,尽管还没有结论性证据,但建议对伴有凝血障碍的成年缺血性卒中患者推荐长期抗凝治疗作为卒中的二级预防治疗。
笔者的研究受到某些限制,一是病例选择的偏见,没能包括所有的隐源性缺血性卒中或TIA患者。二是没有在脑缺血发作后3个月再次复查凝血功能,因为脑缺血的急性期可能导致凝血障碍的假阳性结果。三是没有对静脉血栓形成或女性流产的家族史进行评估,因这些因素可能与凝血障碍的发病率增加有关。但本研究没有发现缺血性卒中与获得性或遗传性凝血障碍患者增加脑缺血复发的风险,也没有证实口服抗凝或抗血小板治疗降低凝血障碍患者缺血性卒中复发的风险,这或许是由于笔者所观察的样本量较小,需要前瞻性随机对照的大样本研究,以证实伴有凝血障碍的缺血性卒中患者能否在长期抗凝治疗中获得益处。
[1] Ho WK,Hankey GJ,Quinlan DJ,et al.Risk of recurrent venous thromboembolish in patients with common thrombophilia:a systematic review[J].Arch Intern Med,2006,166(7):729-736.
[2] Lasek BA,Puz P,Kazibutowska Z.Patent foramen ovale and cryptogenic stroke,a statistical or cause-and-effect relationship:A neurological point of view[J].Postepy Kardiol Interwency J,2013,9(3):272-274.
[3] Rojo-Martinez E,Sandín-Fuentes M,Calleja-Sanz AI,et al.High performance of an implantable Holter monitor in the detection of concealed paroxysmal atrial fibrillation in patients with cryptogenic stroke and a suspected embolic mechanism [J].Rev Neurol,2013,57(6):251-257.
[4] Pristipino C,Anzola GP,Ballerini L,et al.Management of patients with patent foramen ovale and cryptogenic stroke: a collaborative,multidisciplinary,position paper:executive summary[J].Catheter Cardiovasc Interv,2013,82(1):122-129.
[5] Zenone T,Chan V.Young woman with recurrent ischemic strokes diagnosed as Fabry disease:lessons learned from a case report[J].Clin Neurol Neurosurg,2011,113(7):586-588.
[6] Dion F,Saudeau D,Bonnaud I,et al.Unexpected low prevalence of atrial fibrillation in cryptogenic ischemic stroke: a prospective study[J].J Interv Card Electrophysiol,2010,28(2):101-107.
[7] Markaki I,Franzén I,Talani C,et al.Long-term survival ischemic fcerebro vascular disease in the acute inflammatory stroke study,a hospital-based cohort described by TOAST and ASCO[J].Cerebrovasc Dis,2013,35(3):213-219.
[8] Darteyre S,Chabrier S,Presles E,et al.Lack of progressive arteriopathy and stroke recurrence among children with cryptogenic stroke[J].Neurology,2012,79(24):2342-2348.
