去氧胆酰酪氨酸对人类精子质膜完整性和细胞凋亡的影响
2014-11-12温成丽职瑞娜王玉柱李卫华丁训城
温成丽,职瑞娜,王玉柱,黄 超,李卫华,丁训城
(1.复旦大学公共卫生学院,上海 200032;2.上海市计划生育科学研究所国家计划生育药具重点实验室,上海 200032)
目前使用最广泛的阴道杀精剂壬苯醇醚-9,长期使用会导致阴道黏膜刺激症状并导致泌尿系统感染增加,因此新型高效、低毒兼具抗精子特异性活性的外用避孕化合物不断被发现,国内外正在对这些活性化合物进行抗精子靶标和机制的研究[1]。
胆酸及其衍生物去氧胆酸钠(sodium deoxycholate,SDC)是一类存在于人体胆汁中的天然的表面活性物质。Courtot等[2]证实,它们具有杀灭精子作用,而且能抑制人免疫缺陷病毒-1(human immunodeficiency virus-1,HIV-1)的复制,这类胆酸衍生物的细胞毒性较低,对人的肠黏膜细胞没有任何损害作用。为进一步提高药效,降低副作用,在保留胆酸可能的药效基团的基础上,对其侧链部位用氨基酸进行了结构修饰,合成了新的胆酸衍生物去氧胆酰酪氨酸(deoxycholyltyrosine,DCT),相对分子质量558.0。DCT还具有较强的抗HIV-1活性,其 IC50为(21.50 ±3.2)mg·L-1,并可抑制 HIV逆转录酶活性[3]。也有研究报道,HIV病毒膜对DCT具有选择性的吸收,聚集于富含磷脂的HIV磷脂双分子层中,直接灭活HIV-1病毒[4]。至于DCT灭活人类精子,其抗精子靶标和作用机制目前还未见报道。
为探索DCT灭活人类精子的生物学特征,本研究利用荧光染色剂与流式细胞术相结合技术,从精子凋亡反应及质膜完整性(plasma membrane integrity,PMI)角度,对人类精子结构和功能状态特别是精子凋亡和质膜完整性进行检测。在传统显微镜检查和CASA分析常规评估终点的基础上,将DCT对精子药效从定性描述转化到定量的高通量多参数的分析,增加敏感特异的分子水平上的评价终点[5],从而为下一步探讨DCT对精子作用的候选靶标以及设计新型外用避孕药提供科学依据。
1 材料与方法
1.1 主要试剂及仪器
精子培养液(Earle's balanced salt solution,EBSS);络合异硫氰酸荧光素(FITC)标记的AnnexinⅤ细胞凋亡试剂盒(美国Becton Dickinson公司);LIVE/DEAD Sperm Viability Kit(L-7011)(美国Invitrogen Molecular Probes公司);碘化丙啶(PI,美国Sigma公司);DCT,本课题组合成。计算机辅助精液分析系统(北京清华同方股份有限公司);流式细胞仪(FACS Calibur,美国BD公司);荧光显微镜(BX41,日本Olypus);低速冷冻离心机(美国Eppendorf公司)。
1.2 精液标本的采集
2012年12月-2013年4月就诊于上海市计划生育科学研究所医院门诊部的男性,年龄25~35岁,禁欲3~8 d,自慰法收集精液,取符合WHO标准的正常精液(在0.5 h内液化、精液量>2 mL、pH值7.0 ~7.7、精子活率 >70%)用于本课题的研究。使用之前先用上游法进一步获得高活力精子,并将精子样本调节至密度为1×1010L-1备用。本研究经本研究所伦理委员会批准,精液标本捐献者知情同意,标本在完成实验后,全部高温杀灭。避免多人精液混合精子出现凝集,实验采用同一人的精样。
1.3 精子上游法获得高活力精子
将符合WHO标准的精液标本置于锥底离心管中,300 ×g 离心10 min,弃精浆,留0.2 ~0.4 mL沉淀精子液。取含8 mL EBSS(含0.4%牛血清白蛋白)的锥底离心管,将沉淀精子液小心加到EBSS液下方,并将试管倾斜40°置于37℃,5%CO2培养箱中孵育1.5 h。轻轻吸取试管上层呈云雾状含精子的EBSS液约2 mL。在300×g离心3 min,弃上清。用0.5 mL EBSS液重悬精子沉淀团,获得高活力精子悬液,调节精子密度为1×109L-1。
1.4 精子活率与运动参数的测定
取50 μL高活力精液,分别置入DCT终浓度分别为0,0.25,0.50 和1.0 g·L-1的96 孔板中,混匀。20 min后分别吸取混合后的精子悬液约10 μL用CASA进行分析,获得精子活率和(a+b)级精子活力的检测百分比。
1.5 流式细胞仪检测质膜完整性
将高活力精子样本用EBSS精子培养液调节密度为1×109L-1。取200 μL精子悬液分别置入含200 μL 37℃预温的EBSS空白溶液和DCT溶液(浓度分别为 0.25,0.50 和 1.0 g·L-1)的1.5 mL离心管中。于37℃,5%CO2孵箱避光孵育20 min,300 × g 离心 5 min,弃上清,用 400 μL EBSS精子培养液重悬。取其中200 μL悬液放入1.5 mL离心管中,加入 SYBR-14(终浓度100 nmol·L-1)和PI(终浓度12 μmol·L-1)各1 μL,混匀后 37℃,5%CO2孵箱孵育 20 min,离心,弃上清。再用EBSS精子培养液清洗2次,300×g离心5 min,除去游离多余荧光染料。最后用400 μL EBSS液重悬,经流式细胞仪检测。每份悬液样本获取10 000个精子。
1.6 荧光显微镜观察质膜完整性[6]
取1.5项SYBR-14/PI染色后的各组精子悬液10 μL涂于玻片上。空气干燥后,在400倍荧光显微镜下观察。每张涂片计数200个精子,以绿色荧光精子占检测精子百分率表示,计算检测样品精子质膜完整率,以质膜完整精子占检测精子总数百分率表示。
1.7 AnnexinⅤ/PI流式细胞仪分析精子凋亡
按照1.5项将精子与DCT混合后,吸取其中200 μL EBSS 精子悬液,加入 AnnexinⅤ-FITC 和PI各10 μL,混匀,于 37℃,5%CO2培养箱避光孵育20 min,300×g离心8 min,弃上清,用EBSS液洗涤2次。加入200 μL EBSS液重悬,通过流式细胞仪测定染色情况。每份样品记录10 000个精子。
1.9 统计学分析
2 结果
2.1 DCT对精子活率和活力的影响
DCT 0.25 g·L-1组精子活力和活率下降为空白对照组的1/2,DCT 0.50 g·L-1组活力和活率下降为空白对照的1/10 和1/20,1.0 g·L-1组几乎无存活精子存在(表1)。不同浓度DCT对精子活率和活力均具有明显的抑制作用(P<0.05),且是精子活率及活力均显示出随着DCT浓度的增加而降低的趋势(r活率=0.91,r活力=0.88,P <0.05)。

Tab.1 Effect of deoxycholyltyrosine(DCT)on sperm viability and motility
2.2 DCT对质膜完整性的影响
2.2.1 流式细胞仪结果
流式细胞仪检测结果(图1)及定量数据结果如表2所示,空白对照组活精子百分率显著高于DCT处理组(P<0.05)。随着DCT浓度的增加,死亡精子百分率,即质膜破损精子百分率逐渐升高,DCT 0.25,0.5 和1.0 g·L-1时质膜破损的死精子百分率分别 为 (54.3 ± 9.8)%,(73.8 ± 3.5)% 和(80.6±8.3)%,与空白对照组具有明显差异(P<0.05),并具有较好的浓度依赖性(r=0.91,P <0.05)。实验结果表明,随着DCT浓度的升高,质膜损伤精子百分率逐渐升高,正常精子百分率出现下降趋势,DCT 0.50 g·L-1组濒死精子百分率较高,随着浓度升高濒死精子质膜逐渐被破坏成为坏死精子。
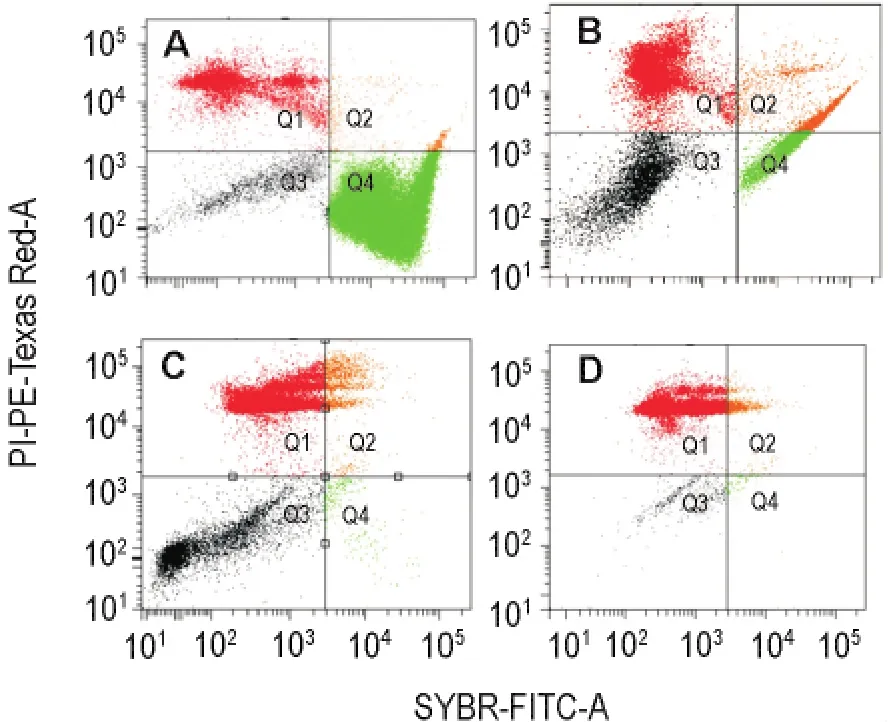
Fig.1 Effect of DCT on membrane integrity of human sperm by flow cytometry.See Tab.1 for the treatment.A:control group;B:DCT 0.25 g·L -1;C:DCT 0.5 g·L -1;D:DCT 1.0 g·L -1.

Tab.2 Effect of DCT on membrane integrity of human sperm
2.2.2 荧光显微镜观察
荧光显微镜观察显示,DCT作用后精子分为3个亚群,质膜完整的活精子呈边缘光滑均匀淡染的绿色荧光,为SYBR-14阳性染色(图2A);而死亡精子的质膜受损,染色剂PI进入精子内部与核染色,使之呈现均匀弥漫的红色荧光,为PI阳性染色(图2D);同时,染上并发出2种荧光的双阳性机子,正处于从活向死的过渡状态(图2B,C)。

Fig.2 EffectofDCT on membrane integrity by fluorescence microscopy(×400).See Tab.1 for the treatment.A:control group;B:DCT 0.25 g·L -1;C:DCT 0.5 g·L -1;D:DCT 1.0 g·L -1.
2.4 DCT对人精子凋亡的影响
图3及各象限数据结果(表3)结果显示,与空白对照组比较,DCT 0.5 g·L-1使精子的早期凋亡率升高到(9.7 ±0.7)%(P <0.05),浓度为 1.0 g·L-1时,其早期凋亡率反而下降至(2.4±0.9)%,差异无统计学意义(P>0.05),说明DCT对精子早期凋亡率具有双向性。DCT 0.25,0.5 和1.0 g·L-1各组的人精子晚期凋亡率均明显升高,且差异有统计学意义(r=0.98,P <0.01)。

Fig.3 Effect of DCT on sperm apoptosis by AnnexinⅤ-FITC/PI staining.See Tab.1 for the treatment.A:control group;B:DCT 0.25 g·L -1;C:DCT 0.5 g·L-1;D:DCT 1.0 g·L -1.

Tab.3 Effect of DCT on apoptosis of human sperm
3 讨论
本研究显示,DCT对精子具有明显的杀伤作用,可望作为新型外用避孕药进行研发。随着DCT浓度的升高,精子活力、活率呈现下降趋势。质膜完整性检测结果显示,随着DCT浓度的升高,存活精子比例逐渐降低,死亡精子比例逐渐升高。DCT≤0.5 g·L-1引起精子早期凋亡率升高,但是高浓度时却出现降低趋势。精子晚期凋亡率随着浓度的升高呈现明显增高的趋势。
本研究发现,DCT 1.0 g·L-1可使精子的活力为0,不存在具有生殖能力的a级和b级精子。精子活率此时为(0.2±0.5)%,这主要是由活力较差的c级精子组成,其活力已不能够达到受精的要求。这一结果显示,DCT与现在市售的具有阴道刺激性的壬苯醇醚-9的杀精效能(最低杀精浓度0.35 g·L-1[7])相似。
精子质膜是精子最外层的细胞结构,用以维持和调节胞内成分,其结构与生理的完整性对维持精子存活、运动和生化代谢是十分重要的[8]。本实验结果显示,DCT作用后质膜完整精子比例逐渐下降,质膜破损精子比例不断上升,提示DCT对精子的质膜具有明显的损伤作用。濒死精子比例不具有明显的浓度依赖性,这可能是因为随着DCT浓度升高,濒死状态的精子逐渐死亡,从而使得死亡精子比例升高有关。
凋亡不仅发生于睾丸生精上皮中的生精细胞,也可以发生在精子水平,但过度的凋亡可能是导致精子的受精能力下降的原因之一[9]。AnnexinⅤ检测精子凋亡结果表明,DCT处理组的精子晚期凋亡及坏死率均随浓度增高而升高,且具有浓度-效应关系。
DCT诱发人类精子凋亡,且以晚期凋亡增高为特点,且与精子质膜完整性实验结果基本一致,可能是随着DCT浓度升高,精子质膜结构发生变异加剧破损,膜渗透性增高,由早期凋亡转变为晚期凋亡及坏死精子,其活力和受精能力必然丧失,最后引起精子死亡。焦立飞等[10]认为,此凋亡可能与过自杀受体(Fas/FasL)途径或线粒体途径激活胱天蛋白酶,并作用到下游的酶切底物,进而产生一系列的级联反应,最终导致细胞凋亡有关。综上所述,DCT一类化学因素以浓度依赖性方式诱发精子“过度”凋亡而导致精子受精能力丧失。且均与精子质膜完整性、通透性和稳定性密切相关。
本研究采用定性和定量相结合的方法研究DCT对精子质膜和凋亡的影响,虽然采用多次实验的方法控制随机误差,但是鉴于机器对于声音和振动的敏感性,本实验活力和活率数据可能存在误差。另外,精子的凋亡受到多种基因的控制,应进一步探讨DCT作用于精子凋亡的线粒体途径及其相关调控基因如Fas/FasL和Bcl-2/Bax的表达。因此,DCT诱导致人类精子细胞凋亡的机制还有待于继续深入研究。
[1]Anton E,Krawetz SA.Spermatozoa as biomarkers for the assessment of human male infertility and genotoxicity[J].Syst Biol Reprod Med,2012,58(1):41-50.
[2]Courtot AM,Nikas G,Gravanis A,Psychoyos A.Effects of cholic acid and'Protectaid'formulations on human sperm motility and ultrastructure[J].Hum Reprod,1994,9(11):1999-2005.
[3]Li WH,Liu SW,Liu Y,Lu H,Wang YZ,Jiang SB,et al.In vitro spermicidal and anti-HIV effects of deoxycholyltyosine[J].Reprod Contraception(生殖与避孕),2007,27(10):661-666.
[4]Al-Jabri AA,Wigg MD,Elias E,Lambkin R,Mills CO,Oxford JS.In vitro anti-HIV-1 virucidal activity of tyrosine-conjugated tri-and dihydroxy bile salt derivatives[J].J Antimicrob Chemother,2000,45(5):617-621.
[5]Wen CL,Xia MJ,Wang YZ,Li WH.Application of flow cytometry in evaluating spermicidal function of topical contraceptive[J].Reprod Contraception(生殖与避孕),2013,33(1):48-54.
[6]Garner DL, Johnson LA.Viability assessment of mammalian sperm using SYBR-14 and propidium iodide[J].Biol Reprod,1995,53(2):276-284.
[7]Li RX,Hu ZH,Fan GR,Zhou YC,Chen ZS,Zong WP.Observation of the antifertility effect of the new type NP-9 membranes in rabbits and spermicidal test in vitro and in vivo[J].Reprod Contraception(生殖与避孕),2010,30(12):800-805.
[8]Aziz N,Said T,Paasch U,Agarwal A.The relationship between human sperm apoptosis,morphology and the sperm deformity index[J].Hum Reprod,2007,22(5):1413-1419.
[9]Aitken RJ,De Iuliis GN.On the possible origins of DNA damage in human spermatozoa[J].Mol Hum Reprod,2010,16(1):3-13.
[10]Jiao LF,Yan CH,Zhao J,Jia L,He J,Peng SQ.Reproductive toxicity of low-level chlorpyrifos repeated exposure and its mechanisms in male rats[J].Chin J Pharmacol Txicol(中国药理学与毒理学杂志),2011,25(6):568-575.
