改良方法制备的血管性痴呆模型大鼠的学习记忆能力表现
2014-11-12马婧怡张万鑫刘春丽金晓敏
马婧怡,张万鑫,陈 虹,丁 慧,刘春丽,金晓敏
(石河子大学药学院教育部新疆特种植物药资源重点实验室,新疆石河子 832002)
血管性痴呆(vascular dementia,VD)是指脑血管病变引起脑损害后所导致的痴呆,以记忆、认知功能缺损为主,同时还伴有语言、运动、视空间障碍以及人格障碍[1]。是目前为止唯一可以防治的痴呆,如果能够早期发现并积极防治有逆转的可能性[2]。目前VD的研究已成为医药学界诸多学者关注的重点,因而制作理想的动物模型对探究VD的发病机制及新药开发至关重要。既往许多学者曾采用各种脑缺血模型进行VD模型的制作,包括最为经典的双侧颈总动脉永久性结扎法,国际公认的VD造模方法:pulinsin-四血管阻断法,双侧颈总动脉缺血再灌注法,栓塞法以及复合VD造模方法等。其中栓塞法又包括光化学诱导栓塞法、线栓法、微血栓颗粒造模法(血凝块栓子栓塞法)、颅外安置小磁铁吸附经尾静脉注入四氧化三铁的方法。复合VD模型的建立包括高血压加双侧颈动脉缺血再灌注血管性痴呆模型、高血脂加四血管阻断法制作VD模型[3]。诸多模型都各有其优缺点,因此,应当针对研究内容及所需重点选择出更为合适的建模方法。本实验采用两种改良后的成熟方法制作VD模型,旨在探讨比较该两种改良方法制备的VD模型的成模可信程度。为后期进一步深入研究防治VD的药物奠定实验基础。
1 材料与方法
1.1 主要药品及仪器
水合氯醛(天津市福晨化学试剂厂),多聚甲醛(天津市科密欧化学试剂有限公司,批号:20060714),HM-202型十万分之一天平(日本A&G有限公司),DMS-2型Morris水迷宫(中国医学科学院药物研究所);CM3050型恒温冰冻切片机(德国Leica公司);MIC0266型倒置显微镜(德国Zeiss公司)。
1.2 动物及模型制备
36只雄性SD大鼠,清洁级,体质量250~350 g,购自新疆维吾尔自治区实验动物研究中心,许可证编号SCXK(新)2011-0002。随机分为不同时点永久性结扎双侧颈总(改良2-VO)、改良大鼠大脑中动脉梗死/再灌注(改良MCAO/R)、假手术组,每组12只。
1.2.1 改良2-VO模型制备
采用不同时点永久性结扎双侧颈总(改良2-VO)的方法[4],即采用每间隔3 d分2次永久性结扎大鼠双侧颈总动脉法制备模型。
1.2.2 改良MCAO/R模型制备
采用左侧切口、不分离翼腭动脉等改良手段制备改良大鼠大脑中动脉梗死模型[5],并将栓线尾部略露出皮肤,缝线略作固定。在栓线置入2 h后再次麻醉大鼠,由露出皮肤的栓线尾部将栓线柔和缓慢地抽出,当栓线前端膨大处遇到颈外动脉(ECA)结扎线时会有阻力,即停止拔线,剪除栓线的残余末端,完成改良MCAO/R模型制备。
假手术组只分离大鼠双侧颈总动脉、颈外动脉、颈内动脉,但不做任何结扎及鱼线插入,其余步骤缝合伤口,每日碘伏消毒。
1.3 Morris水迷宫实验
根据文献[4],参照Morris实验方法进行,于术后第15天开始。实验历时7 d,训练第1天(术后第15天)让大鼠自由游泳2 min;从第2天(术后第16天)起,每天分上、下午两段,每段训练4次。训练时随机选择一个入水点,将大鼠面向池壁放入水中,系统自动记录大鼠找寻并爬上平台时所需时间(逃避潜伏期)及运动轨迹,每次训练间隔为60 s。如果大鼠在120 s内未找到平台,须将其引至平台,这时潜伏期计为120 s。于训练第7天(术后第21天)撤除水下平台,在同一入水点将大鼠面向池壁放入水中,系统将自动记录其在120 s内跨过原平台相应位置的次数及运动轨迹。于术后第41天及第42天,同上述操作,再次观察各组大鼠的逃避潜伏期及平台穿越表现。
痴呆标准是以实验组大鼠的各时段成绩的平均逃避潜伏期与假手术组逃避潜伏期的均值之差占该鼠平均逃避潜伏期的比例来判定的。该值>20%为痴呆大鼠[6]。其中,若该值>20%≤30%为轻度痴呆,>30%≤40%为中度痴呆,>40%为重度痴呆。
游泳轨迹靠通过观察动物入水后寻找平台来确定。随机式的搜索轨迹往往出现在水迷宫大部分区域,带有很大的盲目性;边缘式是一种沿池壁以大幅度轨迹搜索平台的方式,这是一种本能行为,处于较低级的认知水平;趋向式是以曲线逐步向平台靠拢,是一种较高级的策略,但定位不够准确;直线式为从起点以直线方式向平台搜索,表明有明确的空间定位。通过记录各组大鼠在水迷宫实验期间每天第一次入水时所采用的搜索策略方式,计算出各组搜索策略方式为直线式和趋向式的大鼠个数之和进行统计分析。
1.4 HE染色观察大鼠海马组织CA1区组织结构的变化
水迷宫实验结束后第2天,大鼠ip给予10%水合氯醛(3.5 mL·kg-1)麻醉迅速断头取脑,去掉嗅脑、小脑及低位脑干,取视交叉后4 mm与小脑前之间的部分,将脑组织置于4%多聚甲醛中浸置4~6 h(4℃)。
将多聚甲醛浸置后的脑组织常规脱水、透明、浸蜡包埋,连续冠状切片,每张切片厚约5 μm,进行HE染色在倒置荧光相差显微镜下观察切片并拍照。
1.5 统计学分析
2 结果
2.1 改良模型大鼠逃避潜伏期表现
表1结果显示,与假手术组相比,两模型组逃避潜伏期均延长(P <0.05,P <0.01),尤以改良2-VO组的逃避潜伏期最长,改良MCAO/R组次之,而改良MCAO/R组到术后第41天与假手术组已无显著性差异。
自术后第19天(水迷宫定位航行实验进行第4天)起,改良MCAO/R组与改良2-VO组逃避潜伏期出现显著性差异(P<0.05),2-VO组显著延长,直至术后第41天,显著性差异最为明显(P<0.01)。

Tab.1 Escape latency of rats in improved permanent bilateral common carotid artery occlusion(2-VO)and improved middle carebral artery occulsion(MCAO/R)models
与同组术后第41天潜伏期相比,假手术组自实验进行第4天起趋于平稳(P>0.05),而两模型组均与术后第41天形成显著性差异;与术后第41天比较,术后第20天延长,改良MCAO/R组显著延长(P <0.01),改良2-VO 组次之(P <0.05)。
术后72 h内,改良2-VO组中有1只大鼠,死于呼吸困难;改良MCAO/R组共有3只动物死亡,其中1只死于呼吸困难,2只于拔栓线后死亡,假手术组大鼠无死亡。结合潜伏期数据,计算可知,术后41d时,改良2-VO组痴呆大鼠10只,其中2只为轻度痴呆,7只为中度痴呆,1只为重度痴呆。改良MCAO/R组痴呆大鼠7只,其中3只为轻度痴呆,2只为中度痴呆,2只为重度痴呆。
2.2 改良模型大鼠平台穿越表现
表2结果显示,与假手术组比较,两模型组穿越平台次数均减少,尤以改良2-VO组最为突出。术后第21天,2-VO和MCAO/R组穿越次数显著减少(P<0.01),并且2-VO组显著低于MACO/R组(P<0.01);术后第42天,2-VO组穿越次数依旧显著低于假手术组,但MACO/R组已恢复至假手术组水平。
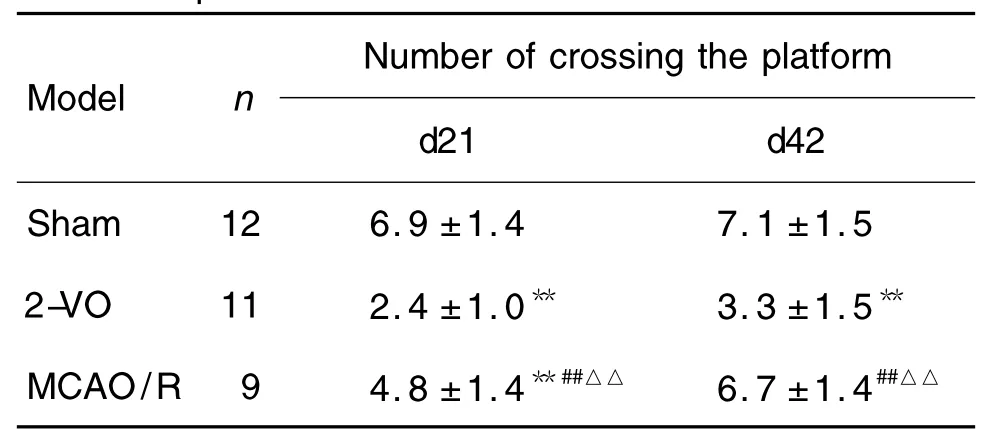
Tab.2 Number of crossing platform of rats in improved 2-VO and improved MCAO/R models
2.3 改良模型大鼠游泳轨迹表现
通过摄像头记录轨迹,各组以趋向式及直线式为搜索策略的大鼠个数之和如下表3所示。其中假手术组大鼠的游泳轨迹多为趋向式和直线式,对空间方向的辨别力较高;而改良2-VO组游泳轨迹多为边缘式和随机式,对空间方向辨别力很低;改良MCAO/R组从水迷宫航行实验进行第4天起,搜索策略大部分改变。通过χ2检验可知,从水迷宫航行实验进行第3天(术后第18天)起,每天的χ2值分别是 7.020;8.440;9.812;10.451;13.124 和14.470,且均 P <0.05。
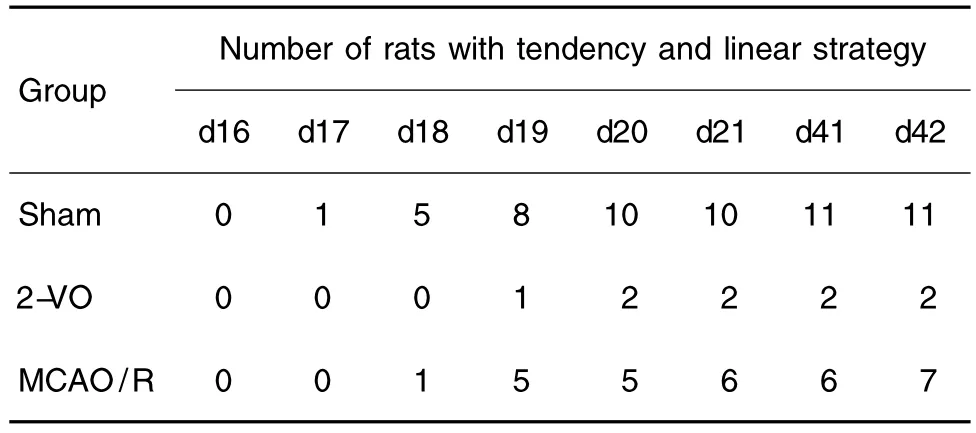
Tab.3 Total number of tendencies and linear strategies of improved 2-VO and improved MCAO/R models
2.4 改良模型大鼠海马组织CA1区组织结构变化
HE 染色后,两模型组(图1A,1B,1C,1D)的大鼠海马CA1区细胞数目减少,细胞排列紊乱稀疏,细胞形态不完整,结构不正常,胞浆稀少,胞核与胞浆界限模糊,细胞核深染,固缩呈三角形或不规则形,核仁不明显,并出现增生胶质细胞。尤以改良2-VO组(图1A,1B)最为严重,改良MCAO/R组(图1C,1D)次之;假手术组(图1E,1F)大鼠海马CA1区细胞数目多,排列整齐紧密,细胞形态完整,结构正常,胞浆丰富,胞核与胞浆界限清晰可见,核仁明显。

Fig.1 Morphological changes of hippocampus CA1 area of improved model rats(HE staining).A:improved 2-VO group(×200);B:improved 2-VO group(×400);C:improved MCAO/R group(×200);D:improved MCAO/R group(×400);E:sham group(×200);F:sham group(×400).Arrows show proliferative glial cells and incomplete cells.
3 讨论
本研究结果显示,两模型组学习记忆能力显著性下降,至术后第41天改良2-VO组仍具有明显的学习记忆能力下降现象,而改良MCAO/R组在20 d时学习记忆能力确实有下降现象,但至术后第41天该现象已消失,这说明该组大鼠记忆能力显著提高,空间探索及搜索策略结果也再次证实这一点。同时通过各组训练的每一天与同组术后第41天的潜伏期比较可看出除假手术组于训练后第4天起成绩趋于平稳外,两模型组均有学习记忆能力提高的现象,可能是由于术后随时间的增加大鼠自身的修复所造成。而值得注意的是,同组间的术后第21天与第42天穿越平台次数比较中,仅有改良MCAO/R组出现显著性差异,这与潜伏期所得结果不一致。分析原因可能是由于潜伏期的计算是将每只大鼠的每天上下午两段,共8次潜伏期求平均,中间掺杂了瞬时记忆的影响。而空间探索则是在所有训练后第一次入水的记忆能力体现,更具代表性,但这需要进一步的实验证实。针对目前结果而言,能够证实的是虽然两模型组均有自我修复过程,但改良2-VO组的程度远小于改良MCAO/R组,或者说在术后42 d内这种修复能力对于模型成功与否的影响是很小的,而改良MCAO/R组却因为这种修复而导致随时间的推移,模型逐渐不成立。
以改良2-VO法导致痴呆的大鼠,在结扎术后42 d学习记忆能力仍无恢复趋势,这将有利于药物疗效的长期动态观察,该模型是以慢性低灌注引起脑缺血缺氧,最终导致神经细胞功能下降、学习记忆功能障碍,较好地模拟了人因动脉粥样硬化、动脉管腔狭窄等因素导致的VD,且手术过程简单易行,相对稳定。但仅结扎双侧颈总动脉,由于大脑动脉环的代偿作用,侧支循环的建立,难以达到理想的脑缺血。
改良MCAO/R法制作的模型具有明确缺血灶[7],成型时长短,可重复性强的特点。但随着时间的延长,其大鼠的学习记忆能力有显著性恢复。这是由于再灌注模型主要是脑的急性缺血再灌注损伤所致,没有双侧颈总动脉结扎后的长期低灌注缺血的影响,虽然在造模后的20 d内时与假手术组比较具显著性差异,至42 d却已无明显差异,脑功能恢复较为明显,该结论与以前文献报道相符[8],且大鼠栓塞性脑缺血再灌注与人群常见的VD存在一定差异。
综上,改良2-VO法及改良MCAO/R法模拟VD均可导致大鼠出现学习记忆障碍,大鼠海马组织CA1区组织结构均发生改变,因此这两种方法均可行。其中改良2-VO模型更适用于较长时期的药物疗效研究,操作简便,且模型稳定。而改良MCAO/R模型是较为理想的短期药效研究或预防药物疗效研究的造模方法之一。
[1]Wang MY,Zhu Y,Liu XL.Treatment of vascular dementia[J].Shandong Med J(山东医药),2007,47(35):115-116.
[2]Gorelick PB.Status of risk factors for dementia associated with stroke[J].Stroke,1997,28(2):459-463.
[3]Hu R,Zhong XM.The summary of researching on the animal model of mice with vascular dementia[J].J Zhejiang Univ Tradit Chin Med(浙江中医药大学学报),2008,32(1):137-138,140.
[4]Huang XW,Li H,Qin DL,Chen MJ,Zhang H,Zhang Z.The model of VD rats was established by the method of ligation bilateral common carotid artery at two times[J].Chin J Gerontol(中国老年学杂志),2010,30(14):2006-2007.
[5]Yang ZZ,Chen H.Improvement and experience in suture methods for rat model of focal cerebral ischemia[J].Lishizhen Med Mater Med Res(时珍国医国药),2008,19(9):2189-2190.
[6]Zhao XL,Fang XB,Li DP.Establishing vascular dementia model in rats[J].J Chin Med Univ(中国医科大学学报),2002,31(3):166-167,176.
[7]Yin JX,Tian JZ,Huang QF,Cheng L,Shi J,Wei CB,et al.MCAO to vascular dementia model in rats[J].Chin J Pathophysiol(中国病理生理杂志),2003,19(8):1144-1147.
[8]Ni J,Ohta H,Matsumoto K,Watanabe H.Progressive cognitive impairment following chronic cerebral hypoperfusion induced by permanent occlusion of bilateral carotid arteries in rats[J].Brain Res,1994,653(1-2):231-236.
