鹿血中甾体化合物的分离与结构鉴定
2014-11-09徐德平吴盼盼
袁 媛, 徐德平, 吴盼盼
(江南大学 食品学院,江苏 无锡 214122)
鹿血为鹿科动物梅花鹿(Cervus nippon)和马鹿(Cervus elaphus)的血液,是传统名贵中药[1-2]。近年来,运用现代医学手段,进行临床研究和动物比较试验,发现鹿血具有抗衰老、抗疲劳、调节免疫、补血、美容、补肾益精、抗辐射等作用[3-5],是一种集预防、医疗、保健作用于一体的滋补品[6]。据文献报道,鹿血的化学成分非常复杂[10-14],国内外对鹿血具体化学成分的结构研究还未见报道,特别是鹿血甾体化合物,仅有范玉林等在鹿茸中发现过此类物质[15]。现有文献报道都是用标准品,利用HPLC对鹿血活性成分进行定性、定量研究,对鹿血中未知的激素并不能测定[16]。目前,仅发现其含常见几种甾体化合物,如睾丸酮(testosterone)、雌二醇(estradiol)[17-18],对鹿血甾体化合物的分离、结构鉴定还未见报道。
鉴于以上原因,用乙醇提取,多种色谱柱分离,采用TLC、1HNMR,和13CNMR等方法对鹿血化学成分进行研究,以探明鹿血化学成分与功能活性之间的关系,为鹿产品的进一步开发提供理论依据。
1 材料与方法
1.1 材料与试剂
鹿血,安徽五星集团提供;GF254硅胶板,山东烟台芝罘化工厂产品;MCI柱,日本三菱化学公司产品;ODS柱、ODS-A柱、ODS-B柱,日本东曹株式会社产品;无水乙醇、丙酮、硫酸、茴香醛、冰醋酸、甲醇、正丁醇均为分析纯,上海国药集团化学试剂有限公司产品。其他试剂均为国产分析纯。
1.2 仪器与设备
RE52CS旋转蒸发器,上海亚荣生化仪器厂制造;ZF-90型暗箱式紫外透射仪,上海顾村电光仪器厂制造;CQ-005型萃取罐,常州市特威电气自动化系统有限公司制造;R-1002型旋转蒸发仪,上海申顺生物科技有限公司制造;SYB06-100型恒流泵,BS-100A自动部分收集器,上海沪西分析仪器厂有限公司制造;HH-4型数显恒温水浴锅,江苏省金坛市荣华仪器厂制造;SHB-3型循环水多用真空泵,郑州长城科贸有限公司经销;Brucker AVance500型核磁共振仪,Brucker公司制造。
1.3 实验方法
1.3.1 鹿血中有效成分的提取 取10 L鹿血原液置于 100 L 的萃取罐中,按料液比 m(g)∶V(mL)=1∶5加入体积分数95%乙醇,常温搅拌提取3次,每次2 d左右,过滤取滤液。残渣在相同条件下重复提取2次,合并3次滤液,真空减压蒸馏回收乙醇,即得鹿血醇提物,浓缩干燥,置于冰箱备用。
1.3.2 鹿血醇提物的粗分 取部分鹿血醇提物加少量去离子水,溶解后上样MCI柱(5 cm×150 cm),调节柱体积流量为10 mL/min,依次用去离子水,体积分数 20%、30%、40%、50%、75%、80%乙醇溶液梯度洗脱,用250 mL的锥形瓶收集洗脱液,TLC法跟踪检测,将薄层板上显示相同Rf值的洗脱液合并浓缩。将体积分数80%乙醇洗脱液浓缩至适量,再上样ODS柱(5 cm×100 cm),调节体积流量为 8 mL/min,用乙醇溶液梯度洗脱,250 mL的锥形瓶收集洗脱液,经 TLC 法检测,根据 Rf值粗分为 A、B、C、D、E、F 6部分。将这6部分全部放入冰箱保存备用。根据所做抗疲劳实验,得出C部分具有明显的抗疲劳作用,而A、B、D、E、F这5部分的抗疲劳活性不太明显,所以就单独对C部分进行进一步分离。
1.3.3 C部分的分离 将前面得到的C部分再次上样 MCI柱(5 cm×150 cm),调节体积流量为10 mL/min,依次用去离子水、乙醇溶液梯度洗脱,TLC法跟踪检测,大致得到3部分,分别标记为C1、C2、C3。
1.3.4 C1、C2、C33部分分离纯化 将浓缩后的C1、C2、C33部分分别上样 ODS-B柱、ODS-A 柱(5 cm×100 cm),调节体积流量为8 mL/min,依次用去离子水、乙醇溶液梯度洗脱,用自动部分收集器收集,15 mL/管,经TLC跟踪监测,将Rf值相同的组分合并减压浓缩,反复上样ODS-B柱、ODS-A柱(5 cm×100 cm),由TLC法鉴定纯度,最后分离得到纯化合物Ⅰ、Ⅱ、Ⅲ。
1.3.5 Ⅰ、Ⅱ、Ⅲ 3个化合物的结构鉴定 以二甲基亚砜(DMSO)为溶剂,四甲基硅烷(TMS)为内标物,将上述3个化合物经氢谱 (1HNMR)和碳谱(13CNMR)等光谱数据分析,并结合相关文献确定这3种物质的化学结构。
2 结果与讨论
2.1 化合物Ⅰ、Ⅱ、Ⅲ的纯度
分离得到的化合物Ⅰ、Ⅱ、Ⅲ,经点样在展开剂V(正丁醇)∶V(乙酸)∶V(水)=5∶4∶1 中展开,在暗箱式紫外透射仪和显色后的薄层板上显示均为单一斑点,从左到右依次为Ⅰ、Ⅱ、Ⅲ 3种化合物(见图1),说明纯度达到核磁鉴定分析要求。
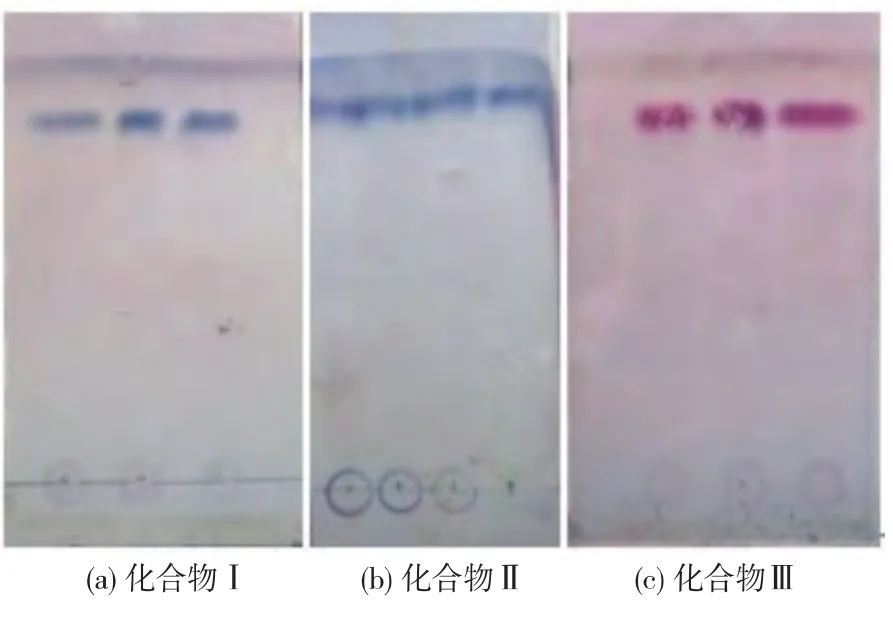
图1 化合物Ⅰ、Ⅱ、Ⅲ的薄层色谱图Fig.1 Thin-layer chromatogram of compounds Ⅰ,Ⅱ,Ⅲ
2.2 显色反应
将化合物Ⅰ、Ⅱ、Ⅲ分别进行醋酐-浓硫酸和氯仿-浓硫酸的定性试验[15],结果见表1。
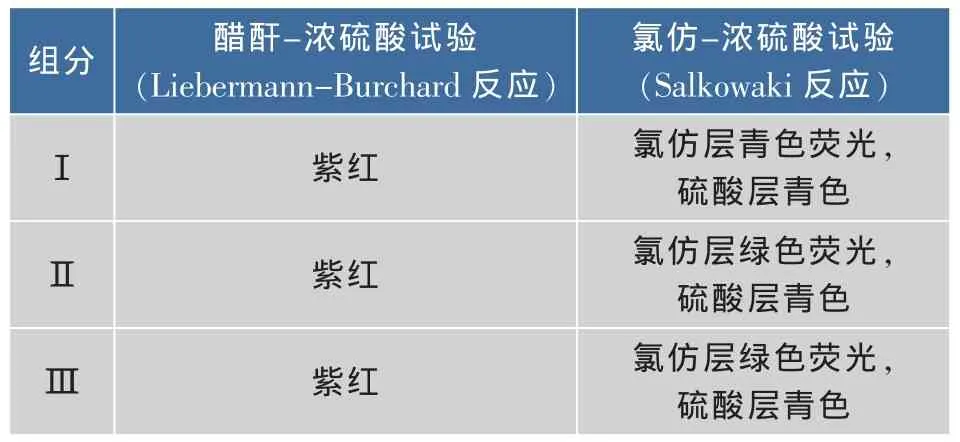
表1 化合物Ⅰ、Ⅱ、Ⅲ的显色反应Table 1 Color reaction of compoundsⅠ,Ⅱ,Ⅲ
结果表明,化合物Ⅰ、Ⅱ、Ⅲ均发生甾体反应,反应呈阳性,初步判定3种物质为甾体化合物。
2.3NMR分析
2.3.1 化合物Ⅰ 白色无定形粉末,可溶解于含水甲醇、乙醇中。
从化合物Ⅰ的1H-NMR图谱可见,δ7.87有1个单峰 H信号, 这个 H应为活泼 H,δ5.31、5.20、5.06各有1个单峰H信号,表明这3个H是双键上H,δ1.73、1.64、1.55、1.23、0.99 各有 1 个单峰甲基信号,即含5个甲基。
13C-NMR(125 MHz)中可见到 34 个碳信号(见表2),δ212.5处有1个碳信号,说明有酮基存在;δ172.4、170.1 有 2 个碳信号,δ136.4~123.9 共有 7 个碳信号,应为双键上的碳,推测170.1也是双键上的碳,可见有4个双键,δ75.3、64.4为2个连氧碳。高场区有 12 个 CH2,5 个 CH3,3 个 CH。
从δ212.5处的酮基、δ170.1双键上的碳信号及显色反应来看,化合物Ⅰ应为雄甾烯酮类化合物,根据此类化合物的特征,δ212.5为C3位酮基,δ170.1为 C5,δ172.4为连接在 C17位上的羧基,δ75.3为C17信号。δ64.4为一连氧信号,表明母环上有羟取代基,综合分析应为C2碳信号,即C2上有羟基取代,由于β效应导致酮基向低场移动。从碳谱中可以见到共有4个双键,除C4、C5双键,母环上C14、C15之间也有一个双键。δ13.9的甲基为C18,δ22.4的甲基为C19。至此可以得出化合物为雄性激素类似物质。
雄性激素类物质C17位上常连有侧链,该化合物也一样,C17连有羧基,从高场区碳信号来看δ45.4有一个CH信号,表明侧链有分枝,除母环外,侧链上有6个CH2,3个CH3,2个双键,从双键碳信号性质来看,有3个季碳。从这些数据并参照相关文献初步认定化合物Ⅰ为△4,14-雄烯-2醇-28,30环戊二烯庚酸酯-3酮。其化学结构式如图2(a)所示。
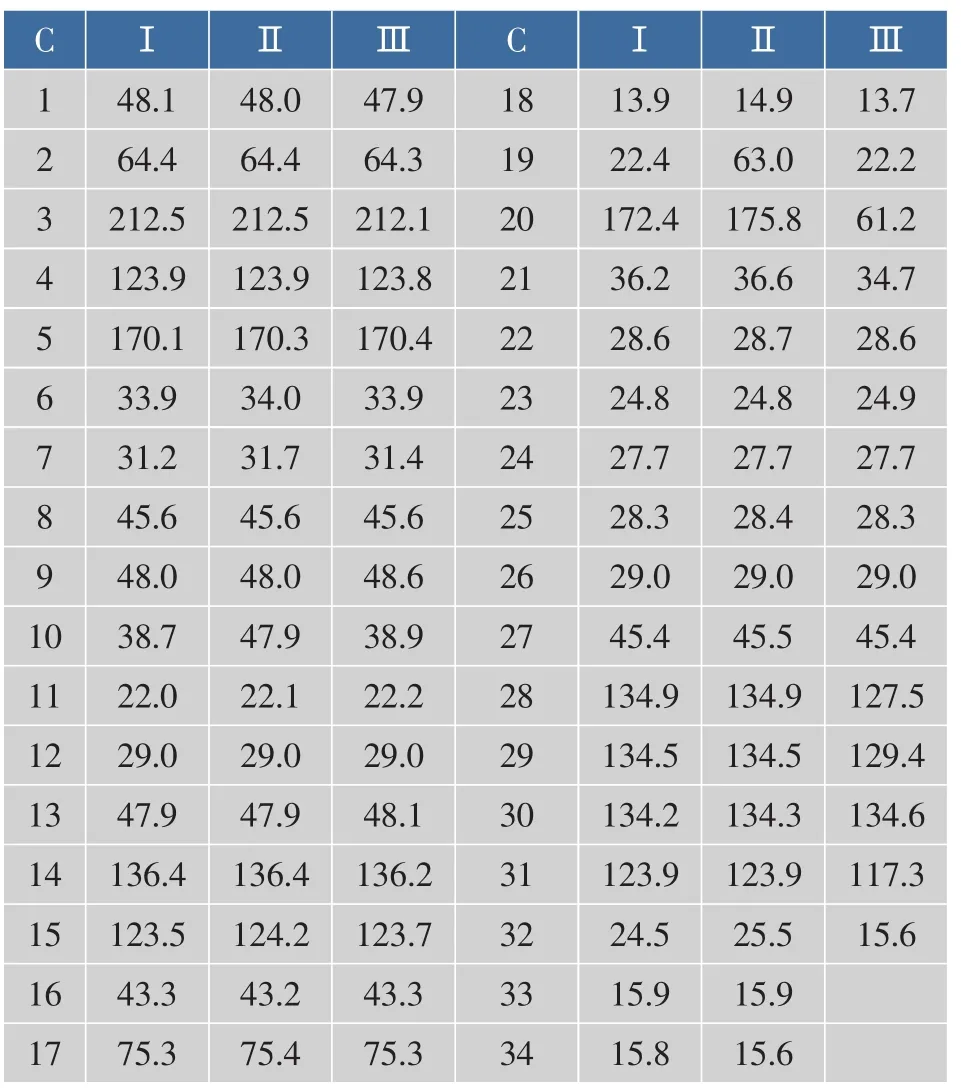
表2 化合物Ⅰ、Ⅱ、Ⅲ的13CNMR中的数据(δ)Table 2 13CNMR chemical shifts of compound Ⅰ,Ⅱ,Ⅲ

图2 化合物Ⅰ、Ⅱ、Ⅲ的结构图Fig.2 Structure of compoundⅠ,Ⅱ,Ⅲ
2.3.2 化合物Ⅱ 白色无定形粉末,可溶解于含水甲醇、乙醇中。
从化合物Ⅱ的1H-NMR图谱可见,δ7.91有1个单峰 H信号,这个H应为活泼 H,δ5.31、5.20、5.06各有1个单峰H信号,表明这3个H是双键上H。δ1.93、1.64、1.50、0.89 各有 1 个单峰甲基信号,即含4个甲基。
13C-NMR(125 MHz)中可见到 34个碳信号(见表2),δ212.5处有1个碳信号,说明有酮基存在,δ172.4、170.1 有 2 个碳信号,δ136.4~123.9 共有 7 个碳信号,应为双键上的碳,δ75.3、64.4、63.0 为 3 个连氧碳。 高场区有12个CH2,4个CH3,3个CH。
从以上数据来看,化合物Ⅱ与化合物Ⅰ结构相似,不同的是化合物Ⅱ多了一个δ63.0的连氧碳信号,少了δ22.4的甲基,表明C19上有羟基取代。从这些数据并参照相关文献初步认定化合物Ⅱ为△4,14-雄烯-2,19 醇-28,30 环戊二烯庚酸酯-3 酮。其化学结构式如图2(b)所示。
2.3.3 化合物Ⅲ 白色无定形粉末,可溶解于含水甲醇、乙醇中。
从化合物Ⅲ的1H-NMR图谱可见,δ7.92有1个单峰H信号,这个H应为活泼H,δ5.25有1个单峰H信号,5.17、5.07各有2个单峰H信号,表明这5个H是双键上H。13C-NMR(125 MHz)中可见到31个碳信号(见表2),δ212.5处有1个碳信号,说明有酮基存在;δ170.1 有 1 个碳信号,δ136.4~117.3 共有7个碳信号,δ170.1碳信号应为双键上的碳,表明与化合物Ⅰ具有相似的烯酮结构。与化合物Ⅰ相比不一样的是少一个δ172.4的羧基,多一个δ61.2连氧碳CH2信号,表明C17位上连接的是氧而不是羧基。从135DEPT谱中可以看到,δ136.4~117.3共有5个CH碳信号,说明有5个双键H未被取代,这与H谱信号弹相一致,高场区碳信号δ45.5有一个CH信号,表明侧链有分枝,除母环外,侧链上有6个CH2,3个CH3,从以上数据来看化合物Ⅲ与化合物Ⅰ虽有不同但母环结构是相似的。经这些数据分析并参照相关文献可知,化合物Ⅲ为△4,14-雄烯-2醇-27,29环戊二烯己醚-3酮。其化学结构式如图2(c)所示。
3 结语
利用乙醇对鹿血的有效成分进行提取,经MCI柱层析粗分,再经ODS反相色谱柱反复分离,得到3种化合物Ⅰ、Ⅱ、Ⅲ,通过1HNMR、13CNMR等方法鉴定出Ⅰ为△4,14-雄烯-2醇-28,30环戊二烯庚酸酯-3 酮;Ⅱ为△4,14-雄烯-2,19 醇-28,30 环戊二烯庚酸酯-3酮; Ⅲ为△4,14-雄烯-2醇-27,29环戊二烯己醚-3酮。结果显示,3个化合物均为雄性激素衍生物,这3种雄性激素衍生物在鹿血中存在属首次报道。采用TLC、1HNMR和13CNMR等方法对鹿血化学成分进行研究,以探明鹿血化学成分与功能活性之间的关系,为鹿产品的开发提供理论依据。
[1]宋胜利,葛志广,宋文涛,等.鹿血资源的开发及利用前景[J].农牧产品开发,2000(11):5-8.SONG Shengli,GE Zhiguang,SONG Wentao,et al.The development and utilization prospects of Deer blood resources[J].Agriculture and Animal Husbandry Products Development,2000(11):5-8.(in Chinese)
[2]中华人民共和国国家药典委员会.中华人民共和国药典[M].北京:化学工业出版社,2010.
[3]袁相恋,博士儒,李庆杰,等.鹿血化学成分和药理作用及其应用研究进展[J].经济动物学报,2011(4):207-211.YUAN Xianglian,BO Shiru,LI Qingjie,et al.Deer blood chemical components,pharmacological effects and application research progress[J].Journal of Economic Animal,2011(4):207-211.(in Chinese)
[4]付彩霞.梅花鹿血的蛋白酶水解及水解产物的抗衰老功能研究[D].武汉:华中农业大学 食品科学学院,2009.
[5]尹小平,姜红,高晓黎,等.酶解天山马鹿血分离制备抗疲劳肽的研究[J].天然产物研究与开发,2009,21:391-394.YIN Xiaoping,JIANG Hong,GAO Xiaoli,et al.Preparedand separated anti-fatigue peptides from wapiti velvet antler blood protein[J].Nat Prod Res Dev,2009,21:391-394.(in Chinese)
[6]胡圣爱,阎辉.复方鹿血冻干粉抗缺氧抗疲劳作用的实验研究[J].中华实用中西医杂志,2003,16:1555-1556.HU Shengai,YAN Hui.Experimental research on oxygen resistance and the anti-fatigue effect of Compound deer blood[J].Practical Chinese and Western Medicine Magazine,2003,16:1555-1556.(in Chinese)
[7]刘颖,陈光,胡高飞,等.蒺藜果实中C21甾体类化合物结构解析[J].北京化工大学学报,2010(4):103-107.LIU Ying,CHEN Guang,HU Gaofei,et al.C2l steroid compound analysis of Tribulus terrestris fruits[J].Journal of Beijing University of Chemical Technology,2010(4):103-107.(in Chinese)
[8]周维善,黄维垣.甾体化合物的命名[J].化学通报,1965(10):15-23.ZHOU Weishan,HUANG Weiyuan.Thenaming of steroid compounds[J].Chemistry Bulletin,1965(10):15-23.(in Chinese)
[9]束怀德.甾体激素药理学[M].北京:人民卫生出版社,1982.
[10]蒋蕾,赵文静,常惟智.鹿血的药理作用及临床应用概况[J].中药研究进展,2006(6):12-13.JIANG Lei,ZHAO Wenjing,CHANG Weizhi.Pharmacological action and clinical applicationof Deer blood[J].Traditional Chinese Medicine Research Progress,2006(6):12-13.(in Chinese)
[11]Baroni F,Prot ano G,Riccobono F.Essential and toxicelements inroe deer blood[J].Trace Metalsin the Environment,2000(4):485-505.
[12]Margaret E Lawton,Sutton J G.Species identification of deer blood by isoelectric focusing[J].Journal of the Forensic Science Society,1982(4):361-366.
[13]Seal U S,Ozoga J J,Erickson A W,et al.Effects of Immobilization on blood analysis of white-tailed deer[J].The Journal of Wildlife Management,1972,36:1034-1040.
[14]Wilson P R,Pauli J V.Blood constituents of farmed red deer (Cervus elaphus). Ⅱ :biochemical values[J].New Zealand Veterinary Journal,2012,31:1-3.
[15]范玉林.鹿茸中甾体化合物的研究[J].吉林农业大学学报,1987(2):69-71.FAN Yulin.Steroid compounds in research of velvet antler[J].Journal of Jilin Agricultural University,1987 (2):69-71.(in Chinese)
[16]崔丽春.梅花鹿血液中3种抗衰老成分的动态分析[D].哈尔滨:东北林业大学 野生动物资源学院,2004.
[17]董万超,赵景辉,潘久如,等.梅花鹿七种产品的化学成分研究[J].特产研究,1994(1):30-43.DONG Wanchao,ZHAO Jinghui,PAN Jiuru,et al.The seven kinds of chemical composition research of sika deer[J].Specialty Research,1994(1):30-43.(in Chinese)
[18]James A Wesson,Patrick F Scanlon,Roy L,et al.Influence of chemical immobilization and physical restraint on steroid hormone levels in blood of white-tailed deer[J].Can J Zool,1979,57:768-776.
