膀胱过度活动症的客观评估指标
2014-11-05许克新张石英
许克新,胡 浩,张石英,王 栋
(北京大学人民医院泌尿外科,北京100044)
膀胱过度活动症(overactive bladder,OAB)是发病率较高的储尿期下尿路症状,常给患者带来较大的生活困扰及经济负担。目前,OAB的临床诊断是基于患者的症状与主诉,并进行相应的检查以除外其他疾病之后的排除性诊断,而缺乏准确、实用的客观检测方法来帮助OAB的诊断或评估疗效。最近的一些研究结果显示,OAB患者尿液中的神经营养因子、前列腺素、C反应蛋白均有变化,这些指标可能成为OAB的生物诊断标记物,其中又以神经营养因子[包括神经生长因子(nerve growth factor,NGF)与脑源性神经营养因子(brain-derived nerve factor,BDNF)]受到较多的关注。有临床研究结果显示,尿NGF可作为OAB诊断与抗胆碱能药物疗效的潜在生物指标,但也有研究显示BDNF可能与OAB关系更为密切,可能是一种更有效的OAB相关生物标记物。尽管目前仍缺乏确切的证据表明NGF或BDNF可应用于临床,成为OAB的监测标记物,但已明确神经营养因子确实参与了OAB的发生。在回顾了该领域的最新研究后,现将OAB生物标记物相关研究进展总结如下。
1 概述
依据国际尿控协会(ICS)的定义,OAB是一种以尿急症状为特征的症候群,常伴有尿频和夜尿症状,可伴或不伴急迫性尿失禁[1]。OAB在男性和女性的患病率相近,均随着年龄的增加而上升[2]。OAB的核心症状:尿急症(Urgency),定义为突发、强烈、很难被延迟的排尿欲望[3]。但“突发”与“强烈”均较主观,难以量化[4],常常与急迫的尿意相混淆(急迫的尿意是一种生理性的正常膀胱感觉,伴随膀胱充盈过程而逐渐出现,可以被主观控制而延迟排尿)。因此,也给OAB的诊断与疗效评估带来了很大难度。逼尿肌过度活动(DO)是OAB的尿动力学特征,但DO仅能在约一半的OAB患者中检测到,而在一些正常人群中会存在无症状的逼尿肌不自主收缩[5]。另外,尿动力学是一项侵入性检查,这影响了其作为OAB临床诊断方法,而目前临床中常用的评估方法只能是患者主诉或一些症状评估量表(如 OAB-q、OABSS 等)[6,7]。解决这一问题的方法是找到一种更加简单、经济、实用的OAB诊断与疗效评估的客观检测方法。尽管目前仍没有一个确切可靠的临床指标,但仍有许多研究对于诊断OAB很有价值,值得我们关注。
2 神经营养因子
近年来,神经营养因子在OAB中的作用受到了越来越多的关注。神经营养因子包括NGF与BDNF,是神经细胞生殖、分化、生长与存活所必需的生长因子,其在中枢与外周神经系统中起到了广泛的作用[8]。尿液中的NGF与BDNF已被证实是由膀胱上皮与膀胱逼尿肌细胞分泌的。NGF可高选择性地结合于受体TrkA,BDNF可高选择性地结合于受体TrkB,这两种受体均是一种表达于膀胱上皮细胞与传入神经的细胞表面跨膜糖蛋白[9,10]。尿液中NGF与BDNF的升高可通过受体等通路导致DO[11]。
2.1 NGF 对NGF的研究开始于上世纪50年代,Cohen与Montalcini因为发现了NGF与其他生长因子,获得了1986年的生理学与医学诺贝尔奖。神经细胞或非神经细胞均可能合成NGF[12],在尿路中,NGF是由膀胱上皮及平滑肌细胞产生的。它调节着交感神经元节后纤维及传入神经的生长与功能,并可能是一种激活传入神经C纤维,介导其病理变化的化学介质[13]。动物模型证实,膀胱过度活动时膀胱上皮及平滑肌细胞可大量释放NGF[9]。最近的研究表明,短期或长期膀胱局部给予NGF可降低膀胱容量,减少膀胱收缩间隔时间,并增加膀胱反射性收缩[14,15]。另有研究证实在大鼠脊髓或膀胱中长期给予NGF,可导致膀胱过度活动并出现排尿频率增加[11,14,16~18]。NGF 介导膀胱逼尿肌过度活动的可能机制如图1所示,在炎症、梗阻、去神经化等刺激因素作用下,NGF生成增多,并致敏传入神经,加强突触传导并产生排尿次数的增加。
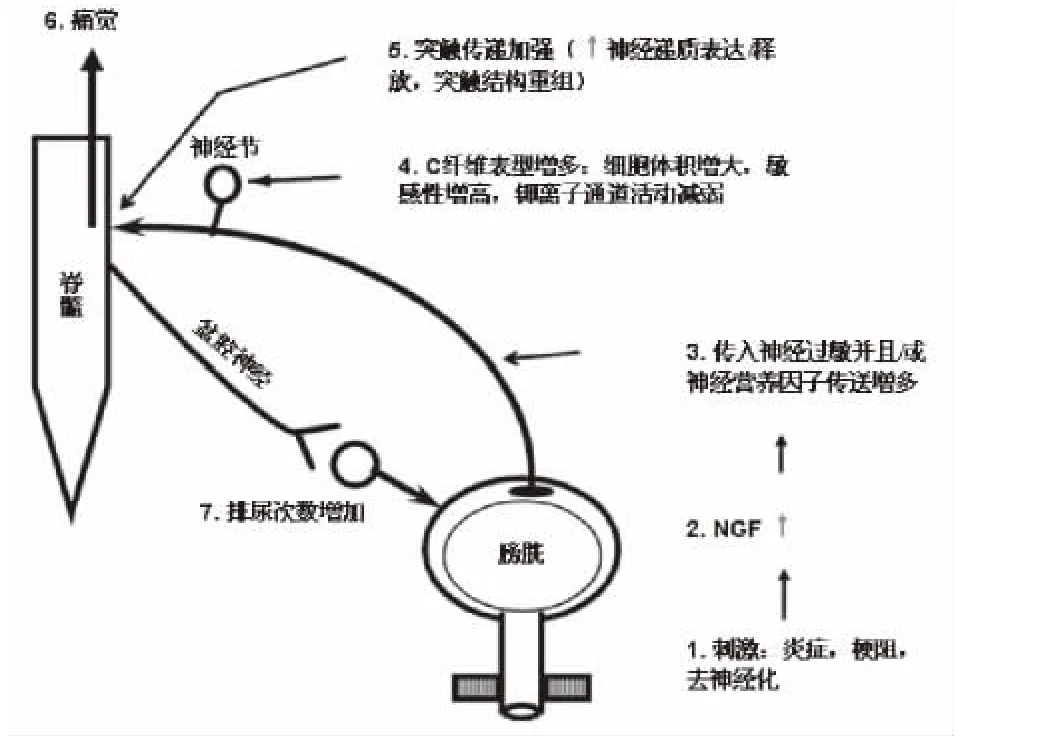
图1 NGF介导膀胱逼尿肌过度活动的可能机制
2.1.1 尿NGF水平可作为OAB诊断指标吗 依据前述研究结果,在人体中,随着尿NGF水平的上升也可以致敏膀胱传入神经,加强膀胱感觉神经传入,并最终导致DO。而DO被认为是OAB的尿动力学表现,因此NGF将可能作为OAB诊断的生物指标[19]。研究表明,在OAB、自发性/神经源性DO、间质性膀胱炎以及膀胱出口梗阻患者中均可检测到水平异常升高的 NGF[20,22]。在有尿急症或 DO 患者的膀胱组织与尿液中,均可检测到NGF水平的升高。但因膀胱的上皮组织、上皮下组织及平滑肌组织很难被量化,不利于在这些组织中观察不同患者NGF水平的变化[23]。而尿液很容易量化,相比膀胱组织,尿液检测是一种更简便、安全且准确的定量NGF的方法[24]。与对照组相比,OAB患者的尿NGF水平显著升高约12倍[25]。另有研究证实,OAB患者尿液中的NGF水平升高,尤其是在有急迫性尿失禁症状的 OAB(湿性 OAB)患者[26]。而且OAB患者尿NGF水平可能还与患者尿急症状的严重程度相关:研究证实尿急症状评分(USS)为3分或4分的患者,其尿NGF水平显著高于USS评分为3分以下的患者[25]。在Liu等的研究中,干性OAB患者与湿性OAB患者的尿NGF水平均显著高于对照组(无下尿路症状)或仅有膀胱感觉过敏的人群;而湿性OAB患者的尿NGF水平又显著高于干性OAB患者(这可能是由于湿性OAB患者DO的比例更高)[26]。在男性膀胱出口梗阻(BOO)患者与对照人群中进行的研究显示,BOO/OAB与BOO/DO患者的尿NGF水平显著高于BOO/无OAB人群或对照组人群,BOO/OAB患者与BOO/DO患者的尿NGF/Cr水平无显著差异[27]。在女性患者中,混合性尿失禁患者(MUI)、急迫性尿失禁患者(UUI)以及DO患者的尿NGF水平均显著高于压力性尿失禁患者(SUI)或对照人群。尿NGF/Cr水平大于0.05的比例在SUI患者中为9%,在DO患者中为77%,在SUI合并DO的患者中为81%,在抗压力性尿失禁术后新发DO的患者中为80%[28]。Chen等的研究显示,以尿NGF/Cr比值大于0.05作为诊断OAB的标准时,敏感度与准确度分别为67.9%与93.8%[29]。但也有研究显示,OAB 患者尿 NGF/Cr比值有升高趋势,但与健康受试者相比,变化并未达到统计学意义的显著差异[30]。对于这种有差异的不同结果,可能还需要更多临床研究来证实NGF与OAB的确切关系。
2.1.2 尿NGF水平可作为OAB治疗效果评估指标吗 抗胆碱能药物是目前最常用的治疗OAB的药物,它主要阻断胆碱能药物受体,并可能同时降低尿NGF水平。在Liu等的研究中,给予OAB患者抗胆碱能药物(托特罗定4 mg,每日一次)治疗12周,在用药4、8、12周及停药4周后分别测定尿急严重程度(USS)及尿 NGF/Cr[31]。结果显示,对治疗有反应者在用药4、8、12周后,USS均有显著缓解,而NGF/Cr在用药12周后才出现显著下降。停药4周后,35%的患者症状复发,且NGF/Cr水平重新上升(与基线值相比P=0.28),而在症状未复发的患者中,NGF/Cr仍维持在低水平(与基线值相比P=0.043)。提示尿NGF可作为抗胆碱能药物治疗OAB的疗效评估指标(图2)。这个研究进一步显示,虽然尿NGF与USS均随着抗胆碱能药物的治疗而下降,但两者的变化之间存在时间窗,这可能是由于USS是患者的主观感受,NGF是OAB的病理生理改变,患者症状解决的同时,病理生理改变可能需要更长的治疗时间才能够达到。虽然在停药1个月后35%的患者出现复发,但随着病理生理状态的改变(NGF水平下降),更长的抗胆碱能药物治疗能否带来更低的复发率或更长的无复发时间,尚有待于进一步验证。见图2。
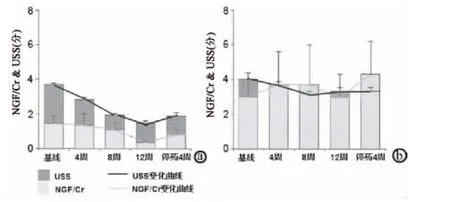
图2 尿NGF与抗胆碱能药物治疗OAB疗效的相关性 Q:对治疗有反应者;b:对治疗无反应者
2.2 BDNF BDNF是人体内数量最多的一种神经营养因子,但不论在生理或病理状态下,目前对其的研究或了解仍相当有限。现有研究表明,BDNF主要由小、中型的肽能神经元细胞生成,也可由非神经细胞产生[32],在感觉神经生长及发挥功能上起到了重要作用[33]。BDNF较多存在于脊髓中的感觉神经末梢,除了其对神经细胞的营养与重塑作用外,也有研究表明其对伤害感受有重要介导作用[34],而体内BDNF的表达水平可能受到NGF的调节[35]。
2.2.1 尿BDNF水平可作为OAB诊断与治疗效果评估指标吗 对于BDNF,现有数据基本均来自于膀胱功能异常的实验室模型研究。而其在下尿路功能中所起到的作用,无论是在生理状态下或病理状态下,目前了解仍十分有限。有研究表明,在慢性膀胱炎症或脊髓损伤时,膀胱中BDNF的水平会显著上升[36]。对此,有最近的动物研究可证实:隔离BDNF后有慢性膀胱炎症的受试小鼠膀胱功能得到改善[37]。而无论BDNF隔离与否,均不影响正常动物的膀胱排尿反射,提示BDNF对膀胱功能的影响可能仅限于病理状态下。最新的一项临床研究表明,对照组受试者尿液中的BDNF/Cr比值(pg/mg)均较低,而OAB患者尿液中的BDNF/肌酐比值则显著上升[38],并且与年龄或尿液取样时间无关(图3)。此研究结果提示有可能将 BDNF水平作为OAB诊断的客观检查指标。并且,在3个月的行为方式调节后,OAB患者的BDNF水平下降,但仍高于健康受试者。该研究也进行了BDNF作为OAB诊断标准的准确性评估,以受试者工作特征曲线(ROC)分析,BDNF优于NGF而更适合作为OAB诊断指标(图4)。但其作为OAB临床诊断标准被广泛推广前,可能还需要进一步的大规模临床研究来证实其可靠性与稳定性。另外,临床研究证实,膀胱疼痛综合征或间质性膀胱炎患者尿液中BDNF水平升高,而在接受肉毒杆菌毒素膀胱三角区注射后,尿BDNF水平显著下降[22],由此可见尿BDNF水平的下降与LUTS症状的改善存在正相关。
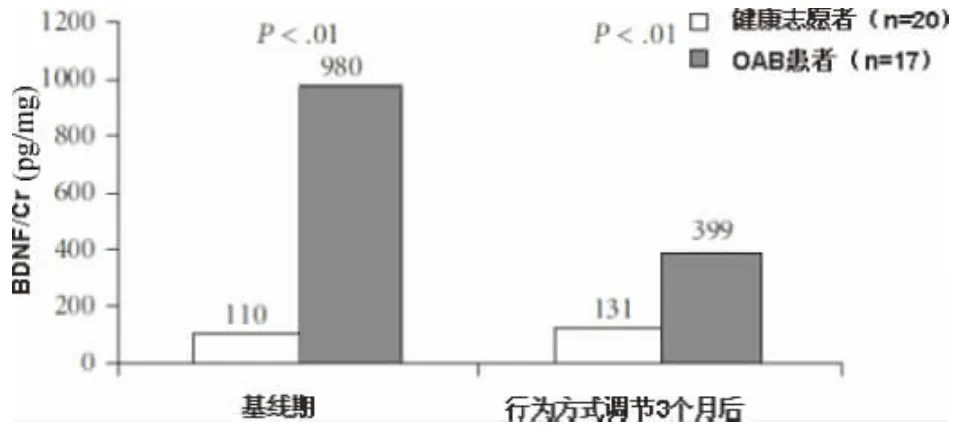
图3 BDNF与OAB的相关性
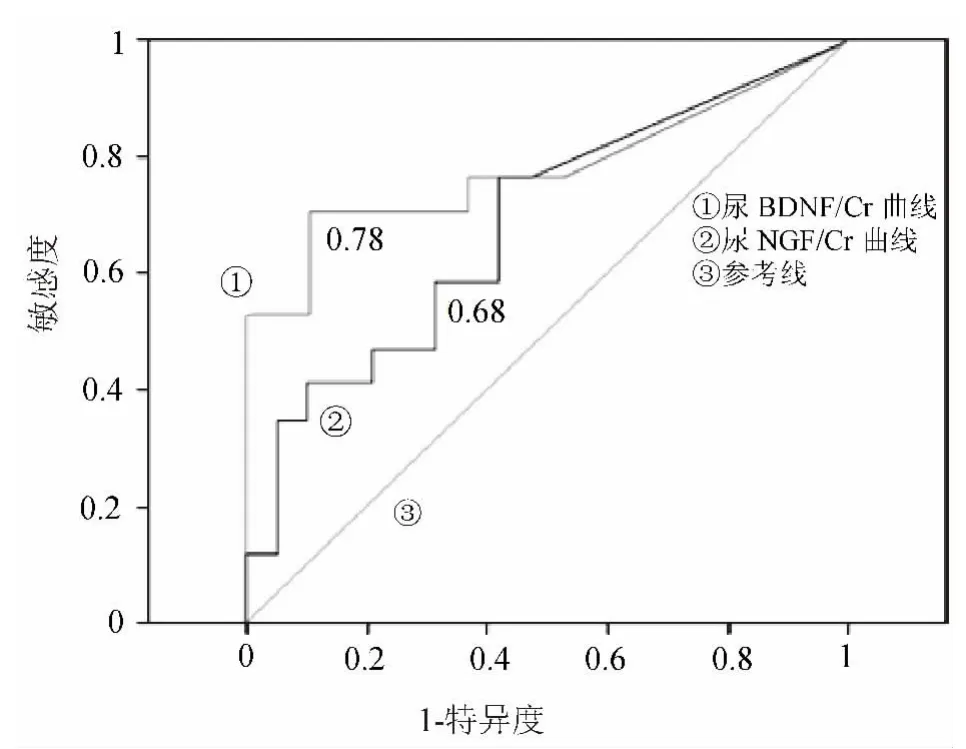
图4 BDNF诊断OAB的ROC曲线
2.2.2 神经营养因子NGF和BDNF可以作为OAB治疗的靶点吗 前述的研究与分析我们认识到,尽管出现急迫尿意时,正常受试者尿NGF水平显著上升,但仍显著低于OAB患者的尿NGF水平。此结果提示正常人群在出现急迫尿意时会有尿NGF水平的生理性上升,而OAB患者会出现表皮生长因子(BGF)病理性的异常升高[39]。P2X3及 TRPV1等受体可调节膀胱功能,神经营养因子可能是通过影响这些受体的表达与功能,从而推动了DO或OAB的发生发展[40]。我们足以通过这些信息获得启示,即降低尿液中升高的NGF水平可能是治疗DO或OAB患者的重要方式。这一点已得到了一些研究的证实:在脊髓损伤的大鼠脊髓中给予NGF抗体中和NGF后,膀胱逼尿肌反射亢进与逼尿肌-括约肌协同失调均得到了抑制[41]。这与使用辣椒辣素脱敏C纤维后观察到的疗效一致。而在顽固性的自发性/神经源性DO患者中,肉毒杆菌毒素A膀胱逼尿肌注射也被证实可降低尿NGF水平[42]。在Pinto与 Hu 的研究中[37,43],通过隔离 NGF 及 BDNF 可成功抑制DO。因此我们有理由相信:NGF与BDNF与OAB的病理生理改变相关,降低体内NGF与BDNF水平将有助于缓解OAB。我们也期待在未来会有新的药物出现,通过阻断NGF/BDNF受体或降低这些神经营养因子本身来有效治疗DO与OAB。
3 前列腺素(PG)
PG可以调节下尿路功能,是由膀胱平滑肌和膀胱上皮细胞合成的。逼尿肌牵张延展、膀胱神经刺激、膀胱黏膜损伤以及炎症等因素均可促进PG的合成[44]。PG素可能参与调节逼尿肌及膀胱传入神经的活动,它通过激活膀胱传入神经(辣椒辣素敏感神经,如C纤维),降低可引起逼尿肌收缩的刺激阈值,从而影响排尿反射。因此PG可参与OAB等膀胱刺激症状的发生[44]。在动物研究中,前列腺素E2膀胱灌注可诱导小鼠逼尿肌收缩,而尿道局部应用则引起尿道舒张[45]。而激活前列腺素EP3受体可以兴奋膀胱传入神经,影响膀胱功能[46]。在临床研究中,OAB患者尿液中前列腺素E2及F2α水平与健康受试者相比显著升高,而且首次尿意时的膀胱容量与前列腺素E2呈负相关[44]。另一方面,也有临床研究并未发现前列腺素E2水平在OAB患者、间质性膀胱炎患者及健康受试者之间有显著差异[47]。PG作为OAB的诊断指标目前仍存在争议,尚需更多的临床证据。
4 尿液中细胞因子、尿液与血液中C反应蛋白
OAB曾被推测为是一种膀胱的炎症性疾病[48],最近也有研究提供了OAB患者膀胱样本的组织学检测结果,提供了膀胱炎症的组织学证据[49,50]。但基于活组织的膀胱炎症检测方法是侵入性的,可能带来损伤甚至并发症,而且价格昂贵,不适宜临床应用。而细胞因子水平在炎症状态下升高,可作为良好的生物指标。有研究检测了OAB患者尿液中的细胞因子、趋化因子及生长因子等,结果显示与健康受试者相比,这些生物标记物中部分有显著升高,巨噬细胞炎症蛋白(MIP-1β)及表皮生长因子(EGF)等标记物有五倍以上的上升,而单核细胞趋化蛋白1(MCP-1)等标记物则有十倍以上的显著上升[48]。
C反应蛋白(CRP)已被作为炎症与感染的标记物而得到深入研究。血浆CRP在炎症等状态下显著增高,被用来作为评估疾病进展与治疗效果的临床指标。有临床研究显示,与健康受试者相比,OAB患者的血浆CRP显著升高,而且湿性OAB患者的CRP水平高于干性OAB患者[51]。而在同一研究中,尿液中的CRP很少能检测到,膀胱组织中的CRP的mRNA表达也呈一般水平。就现有数据来看,通过尿CRP水平检测来诊断OAB的方法敏感性不足。而另一方面需强调的是,下尿路症状患者的血CRP水平可能不足以精确反应其下尿路的情况,因为除OAB外,其它全身炎症反应也可能影响到CRP水平,这可能影响到其作为诊断OAB的生物标记物[51,52]。
5 超声检测膀胱壁厚度及膀胱血流
近年来,较多的研究显示,膀胱局部血供减少可造成膀胱的缺血缺氧,可能是膀胱功能异常的主要原因。膀胱功能异常在代偿期表现为逼尿肌肥厚,并出现下尿路刺激症状,而在失代偿期则表现为逼尿肌收缩无力、膀胱收缩功能下降。有研究证实OAB患者膀胱壁厚度增加,而经过有效的抗胆碱能药物治疗后,厚度降低[31],提示膀胱壁厚度可能是监测OAB疾病进程及疗效的有效指标。但同时也应注意到,在此研究中膀胱壁厚度在各人群中的变化很大,尽管与健康受试者相比,OAB患者膀胱壁厚度有增加趋势,但并未达到统计学差异。在Kuo的研究中分别使用经腹超声与经阴道超声对OAB患者及对照人群进行检查[53]。有趣的是,经阴道超声检查未发现膀胱壁厚度在两组人群间的变化,而经腹超声结果显示OAB患者膀胱壁厚度显著高于对照人群。膀胱出口梗阻(BOO)是导致膀胱功能障碍的重要因素之一,因此膀胱壁厚度也常作为BOO的监测指标被提及。但从临床研究的结果来看,膀胱壁厚度与 BOO程度的一致性并不确切[53,54]。因此虽有膀胱壁厚度与OAB相关性的正向研究结果,但其临床应用与推广也一直存在争议[55]。
膀胱的血供情况可能是反应膀胱功能更直接的指标。研究显示衰老、BOO等多种因素均可影响膀胱功能[56],而这些因素影响膀胱的共同通路可能就是导致膀胱血供减少。而膀胱在长期、慢性的缺血缺氧状况下,可在黏膜/黏膜下层、逼尿肌、神经纤维、膀胱间质等组织结构中发生变化,导致黏膜层破坏、逼尿肌及神经纤维高敏、间质纤维化,最终影响膀胱功能出现储尿期症状[57]。Pinggera 中[58]使用经直肠的彩色超声检测下尿路血流,结果显示与年轻对照组或年龄吻合的老年对照组相比,老年下尿路症状患者膀胱血流灌注均显著下降。提示膀胱缺血缺氧可能是伴随年龄出现的导致下尿路症状的重要因素。在另一项研究中[59],对比了前列腺电切术(TURP)后有持续逼尿肌过度活动(DO)与无DO人群的经直肠超声检测结果,显示DO患者膀胱血流的阻力指数(RI)显著高于无DO人群,提示TURP术后持续的DO及储尿期症状可能和膀胱缺血缺氧状况相关。
6 总结
OAB的诊断与疗效评估目前仍主要依赖患者主诉、症状评分量表等主观的评估工具,缺乏准确且临床可行的客观评估指标。神经营养因子NGF与BDNF可能参与到了OAB的发生,为我们重新认识OAB以及膀胱功能提供了一个新的方向。并且,有研究显示OAB患者尿液中的NGF与BDNF水平上升,BOO合并OAB或DO的患者尿NGF水平也有升高,且在药物治疗BOO后伴随NGF水平的下降。这些结果均提示尿NGF与BDNF或许可以作为OAB诊断与疗效评估的客观指标。其它与OAB相关的客观指标还包括前列腺素、细胞因子、C反应蛋白以及膀胱壁厚度与膀胱血供等超声检测结果,但这些生物标记物或超声结果与OAB的相关性还需进一步研究证实。
[1]Abrams P,Cardozo L,Fall M,et al.The standardization of terminology of lower urinary tract function:report from the standardisation subcommittee of the international continence society[J].Neurourology and Urodynamics,2002,21(2):167-178.
[2]Wang YL,Xu KX,Hu H,et al.Prevalence,Risk Factors,and Impact on Health Related Quality of Life of Overactive Bladder in China[J].Neurourology and Urodynamics,2011,30(8),1448-1455.
[3]Chapple CR,Artibani W,Cardozo LD,et al.The role of urinary urgency and itsmeasurement in the overactive bladder symptom syndrome:current concepts and future prospects[J].British Journal of Urology International,2005,95(3):335-340.
[4]Gormley EA,Lightner DJ,Burgio KL,et al.Diagnosis and treatment of overactive bladder(Non-Neurogenic)in adults:AUA/SUFU Guideline[J].Journal of Urology,2012,188(6):2455-2481.
[5]Hashim H,Abrams P.Is the bladder a reliable witness for predicting detrusor overactivity[J].Journal of Urology,2006,175(1):191-195.
[6]Nixon A,Colman S,Sabounjian L,et al.A validated patient reported measure of urinary urgency severity in overactive bladder for use in clinical trials[J].Journal of Urology,2005,174(2):604-607.
[7]Starkman JS,Dmochowski RR.Urgency assessment in the evaluation of overactive bladder(OAB)[J].Neurourology and Urodynamics,2008,27(1):13-21.
[8]Allen SJ,Dawbarn D.Clinical relevance of the neurotrophins and their receptors[J].Clinical Science,2006,110(2):175-191.
[9]Steers WD,Tuttle JB.Mechanisms of disease:the role of nerve growth factor in the pathophysiology of bladder disorders[J].Nature Clinical Practice Urology,2006,3(2):101-110.
[10]Birder LA,de Groat WC.Mechanisms of disease:involvement of the urothelium in bladder dysfunction[J].Nature Clinical Practice U-rology,2007,4(1):46-54.
[11]Lamb K,Gebhart GF,Bielefeldt K.Increased nerve growth factor expression triggers bladder overactivity[J].J Pain,2004,5:150-156.
[12]Pezet S,McMahon SB.Neurotrophins:mediators and modulators of pain[J].Annual Review of Neuroscience,2006,29:507-538.
[13]Vizzard MA.Changes in urinary bladder neurotrophic factor mRNA and NGF protein following urinary bladder dysfunction[J].Exp Neurol,2000,161:273-284.
[14]Yoshimura N,Bennett NE,Hayashi Y,et al.Bladder overactivity and hyperexcitability of bladder afferent neurons after intrathecal delivery of nerve growth factor in rats[J].Journal of Neuroscience,2006,26(42):10847-10855.
[15]Zvara P,Vizzard MA.Exogenous overexpression of nerve growth factor in the urinary bladder produces bladder overactivity and altered micturition circuitry in the lumbosacral spinal cord[J].BMC Physiology,2007,7:9.
[16]Vizzard MA.Neurochemical plasticity and the role of neurotrophic factors in bladder reflex pathways after spinal cord injury[J].Prog Brain Res,2006,152:97-115.
[17]Seki S,Sasaki K,Igawa Y,et al.Detrusor overactivity induced by increased levels of nerve growth factor in bladder afferent pathways in rats[J].Neurourol Urodyn,2003,22:375-377.
[18]Zvara P,Vizzard MA.Exogenous overexpression of nerve growth factor in the urinary bladder produces bladder overactivity and altered micturition circuitry in the lumbosacral spinal cord[J].BMC Physiol,2007,7:9.
[19]Kuo HC.Recent investigations of urinary nerve growth factor as a biomarker for overactive bladder syndrome[J].Korean Journal of U-rology,2009,50(9):831-835.
[20]Vizzard MA.Neurochemical plasticity and the role of neurotrophic factors in bladder reflex pathways after spinal cord injury[J].Progress in Brain Research,2006,152:97-115.
[21]Liu HT,Liu AB,Chancellor MB,et al.Urinary nerve growth factor level is correlated with the severity of neurological impairment in patients with cerebrovascular accident[J].British Journal of Urology International,2009,104(8):1158-1162.
[22]Pinto R,Lopes T,Frias B,et al.Trigonal injection of botulinum toxin A in patients with refractory bladder pain syndrome/interstitial cystitis[J].European Urology,2010,58(3):360-365.
[23]Birder LA,Wolf-Johnston A,Griffiths D,et al.Role of urothelial nerve growth factor in human bladder function[J].Neurourol Urodyn,2007,26:405-409.
[24]Kuo HC,Liu HT,Chancellor MB.Can urinary nerve growth factor be a biomarker for overactive bladder[J].Rev Urol,2010,12(2-3):e69-77.
[25]Liu HT,Chen CY,Kuo HC.Urinary nerve growth factor in women with overactive bladder syndrome[J].Journal of Urology International,2011,107(5):799-803.
[26]Liu HT,Kuo HC.Urinary nerve growth factor level could be a potential biomarker for diagnosis of overactive bladder[J].Journal of U-rology,2008,179:2270-2274.
[27]Liu HT,Kuo HC.Urinary nerve growth factor levels are increased in patients with bladder outlet obstruction with overactive bladder symptoms and reduced after successful medical treatment[J].Urology,2008,72:104-108.
[28]Liu HT,Chancellor MB,Kuo HC.Urinary nerve growth factor level could be a biomarker in the differential diagnosis of mixed urinary incontinence in women[J].BJU Int,2008,102:1440-1444.
[29]Chen CY,Kuo HC.Novel urinary biomarkers in the diagnosis and assessment of overactive bladder[J].Incontinence and Pelvic Floor Dysfunction,2009,3(1):20-23.
[30]Antunes-Lopes T.Urinary neurotrophins—potential biomarkers of overactive bladder[J].Journal of Urology,2011,185(4):780-781.
[31]Liu HT,Chancellor MB,Kuo HC.Decrease of urinary nerve growth factor levels after antimuscarinic therapy in patients with overactive bladder[J].British Journal of UrologyInternational,2009,103(12):1668-1672.
[32]Obata K,Noguchi K.BDNF in sensory neurons and chronic pain[J].Neuroscience Research,2006,55(1):1-10.
[33]Merighi A,Salio C,Ghirri A,et al.BDNF as a pain modulator[J].Progress in Neurobiology,2008,85(3):297-317.
[34]Zhao J,Seereeram A,Nassar MA,et al.Nociceptorderived brain-derived neurotrophic factor regulates acute and inflammatory but not neuropathic pain[J].Molecular and Cellular Neuroscience,2006,31(3):539-548.
[35]Pezet S,McMahon SB.Neurotrophins:mediators and modulators of pain[J].Annual Review of Neuroscience,2006,29:507-538.
[36]Qiao LY,Vizzard MA.Cystitis-induced upregulation of tyrosine kinase(TrkA,TrkB)receptor expression and phosphorylation in rat micturition pathways[J].Journal of Comparative Neurology,2002,454(2):200-211.
[37]Pinto R,Frias B,Allen S,et al.Sequestration of brain derived nerve factor by intravenous delivery of TrkB-Ig2 reduces bladder overactivity and noxious input in animals with chronic cystitis[J].Neuroscience,2012,166(3):907-916.
[38]Antunes-Lopes T.Urinary levels of brain derived neurotrophic factor(BDNF)in women with overactive bladder(OAB)syndrome correlate with the severity of symptoms.European Urology Supplements,2011,10(2):277-278.
[39]Liu HT,Kuo HC.Urinary nerve growth factor levels are elevated in patients with overactive bladder and do not significantly increase with bladder distention[J].Neurourology and Urodynamics,2009,28(1):78-81.
[40]Cruz F.NGF-induced detrusor overactivity is TRPV1 dependent.European Urology Supplements,2010,9(2):69.
[41]Seki S,Sasaki K,Igawa Y,et al.Suppression of detrusor-sphincter dyssynergia by immunoneutralization of nerve growth factor in lumbosacral spinal cord in spinal cord injured rats.J Urol,2004;171:478-482.
[42]Liu HT,Chancellor MB,Kuo HC.Urinary nerve growth factor levels are elevated in patients with detrusor overactivity and decreased in responders to detrusor botulinum toxin-A injection[J].European U-rology,2009,56(4):700-707.
[43]Hu VY,Zvara P,Dattilio A,et al.Decrease in bladder overactivity with REN1820 in rats with cyclophosphamide induced cystitis[J].Journal of Urology,2005,173(3):1016-1021.
[44]Kim JC,Park EY,Seo SI,et al.Nerve growth factor and prostaglandins in the urine of female patients with overactive bladder[J].Journal of Urology,2006,175(5):1773-1776.
[45]Yokoyama O,Miwa Y,Oyama N,et al.Antimuscarinic drug inhibits detrusor overactivity induced by topical application of prostaglandin E2 to the urethra with a decrease in urethral pressure[J].Journal of Urology,2007,178(5):2208-2212.
[46]Su XL,Leon AC,Wu W,et al.Modulation of bladder function by prostaglandin EP3 receptors in the central nervous system[J].American Journal of Physiology,2008,295(4):F984-F994.
[47]Liu HT,Tyagi P,Chancellor MB,et al.Urinary nerve growth factor but not prostaglandin E2 increases in patients with interstitial cystitis/bladder pain syndrome and detrusor overactivity[J].British Journal of Urology International,2010,106(11):1681-1685.
[48]Tyagi P,Barclay D,Zamora R,et al.Urine cytokines suggest an inflammatory response in the overactive bladder:a pilot study[J].International Urology and Nephrology,2010,42(3):629-635.
[49]Comp'erat E,Reitz A,Delcourt A,et al.Histologic features in the urinary bladder wall affected from neurogenic overactivity-a comparison of inflammation,oedema and fibrosis with and without injection of botulinum toxin type A[J].European Urology,2006,50(5):1058-1064.
[50]Apostolidis A,Jacques TS,Freeman A,et al.Histological changes in the urothelium and suburothelium of human overactive bladder following intradetrusor injections of botulinum neurotoxin type A for the treatment of neurogenic or idiopathic detrusor overactivity[J].European Urology,2008,53(6):1245-1253.
[51]Chuang YC,Tyagi V,Liu RT,et al.Urine and serum C-reactive protein levels as potential biomarkers of lower urinary tract symptoms[J].Urological Science,2010,21(3):132-136.
[52]Kupelian V,McVary KT,Barry MJ,et al.Association of Creactive protein(CPR)and lower urinary tract symptoms in men and women:results from boston area community health survey[J].Urology,2009,73(5):950-957.
[53]Kuo HC.Measurement of detrusor wall thickness in women with overactive bladder by transvaginal and transabdominal sonography[J].International Urogynecology Journal and Pelvic Floor Dysfunction,2009,20(11):1293-1299.
[54]Oelke M,Höfner K,Jonas U,et al.Diagnostic accuracy of noninvasive tests to evaluate bladder outlet obstruction in men:detrusor wall thickness,uroflowmetry,postvoid residual urine,and prostate volume[J].European Urology,2007,52(3):827-835.
[55]Kuo HC,Liu HT,Chancellor MB.Urinary nerve growth factor is a better biomarker than detrusor wall thickness for the assessment of overactive bladder with incontinence[J].Neurourol Urodyn,2010,29(3):482-487.
[56]Roosen A,Chapple CR,Dmochowski RR,et al.A refocus on the bladder as the originator of storage lower urinary tract symptoms:a systematic review of the latest literature[J].Eur Urol,2009,56(5):810-819.
[57]Kuo HC,Liu HT,Chancellor MB.Can urinary nerve growth factor be a biomarker for overactive bladder[J].Rev Urol,2010,12(2-3):69-77.
[58]Pinggera GM,Mitterberger M,Steiner E,et al.Association of lower urinary tract symptoms and chronic ischaemia of the lower urinary tract in elderly women and men:assessment using colour Doppler ultrasonography[J].BJU Int,2008,102(4):470-474.
[59]Mitterberger M,Pallwein L,Gradl J,et al.Persistent detrusor overactivity after transurethral resection of the prostate is associated with reduced perfusion of the urinary bladder[J].BJU Int,2007,99(4):831-835.
