鼻脑通鼻用喷雾剂抑制过氧化氢致SH-SY5Y神经细胞损伤的研究△
2014-11-03侯虹丽孙芳玲咸明慧赵润怀肖苏萍艾厚喜张丽王文
侯虹丽,孙芳玲,咸明慧,赵润怀,肖苏萍,艾厚喜,张丽,王文*
(1.首都医科大学 宣武医院,北京 100053;2.北京祈福瑞草医药科技有限公司,北京 100094;3.中国药材公司,北京 100195)
“重大新药创制”科技重大专项(2011ZX09102-003-05)
*
王文,主要研究方向:神经药理、中药药理;Tel:(010)83198881,E-mail:lzwwang@163.com
鼻脑通鼻用喷雾剂抑制过氧化氢致SH-SY5Y神经细胞损伤的研究△
侯虹丽1,孙芳玲1,咸明慧2,赵润怀3,肖苏萍3,艾厚喜1,张丽1,王文1*
(1.首都医科大学 宣武医院,北京 100053;2.北京祈福瑞草医药科技有限公司,北京 100094;3.中国药材公司,北京 100195)
目的研究鼻脑通对H2O2诱导的人神经母细胞瘤细胞系SH-SY5Y细胞损伤的影响。方法培养的人神经母细胞瘤细胞系SH-SY5Y细胞给予鼻脑通(0.04,0.4,4 μg·mL-1)预孵育24 h后,加入H2O21 000 μmol·L-1作用18 h诱导产生损伤,测定细胞上清液中血管活性肽内皮素-1(ET-1)、降钙素基因相关肽(CGRP);炎症因子白细胞介素-1α(IL-1α)、白细胞介素-8(IL-8);致痛物质P物质(SP)、5-羟色胺(5-HT)、一氧化氮(NO)的含量。结果与对照组相比,损伤组细胞上清液血管活性肽ET-1、CGRP含量显著增多(P<0.01,P<0.05);炎症因子IL-8含量显著增多(P<0.01);致痛物质SP、5-HT、NO含量显著增多(P<0.01,P<0.01,P<0.05)。而与损伤组相比,鼻脑通中、高剂量组细胞上清液血管活性肽ET-1含量降低(P<0.05,P<0.001),且炎症因子IL-8含量也降低(P<0.05,P<0.01);鼻脑通中、高剂量组致痛物质SP含量比损伤组减少(P<0.05,P<0.05),高剂量组5-HT、NO含量比损伤组减少(P<0.05,P<0.05)。结论鼻脑通治疗偏头痛的机制可能与降低H2O2诱导的SH-SY5Y细胞损伤后血管活性肽ET-1、炎症因子IL-8释放以及抑制致痛物质SP、5-HT、NO的释放有关。
鼻脑通;SH-SY5Y神经细胞;ET-1;CGRP;IL-1α;IL-8;SP;5-HT;NO
国内外研究表明,多种心血管疾病和神经系统疾病在一定程度上归咎于炎症反应,而活性氧(ROS)则是炎症反应的重要诱发因素之一[1]。过氧化氢(H2O2)常用作细胞氧化损伤的诱导剂,通过诱导ROS产生,引发炎症反应,从而参与多种神经系统等疾病的发病机制。文献报道显示,在心肌细胞H2O2诱导损伤模型上,观察到细胞内TNF-α、TGF-β1、NF-κB等炎症因子的表达[2];在小鼠皮层神经元H2O2诱导损伤模型和SH-SY5Y细胞氧化损伤模型上,检测亲环蛋白A(CypA)的表达[3];在人脐静脉内皮细胞H2O2诱导损伤模型,来检测IL-6、NF-ΚB-P65炎症因子的表达[4];以及在支气管上皮细胞H2O2诱导损伤模型,检测白细胞介素-8与谷胱甘肽的表达[5]。可见H2O2损伤细胞模型已成为研究心血管和神经系统疾病炎性机制及抗炎治疗的常用模型。
偏头痛是一种临床常见的慢性神经血管紊乱性疾病,其特点是反复发作并伴有恶心、呕吐、畏光、畏声的单侧头痛。尽管偏头痛的病理生理机制尚未被完全阐明,目前认为三叉神经血管学说在偏头痛发病机制中占主导地位,神经源性炎症是其中的关键环节[6]。最新研究显示,非甾体抗炎药可有效治疗偏头痛及其发作过程中颅内炎症介质水平的升高,并据此提出了新的假说,即偏头痛是一种炎性疾病[7]。
鼻脑通鼻用喷雾剂是根据中医“脑窍通于鼻”、“纳鼻而通十二经”理论研发,集川芎、冰片、大果木姜子等中药辛温活血、通窍止痛的组方,一部分中药经水提、浓缩、醇沉、回收乙醇得浸膏;一部分中药经醇提、水提和直接溶解,再经β-环糊精包合、配液等现代工艺精制而成的鼻用喷雾剂。本药采用液相、气相色谱法对处方中川芎、冰片的质量进行测定,对川芎、大果木姜子等进行薄层色谱鉴别,对每喷剂量、pH值、微生物限量等进行了规定。经动物药效、毒理试验研究和药物稳定性研究证明,本药物具有速效止痛的药效,无明显毒副作用,且质量稳定可控,目前已获得国家药物临床批件。本实验在SH-SY5Y细胞损伤模型上,检测鼻脑通对血管肽内皮素-1(ET-1)、降钙素基因相关肽(CGRP)和相关炎症因子白介素-1α(IL-1α)、白介素-8(IL-8)以及致痛物质P物质(SP)、5-羟色胺(5-HT)、一氧化氮(NO)的影响,以探讨鼻脑通治疗偏头痛的可能机制,为寻找预防和治疗偏头痛的有效药物提供依据。
1 材料
1.1 药品与试剂
鼻脑通鼻用喷雾剂(中国药材公司提供,规格:0.8 mg·mL-1,即1 mL溶液中含有0.8 mg生药量)。人神经母细胞瘤SY5Y细胞株(瑞典卡罗林斯卡研究所Bengt Winblad 教授和裴进京博士赠送)。DMEM-F12(Gibco,Cat No:12400-024,Lot No:984278)。胎牛血清(浙江天杭生物科技有限公司,批号:121017)。二甲基亚砜(DMSO)(Amresco,Lot No:12A0219。30%H2O2(北京化工厂,批号:20120331)。5-HT试剂盒(南京建成生物工程研究所,批号:LOT#M20130331,生产日期:20130331)。NO试剂盒(南京建成生物工程研究所,批号:20130318,有效日期:20130617)。SP试剂盒(南京建成生物工程研究所,批号:LOT#M20130331)。ET-1试剂盒(南京建成生物工程所,批号:LOT#M20130402)。CGRP试剂盒(南京建成生物工程所,批号:LOT#M20130402)。IL-1α试剂盒:南京建成生物工程研究所,批号:LOT#M20130330)。IL-8试剂盒(南京建成生物工程研究所,批号:LOT#M20130330)。
1.2 仪器与设备
IX71倒置显微镜(OLYMPOS),CO2培养箱(SANYO),全波长酶标仪(Thermofisher Multiskan Spectrum)。BY-R320低温高速离心机(北京白洋医用离心机有限责任公司),HP8453紫外-可见分光光度计(美国惠普)。
2 方法
2.1 细胞培养及样品处理
SH-SY5Y细胞于DMEM-F12培养基中加入体积分数为10%的灭活胎牛血清、青霉素1×105U·L-1、链霉素1×105U·L-1,在体积分数为5% 、37 ℃的CO2培养箱中培养,每周换液3次,传代2次。
细胞以1×104·mL-1密度接种在96孔培养板中,每孔加入150 μL完全培养基,37 ℃、5% CO2培养24 h,吸弃原完全培养基后,空白组和损伤组分别加入70 μL无血清培养基,损伤加药组分别加入终浓度为0.04,0.4,4 μg·mL-1的70 μL无血清培养基,37 ℃、5%CO2培养24 h,吸弃培养基后,空白组加入70 μL无血清培养基,其余各组加入70 μL 1 000 μmol·L-1H2O2损伤18 h,吸取上清液。
按照试剂盒的说明进行血管肽ET-1、CGRP和炎症因子 IL-1α、IL-8以及致痛物质SP、5-HT、NO各项指标的测定。
2.2 统计学处理
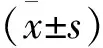
3 结果
3.1 鼻脑通对H2O2损伤诱导血管肽ET-1、CGRP升高的影响
与对照组相比,损伤组细胞上清液ET-1含量升高(P<0.01)。给药组(中、高剂量)细胞上清液ET-1含量比损伤组降低(P<0.05,P<0.001),表明鼻脑通能降低H2O2诱导SH-SY5Y细胞氧化损伤后ET-1的含量,见图1。与对照组相比,损伤组细胞上清液CGRP含量升高(P<0.05),而鼻脑通给药组细胞上清液CGRP含量与损伤组相比无明显差别,见图2。
3.2 鼻脑通对H2O2损伤诱导炎症因子IL-8、IL-1α升高的影响
与对照组相比,损伤组细胞上清液IL-8含量升高(P<0.01)。给药组(中、高剂量)细胞上清液IL-8含量比损伤组降低(P<0.05,P<0.01),表明鼻脑通能降低H2O2诱导SH-SY5Y细胞氧化损伤后IL-8的含量,见图 3。同时检测IL-1α的含量,与对照组相比,损伤组细胞上清液IL-1α有升高趋势,但鼻脑通给药组细胞上清液IL-1α含量与损伤组相比无明显差异,见图 4。
3.3 鼻脑通对H2O2损伤诱导致痛物质SP、5-HT、NO升高的影响
与对照组相比,损伤组细胞上清液SP含量升高(P<0.01)。给药组(中、高剂量)细胞上清液SP含量比损伤组降低(P<0.05,P<0.01),表明鼻脑通能降低H2O2诱导SH-SY5Y细胞氧化损伤后SP的含量,见图5。
与对照组相比,损伤组细胞上清液5-HT含量明显升高(P<0.01)。给药组(高剂量)细胞上清液5-HT含量比损伤组降低(P<0.05),表明鼻脑通能降低H2O2诱导SH-SY5Y细胞氧化损伤后5-HT的含量,见图6。
与对照组相比,损伤组细胞上清液NO含量升高(P<0.05)。给药组(高剂量)细胞上清液NO含量比损伤组降低(P<0.05),表明鼻脑通能降低H2O2诱导SH-SY5Y细胞氧化损伤后NO的含量,见图7。
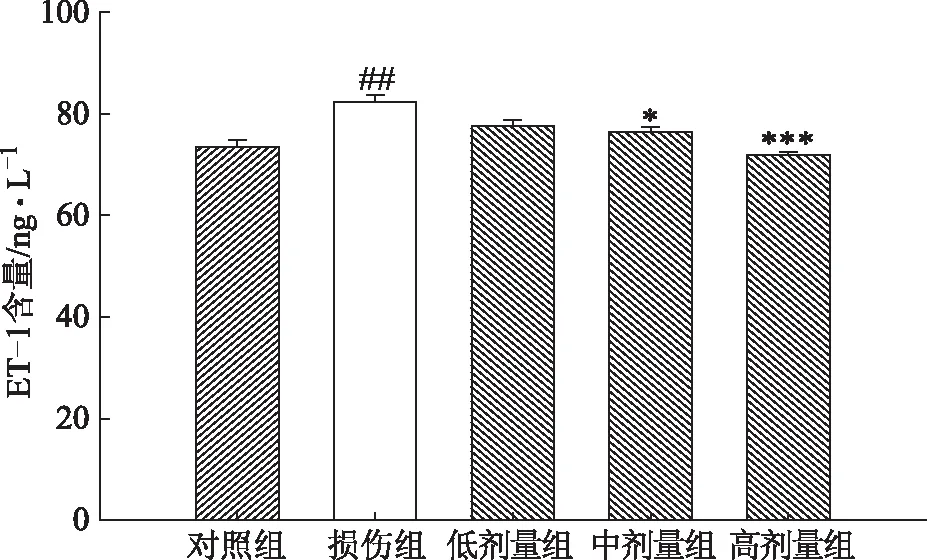
注:与对照组比较,## P<0.01;与损伤组比较,* P<0.05,***P<0.001图1 鼻脑通对细胞上清液ET-1含量的影响
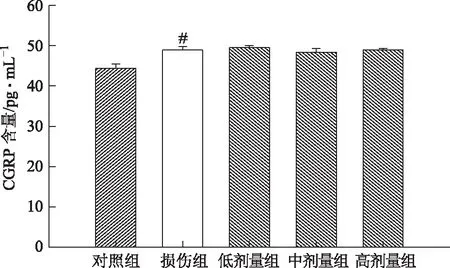
注:与对照组比较,#P<0.05图2 鼻脑通对细胞上清液CGRP含量的影响

注:与对照组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01图3 鼻脑通对细胞上清液IL-8含量的影响
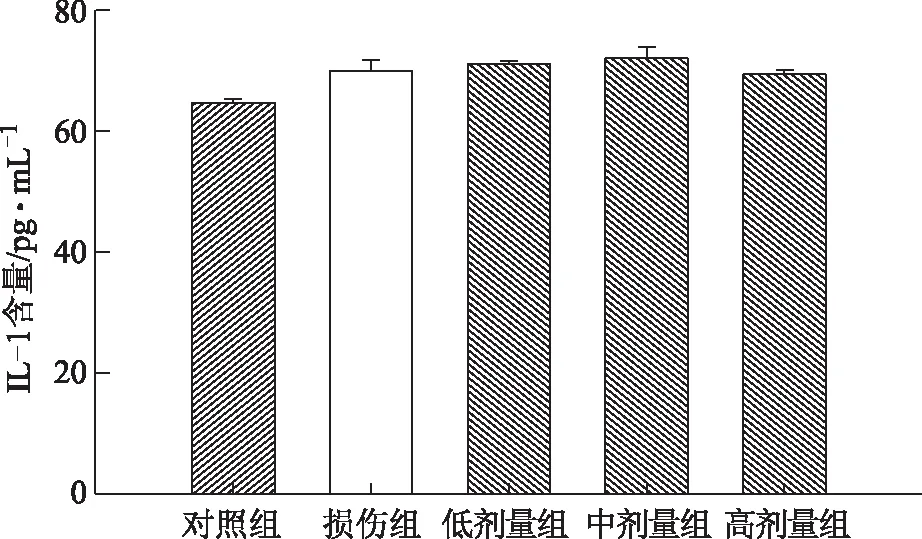
图4 鼻脑通对细胞上清液IL-1α含量的影响

注:与对照组比较,#P<0.01;与模型组比较,*P<0.05图5 鼻脑通对损伤组细胞上清液SP含量的影响
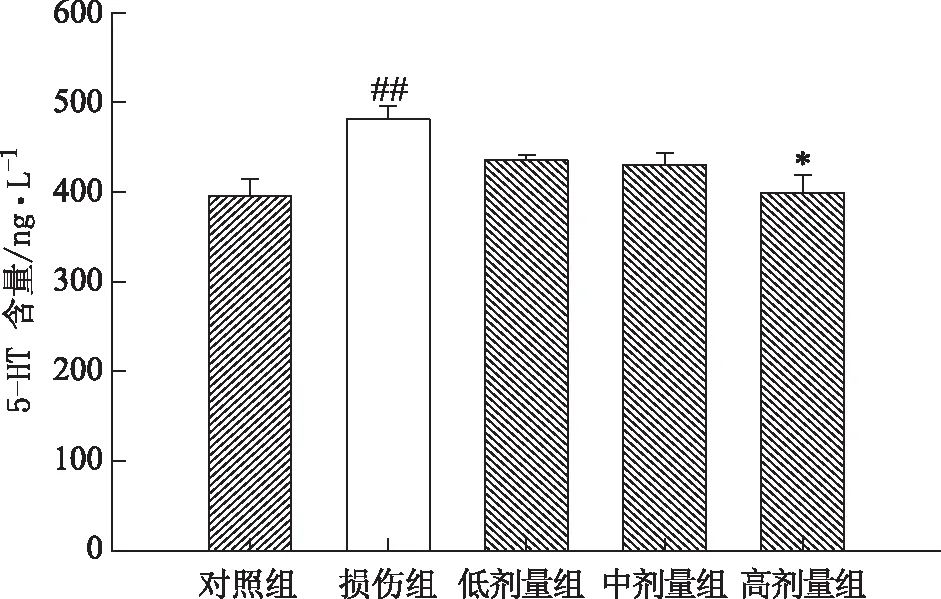
注:与对照组比较,##P<0.01;与模型组比较,*P<0.05图6 鼻脑通对损伤组细胞上清液5-HT含量的影响
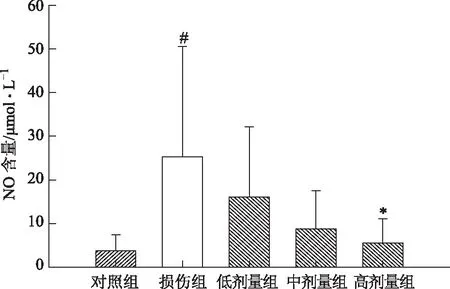
注:与对照组比较,#P<0.05;与模型组比较,*P<0.05图7 鼻脑通对损伤组细胞上清液NO含量的影响
4 讨论
根据WHO全球疾病负担调查,2000年结果显示,偏头痛被列为世界第19种致残原因,占全年残疾的1.4%;2010年结果显示,偏头痛则上升为全球第7种致残原因[8]。虽然偏头痛病理生理学的确切机制仍不清楚,但近年对其病理机制的研究有了很大的进展,认为其涉及5-HT、CGRP、NO等多种因素[9]。偏头痛的发作涉及中枢神经系统的主要活动,可能牵涉到离子通道和环境的变化,进而导致皮层扩布性抑制[10],由于脑功能障碍而激活三叉神经血管系统,进一步激活三叉神经血管反射,导致脑膜血管过度扩张,血浆蛋白渗出,肥大细胞释放组胺,血管周围神经释放血管活性肽如CGRP、ET等引起神经源性炎症,释放许多炎性细胞因子如白介素-1、白介素-2、白介素-6、白介素-8、白介素-10和肿瘤坏死因子,以及血管致痛物质SP、5-HT、His、NO等[11]。在体外实验研究中,H2O2损伤细胞模型被广泛用于炎症机制以及药物干预作用的研究。大量研究表明[12-13],氧化应激可导致机体产生内源性的损伤,激活炎性相关信号通路,通过促进如NF-κB核因子的表达,进一步增加细胞因子如IL-1、IL-6等的释放,介导炎症反应。据报道[14],NF-κB/crel家族的某些转录因子可以直接被过氧化氢或电离辐射激活。陈花[15]在细胞过氧化氢模型上研究了辛伐他汀对炎症因子血管黏附蛋白-1、核因子-κB表达的影响,证明辛伐他汀可抑制过氧化氢诱导的兔血管平滑肌细胞核因子-κB的表达,具有抗炎抗氧化的作用;Schreck等[16]研究显示,过氧化氢损伤Jurkat T细胞,可以激活NF-κB,从而介导炎症因子的释放。本文在过氧化氢损伤SH-SY5Y细胞模型上检测IL-1、IL-8、NO等多种炎症反应相关因子的含量,表明鼻脑通喷雾剂可以抑制炎症相关因子的释放。
CGRP是三叉神经疼痛信号的主要介质[17],在三叉神经的卫星细胞中检测到功能性CGRP受体,具有一定的促炎效应,能显著增加IL-1β的作用,增加COX-2酶的表达和激活以及NO合酶和IL-1β的表达。CGRP在皮层的星型胶质细胞中也能产生轻微的促炎效应。偏头痛发作时在血清、脑脊液和唾液中CGRP水平升高。在神经源性炎症中,硬脑膜上的受体促进细胞因子和炎症介质的释放,促进血管扩张和血管通透性的增加,CGRP介导长期持久的血管扩张,增加脑血流量,这些效应可以通过选择性CGRP受体拮抗剂来阻断。ET为强烈的脑动脉收缩剂,可能通过ETA和ETB受体介导神经的输入和输出。正常生理状态下,ET合成释放很低,偏头痛发作时ET释放增加,引发皮层扩布性抑制,ET通过血管平滑肌细胞膜上的受体与靶细胞膜结合,激活鸟苷酸环化酶、磷酸肌醇系统和Ca2+通道,增高细胞质中Ca2+浓度而影响血管张力,触发偏头痛[18-19]。在我们前期研究中显示[20],鼻脑通能降低硝酸甘油所致偏头痛动物血浆ET-1、CGRP含量,但对正常动物给予鼻脑通喷雾剂后,其对血浆炎症相关介质的释放无影响。本实验结果显示,提前加入鼻脑通预孵育24 h后,能降低H2O2诱导的细胞损伤组上清液ET-1含量,表明鼻脑通能抑制氧化损伤后神经细胞血管活性肽的释放。
偏头痛可以刺激细胞因子的释放,从而介导疼痛和免疫功能。研究表明细胞因子可能介导了偏头痛疼痛产生的神经血管炎症[21],肿瘤坏死因子(TNF-α)、IL-6均可以导致超痛觉。偏头痛发作时释放的5-HT能够引起毛细血管通透性增加,血浆成分渗出,导致头颅血管舒缩改变、脑缺血及血管性炎症,游离出疼痛介质缓激肽、前列腺素等,从而增强痛觉。目前临床应用治疗急性偏头痛的有效药物曲坦类就是5-HT1B/1D受体激动剂[6]。另外,P物质和NO也可传递痛觉信息、产生疼痛,在偏头痛的痛觉信息传递中起着重要的作用[22-23]。基于NO在偏头痛中作用的研究,最近提出了“偏头痛的NO假说”[9]:NO在偏头痛中发挥着一个显著的作用,不仅可以促进偏头痛的发作,而且涉及到发作的整个持续时间。它不仅参与痛觉的产生,而且与CGRP等重要分子之间存在一定关系。抑制NO产生或阻断NO-cGMP途径或者清除NO可能是治疗偏头痛新药物的靶标。目前n-NOS和i-NOS抑制剂已经进入早期的临床开发,用L-NMMA抑制NOS可望有效治疗急性偏头痛的发作。本实验结果显示,H2O2损伤SH-SY5Y细胞后,上清液内的IL-8、SP、5-HT、NO含量均显著增加,而给予鼻脑通提前孵育24 h可使上述几种因子含量降低,表明鼻脑通能抑制神经细胞氧化损伤后炎症因子以及致痛物质的释放。
随着对偏头痛神经生物学机制的深入研究,CGRP受体拮抗剂、前列腺类受体拮抗剂、离子通道拮抗剂等肽类受体拮抗剂已成为治疗偏头痛药物开发的新靶标[24-25]。但偏头痛患者对于此类药物的依赖性逐渐凸显,常导致药物依赖性头痛,加重原来的病情,使病情复杂化。而传统中药如天麻素、川芎嗪等都对偏头痛有一定的治疗作用,且中药作用温和,毒副作用小,将很好地改善上述药物依赖现象。本实验为鼻脑通治疗偏头痛的抗炎机制提供依据,也为中药治疗偏头痛提供了现代药理学研究基础,为偏头痛临床治疗提供更大选择空间[26]。
[1] Reddigan JI,Ardern CI,Riddell MC,et al.Relation of physical activity to cardiovascular disease mortality and the influence of cardiometabolic risk factors[J].Am J Cardiol,2011,108(10):1426-1431.
[2] 贺海波,石孟琼,罗涛,等.珠子参总皂苷减弱炎症应答和对H2O2诱导新生大鼠心肌细胞损伤的保护作用[J].中药药理与临床,2012,28(2):50-54.
[3] 杨俊霞,杨惠超,王东江,等.银杏内酯对过氧化氢损伤的皮层神经元和SH-SY5Y细胞亲环蛋白A(CypA)表达的影响[J].中国医药导报,2011,8(17):5-8.
[4] 许昌声,宁若冰,柴大军,等.麝香保心丸对过氧化氢诱导人脐静脉内皮细胞凋亡及炎症因子表达的影响[J].中国动脉硬化杂志,2011,19(10):813-818.
[5] 何志义,邹朝霞,于亮,等.红霉素对过氧化氢刺激的支气管上皮细胞表达白细胞介素-8与谷胱甘肽的影响[J].中华医学杂志,2005,85(14):976-980.
[6] 郭丽,王舒,石学敏.偏头痛与神经源性炎症的关系[J].中国临床康复,2006,10(42):118-120.
[7] Jin Yan,Ohannes K Melemedjian,Theodore J Price,et al.Sensitization of dural afferents underlies migraine-related behavior following meningeal application of interleukin-6(IL-6)[J].Molecular Pain,2012,8:6.
[8] Timothy J Steiner,Lars J Stovner,Gretchen L Birbeck.Migraine: the seventh disabler[J].Cephalalgia,2013,33(5): 289-290.
[9] Jes Olesen.The role of nitric oxide(NO) in migraine,tension-type headache and cluster headache[J].Pharmacology & Therapeutics,2008,120:157-171 .
[10] Lars Edvinsson,Carlos M.Villalón,Antoinette MaassenVanDenBrink.Basic mechanisms of migraine and its acute treatment[J].Pharmacology and Therapeutics,2012,136:319-333.
[11] Francesca Galletti,Letizia Maria Cupini,Ilenia Corbelli,et al.Pathophysiological basis of migraine prophylaxis[J].Progress in Neurobiology,2009,89:176-192.
[12] Lacraz G,Giroix MH,Kassis N,et al.Islet endothelial activation and oxidative stress gene expression is reduced by IL-1Ra treatment in the type 2 diabetic GK rat[J].PLOS One,2009,4(9):e6963.
[13] 朱玲娜,唐丽琴.糖尿病肾病中氧化应激对炎症细胞因子的影响[J].安徽医药,2012 16(9):1226-1229.
[14] Yasunari K,Maeda K,Minami,et al.HMG-CoA reductase inhibitors prevent migration human coronary smooth muscle cells through suppression of increase in oxidative stress[J].Arterioscler Thromb Vasc Biol,2001,21(6):937-942.
[15] 陈花.炎症、氧化应激与动脉粥样硬化的关系及辛伐他汀抗炎、抗氧化作用的研究[D].西安:第四军医大学,2008.
[16] Schreck R,Rieber P,Baeuerle PA.Reactive oxygen intermediates as apparently widely used messengers in the activation of the NF-kappa B transcription factor and HIV-1[J].EMBO J,1991,10(8): 2247-2258.
[17] Alice De Corato,Lucia Lisi,Alessandro Capuano,et al.Trigeminal satellite cells express functional calcitonin gene-related peptide receptors,whose activation enhances interleukin-1βpro-inflammatory effects.[J].Journal of Neuroimmunology,2011,237: 39-46.
[18] Floris H Vanmolkot,Jan N de Hoon.Endothelial function in migraine: a cross-sectional study[J].BioMed Central,2010,10: 119.
[19] 谭亮,樊光辉.偏头痛发病机制的研究进展[J].中国临床神经外科杂志,2012,17(9):571-573.
[20] 侯虹丽,孙芳玲,咸明慧,等.鼻脑通鼻用喷雾剂对实验性偏头痛动物ET-1、CGRP含量的影响[J].中国现代中药,2013,15(12):1050-1053.
[22] 姜磊,于生元,刘若卓,等.NO与偏头痛中枢敏化关系的初步研究[J].中国疼痛医学杂志,2009,15(1):14-17.
[23] 朱博驰,姚刚,于挺敏,等.头痛宁胶囊对偏头痛大鼠中脑P物质mRNA表达的影响[J].中国疼痛医学杂志,2012,18(10):623-627.
[24] Jes Olesen,Messoud Ashina.Emerging migraine treatments and drug targets[J].Trends in Pharmacological Sciences,2011,32(6):352-359.
[25] Lars Edvinsson,Carlos M.Villalón,Antoinette MaassenVanDenBrink.Basic mechanisms of migraine and its acute treatment[J].Pharmacology and Therapeutics,2012,136:319-333.
[26] 李亚楠,李英杰,郭英俊,等.偏头痛治疗的现状[J].脑与神经疾病杂志,2013,21(2):159-161.
BinaotongInhibitsH2O2-inducedInjuryinSH-SY5YNeuroblastomaCells
HOUHongli1,SUNFangling1,XIANMinghui2,ZHAORunhuai3,XIAOSuping3,AIHouxi1,ZHANGLi1,WANGWen1*
(1.XuanwuHospitalofCapitalMedicalUniversity,Beijing100053,China;2.BeijingQiFuRuiCaoPharm-TechCo.,Ltd.,Beijing100094,China;3.ChinaNationalGroupCorp.ofTraditional&HerbalMedicine,Beijing100195,China)
Objective:To study the effects of binaotong on H2O2-induced oxidative injury in SH-SY5Y neuroblastoma cells.MethodsSH-SY5Y cells were pre-incubated with binaotong(0.04,0.4,4 μg·mL-1) for 24 h prior to exposure to H2O2(1 000 μmol·L-1) for 18 h.The content of vasoactive petide endothelin-1(ET-1),calcitonin gene-related peptide(CGRP);inflammatory cytokines interleukin-1α(IL-1α),interleukin-8(IL-8);pain producing substance substance P(SP),5-hydroxy-tryptamine(5-HT),nitric oxide(NO) were determined through supernatant.ResultsPretreatment the cells with binaotong(0.04,0.4,4 μg·mL-1),supernatant of each injury group of vasoactive petide ET-1,CGRP were increased significantly compared with control group(P<0.01,P<0.05);supernatant of injury group of inflammatory cytokine IL-8 was increased significantly compared with control group(P<0.01);supernatant of each injury group of pain producing substance SP,5-HT,NO were increased compared with control group(P<0.01,P<0.01,P<0.05).However,supernatant vasoactive petide ET-1 level was decreased in the binaotong treated group with middle dose and high dose(P<0.05,P<0.001),and supernatant inflammatory cytokine IL-8 level was also decreased(P<0.05,P<0.01);supernatant pain producing substance SP level was decreased in the binaotong treated group with middle dose and high dose(P<0.05,P<0.05),supernatant pain producing substance 5-HT,NO level were decreased in the binaotong treated group of high dose(P<0.05,P<0.05).ConclusionDecreased supernatant vasoactive petide ET-1 level and inflammatory cytokine IL-8 level and pain producing substance SP,5-HT,NO levels after H2O2-induced injury in SH-SY5Y neuroblastoma cells were the possible mechanisms of binaotong in treating migraine.
Binaotong;SH-SY5Y neuroblastoma cells;ET-1;CGRP;IL-1α;IL-8;SP;5-HT;NO
10.13313/j.issn.1673-4890.2014.05.007
2013-1
1-05)
