当归不定根的诱导研究△
2014-11-03张延红高素芳陈红刚李应东
张延红,高素芳,陈红刚,李应东
(甘肃中医学院 药学系,甘肃 兰州 730000)
“十二五”国家科技支撑计划课题(2011BAI05B02)
*
张延红,副教授,研究方向:药用植物育种和组织培养;Tel:18909449018,E-mail:zhyh456789@163.com
当归不定根的诱导研究△
张延红*,高素芳,陈红刚,李应东
(甘肃中医学院 药学系,甘肃 兰州 730000)
目的建立不定根诱导技术体系,为当归不定根的大规模生产奠定基础。方法以当归种子无菌发芽小苗和休眠芽为试验材料,研究培养基种类、有机物组分及激素组合对当归不定根诱导和生长的影响。结果最佳的不定根诱导外植体是休眠芽叶片、胚轴和根;不同VB1和VB6浓度比例对当归不定根生长的影响显著,其中VB11.0 mg·L-1和VB60.5 mg·L-1组合诱导效果最佳,适当提高VB1浓度可以促进当归不定根的诱导;IBA 0.5 mg·L-1+IAA 2.0 mg·L-1激素组合适宜于不定根诱导。结论建立了当归不定根诱导的技术体系。
当归;组织培养;不定根;诱导;继代培养
当归Angelicasinensis(Oliv.)Diels为伞形科当归属多年生草本植物,以根入药,是我国常用名贵中药材之一,具有补血活血、抗缺氧,调节机体免疫、抗动脉硬化、护肤美容等作用[1]。全国有85%以上的当归产自甘肃,当归是甘肃的特色道地药材。随着国际和国内市场对当归需求量的日益增加,野生当归已难觅踪迹,而当归的栽培对于自然条件的要求又很严格,同时生产中又存在着早期抽薹和多种病虫害等难题,严重影响其药材的优质高产[2]。不定根培养是采用植物组织培养技术大规模培养根类药材的根;不定根培养具有生长周期短、条件可控、遗传背景一致、经济方便、重复性强、效率高和可周年生长等优点,可以快速大量获得药用植物不定根及次生代谢产物,从而有效的解决资源不足等问题[3]。因此,药用植物不定根培养是开发中药资源的一条有效途径。本研究采用植物组织培养的方法诱导产生不定根,旨在为当归不定根的大规模生产奠定基础。
1 材料与仪器
1.1 材料
先将当归种苗的休眠芽从基部切下,根切成4~5 cm的小段。然后将休眠芽、根段和种子先用自来水冲洗30 min,然后用75%乙醇灭菌10 s,再用0.1%升汞灭菌(休眠芽和种子灭菌5 min,根段灭菌10 min),最后用无菌水冲洗3遍,用无菌滤纸吸干表面水分。将休眠芽和种子接种于1/2 MS培养基中,待萌发后取休眠芽叶片,发芽小苗的子叶、胚轴和胚根作外植体。将根段切成1~2 mm厚的薄片作外植体。
1.2 试剂
大量元素;微量元素,有机元素,激素及其它化学药品和试剂均为进口或国产分析纯以上。
1.3 仪器
超净工作台(苏州净化SW-SJ-1D);高压灭菌锅(上海申安LDZX-30KBS);人工气候箱(南京贝蒂BD-PGX);酸度计(意大利哈纳HI98127);电子天平(德国赛多利斯BSA623S)。
2 方法
2.1 不同培养基类型诱导当归根片生根
以当归根片为外植体,MS和1/2 MS(无机盐减半)为基本培养基,添加IBA、KT、IBA、NAA、IAA和2,4-D,单独或配比使用,蔗糖含量30 g·L-1,琼脂含量7 g·L-1,pH 5.8,诱导不定根产生。
2.2 不同VB1 和VB6浓度诱导生根
以当归休眠芽叶片为外植体,1/2 MS(无机盐减半)为基本培养基,改变VB1和VB6浓度比例,添加2.0 mg·L-1IAA和0.5 mg·L-1IBA,诱导不定根产生。
2.3 不同基本培养基和激素组合对诱导生根的影响
将无菌小苗切割成胚根、胚轴和子叶三种外植体,接种于1/2 MS(无机盐减半)和1/2 B5(无机盐减半),同时附加两种不同种类和浓度的激素培养基中(见表1),诱导不定根产生。

表1 胚根、胚轴和子叶诱导不定根的培养基配方
注:“-”表示没有加入激素
2.4 不定根的继代培养
将以休眠芽叶片为外植体,诱导获得的不定根继代于1/2 MS(无机盐减半)为基本培养基(维生素浓度组合为1.0 mg·L-1VB1和0.5 mg·L-1VB6),添加2.0 mg·L-1IAA和0.5 mg·L-1IBA的培养基中进行继代培养,1个月后进行观察统计。
2.5 培养条件
将接种好的材料放入人工气候箱中培养,培养温度为23 ℃,湿度70%,光照时间14 h·d-1,光照强度2 000 lx。
2.6 结果统计
以不定根诱导率、根粗细、根条数为主要考察指标,结合愈伤组织情况进行统计。
3 结果与分析
3.1 不同培养基类型对当归根片不定根诱导的影响

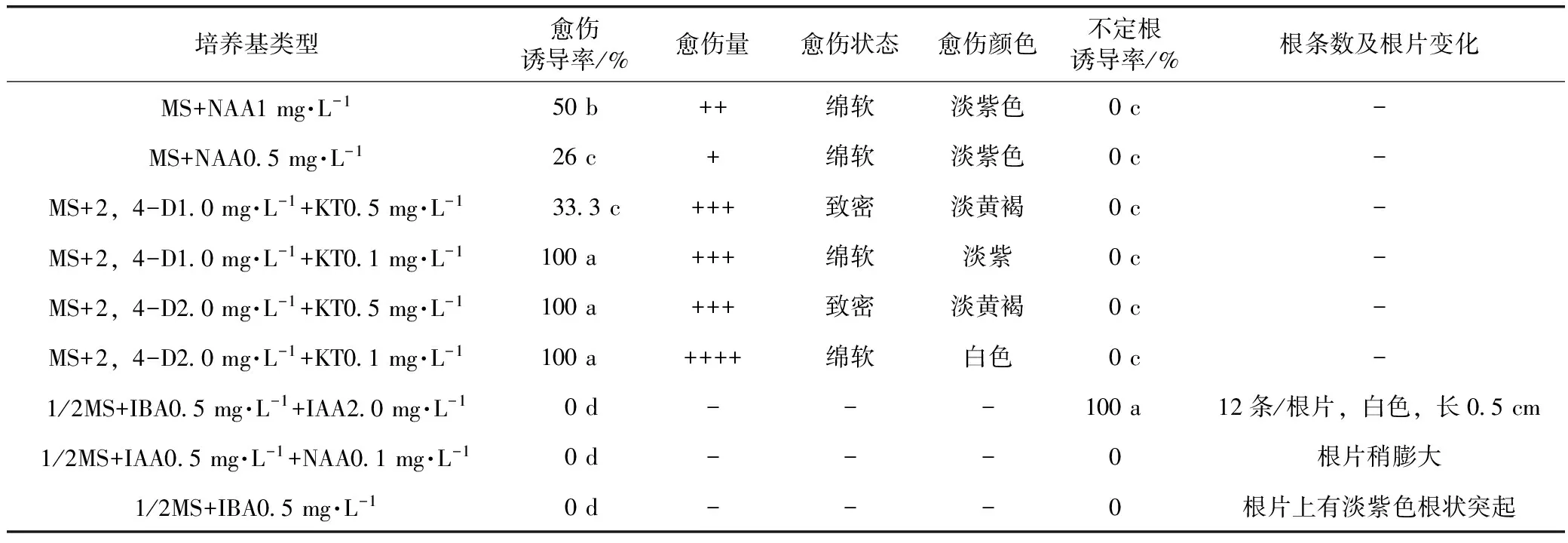
表2 不同培养基类型对当归根片不定根的诱导
续表2
注:大根片是指粗壮种苗根的中上部(直径约为1~1.5 cm);小片指细小种苗的根片;“+++”表示多,“++”表示较多,“+”表示少,“-”表示无;同列内相同字母表示邓肯氏新复极差检验在P=0.05水平上差异不显著,下同。
由表2可以看出,以当归根片为外植体,MS为基本培养基,添加不同浓度IBA和KT诱导不定根。结果表明IBA浓度在1~3 mg·L-1之间,均产生大量愈伤组织,呈绵软状,淡黄色或紫色,根片上有放射线状突起。当IBA为0.5 mg·L-1时,根片上没有愈伤组织,但仍有放射状根突起。当IBA为0.3 mg·L-1时诱导生根效果最好,0.1 mg·L-1时发根数量又减少。因此,低浓度的IBA利于不定根的直接发生,相反,高浓度的激素及其配比利于愈伤组织产生,但阻碍根的发生。以NAA诱导不定根,结果表明,NAA均可诱导愈伤产生,但愈伤量普遍较少。NAA浓度高时,愈伤呈现淡黄色,绵软状,低时,愈伤呈现淡紫色。以MS为基本培养基,附加2,4-D和KT两种激素,进行不定根诱导,结果表明2,4-D在1~2 mg·L-1之间配合使用不同浓度的KT均可诱导产生较多的愈伤组织,2,4-D和KT之间的比值较小时,愈伤多为淡黄褐,膨化致密状。在同一培养基中大根片诱导效果好,愈伤量多,小根片反应较弱,诱导效果不良。这可能是因为大根片内源激素含量较高,容易启动细胞分裂。
以1/2 MS为基本培养基,添加不同种类和浓度的生长素进行根诱导,结果表明1/2 MS+IBA 0.5 mg·L-1+IAA 2.0 mg·L-1诱导不定根的效果很好,每根片上直接诱导产生12条白色较透亮,长约0.5 cm的根。而1/2 MS+IBA 0.5 mg·L-1培养基中根片四周仅诱导产生许多淡紫色根状突起,根片膨大。MS+IBA 0.5 mg·L-1+KT 0.1 mg·L-1中也同样产生许多根状突起。由此推断,IBA对根状突起的诱导起到了决定性的作用,IAA对根的进一步的生长起到了至关重要的作用。在不同种类和浓度的激素配比中2,4-D诱导愈伤的能力明显强于其它激素,但不利于根诱导[4]。
3.2 VB1和VB6浓度对当归不定根诱导和生长的影响
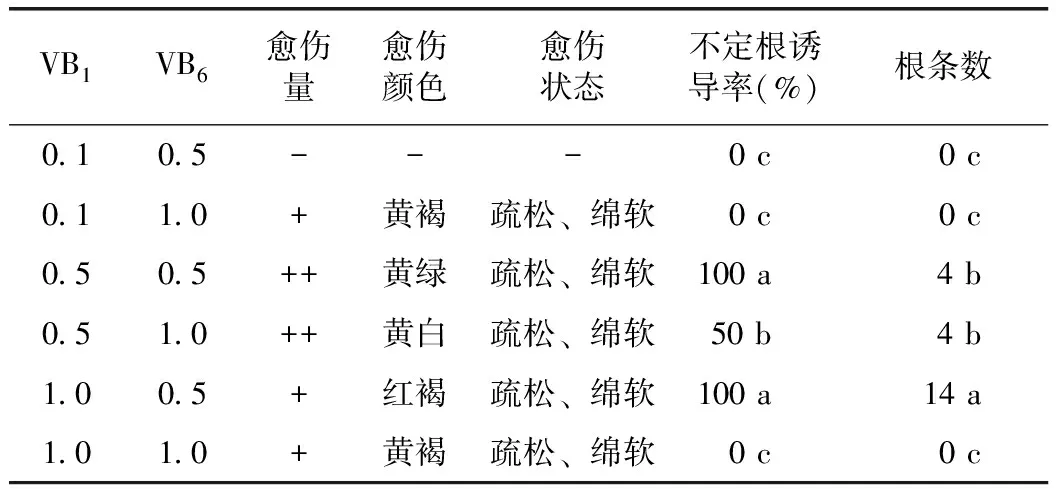
表3 VB1和VB6浓度比例对当归不定根诱导和生长的影响
由表3可以看出,以休眠芽叶片为外植体,VB1和VB6不同浓度配比对不定根诱导影响显著。VB10.1 mg·L-1和VB60.5 mg·L-1浓度配比(即原MS配方浓度)既未诱导产生不定根,也未产生愈伤组织。VB11.0 mg·L-1和VB60.5 mg·L-1浓度配比效果最佳,诱导产生的不定根数量最多,平均根条数14条,平均根长约为0.6 cm,不定根白色;VB10.5 mg·L-1和VB60.5 mg·L-1配比效果次之,不定根数量为4条,平均根长约为0.4 cm。因此,提高VB1浓度诱导当归不定根的效果显著。以不同外植体诱导不定根时,休眠芽叶片效果最好,愈伤组织与试管苗效果不良。
6种不同浓度的VB1和VB6配比对当归愈伤组织的诱导和生长的影响也有差异。VB10.5 mg·L-1和VB60.5 mg·L-1与VB10.5 mg·L-1和VB61.0 mg·L-1较对照(VB10.1 mg·L-1和VB60.5 mg·L-1)中的新生愈伤组织量增加较多、颜色与状态也较优。因此,适当增大VB1浓度也有利于当归愈伤组织诱导。
2.3 不同培养基类型诱导当归(根、胚轴和子叶)产生不定根

表4 不同培养基类型对当归(根、胚轴和子叶)不定根诱导的影响
由表4可以看出,1/2 MS+IBA 0.5 mg·L-1+IAA2.0 mg·L-1+蔗糖15 g·L-1+琼脂7 g·L-1(3号)和1/2 B5+IBA 0.5 mg·L-1+IAA 2.0 mg·L-1+蔗糖15 g·L-1+琼脂7 g·L-1(4号)培养基诱导当归愈伤组织和不定根生长效果最好,不定根诱导率为100%,不定根条数也较多,生长状态较优。不同处理根条数差异不显著。IBA 0.5 mg·L-1和IAA 2.0 mg·L-1配比诱导效果优于IAA 0.5 mg·L-1和NAA 0.1 mg·L-1。不同的外植体诱导效果差异较大,胚轴与胚根诱导产生不定根的效果较好,子叶枯黄死亡。
2.4 不定根的继代培养

表5 不定根继代培养时的生长情况
由表5可以看出,来源于不同VB1和VB6浓度组合的不定根,继代于1.0 mg·L-1VB1和0.5 mg·L-1VB6组合中,培养1个月后,其中在原培养基中继代,不定根的生长状态最好,无愈伤组织产生,根条数和根长均最大,但根中花色素苷含量较高,呈现紫色。试验也将根片诱导获得的不定根在其原培养基中进行继代培养,但根枯死或无增殖。目前,继代后根的生长速度较慢,还有待进一步深入研究。
4 结论与讨论
4.1 适宜的外植体
外植体对于不定根诱导影响显著。本研究表明,休眠芽叶片、根、胚轴为理想的不定根诱导外植体,愈伤组织、子叶诱导效果不佳。
4.2 适宜的基本培养基和激素配比
本试验结果表明,以种子发芽小苗的胚轴、胚根和子叶为外植体时,B5和MS在不定根诱导时差异不大。IAA 2.0 mg·L-1和IBA 0.5 mg·L-1激素组合诱导效果最佳。
4.3 适宜VB1和VB6浓度组合
植物体在自然条件下,有机物成分是依靠自身的代谢加以调节的,而培养的离体组织、细胞虽能合成必需的维生素,但在数量上远远不足,为了能使组织很好地生长,在培养基中必需补加维生素,一般认为VB1、VB6是两种必需的成分。本研究结果表明,适当提高VB1浓度,有利于不定根和愈伤诱导。1.0 mg·L-1VB1和0.5 mg·L-1VB6组合适宜于不定根诱导,这与番茄不定根诱导的研究结果相同[5]。
[1] 陈江弢,杨崇仁.当归属植物的研究进展[J].天然产物研究与开发,2004,(4):12-14.
[2] 雒晓芳,杨宁,陈学林,等.当归水培苗的组织培养[J].西北师范大学报,2004,40(4):77-79.
[3] 高文远,贾伟.药用植物大规模组织培养[M],第一版.北京:化学工业出版社,2004.
[4] 郭肖红,高文远,李克峰.丹参不定根组织培养的研究[J].中草药,2007,38(3):429-432.
[5] 王蒂.植物组织培养植物组织培养[M],第一版.北京:中国农业出版社,2004.
StudyonAdventitiousRootsInductionofAngelicasinensis(Oliv.)Diels
ZHANGYanhong*,GAOSufang,CHENHonggang,LIYingdong
(DepartmentofPharmacy,GansuCollegeofTraditionalChineseMedicine,Lanzhou730000,China)
Objective:To set up system of adventitious roots induction technology ofAngelicasinensis(Oliv.)Diels,which laid the foundation for its large-scale production.MethodsSeedlings from seeds germination and dormant buds as experimental material,the effects of the organic matter composition,types of culture medium,and hormone combination on adventitious roots induction and growth were studied.ResultsExplants is dormant leaf,hypocotyls and root.Different concentration of VB1and VB6had significant effects on adventitious roots growth,among which the VB11.0 mg·L-1and VB60.5 mg·L-1combination was appropriate,improving VB1concentration can promote adventitious roots induction;0.5 mg·L-1IBA and 2.0 mg·L-1IAA hormone combination was suitable for adventitious roots induction.ConclusionThe technology system of adventitious roots induction ofA.sinensiswas established.
Angelicasinensis(Oliv.)Diels;Tissue culture;Adventitious root;Induction;Subculture
10.13313/j.issn.1673-4890.2014.05.002
2014-02-03)
