左旋多巴微囊胃内漂浮片犬体内药物动力学研究
2014-11-02贺鑫韬马桂芝马文娜新疆医科大学药学院乌鲁木齐830054新疆医科大学第一附属医院药学部乌鲁木齐830054
贺鑫韬,马桂芝,滕 亮,马文娜(.新疆医科大学药学院,乌鲁木齐 830054;2.新疆医科大学第一附属医院药学部,乌鲁木齐 830054)
帕金森病(Parkinson′s disease)又称“震颤麻痹”,是一种中枢神经系统变性疾病。美国神经协会对各种抗帕金森病药物进行评估,结果表明,复方左旋多巴制剂(美多芭等)是所有帕金森病药物治疗中最有效的药物[1]。但是该片剂使用方法繁琐,给药频率高,中老年患者的用药顺应性差,同时左旋多巴在十二指肠处有一个较窄的吸收窗,普通制剂由于胃滞留时间短,无法实现充分吸收,导致制剂生物利用度不理想。
胃漂浮给药系统是依据流体动力学平衡系统(hydrodynamcally balanced system,HBS)设计的在胃中密度小于胃内容物密度(1.004~1.010g·cm-3)的给药系统。由于制剂的密度小,口服后可漂浮在胃液上,使得药物在胃肠道中总的释放时间延长,增加了药物在胃和十二指肠的吸收,降低毒副作用,提高了药物的生物利用度[2]。微囊缓释片是利用微囊技术制备缓释单元,同时结合普通的压片技术制备的新型缓释制剂。微囊型缓释制剂不仅具有普通缓释制剂的优点,同时利用刻痕压片还可实现分剂量用药。这是因为其最小缓释单元为微囊,在分剂量使用过程中并不会破坏其缓释结构。
因此,课题组结合前期研究结果[3],尝试采用复合制剂技术将其研制成微囊胃漂浮片[4],该微囊漂浮片具有缓释、胃内滞留以及可分剂量使用等特点,可以更好地满足临床用药需求。本文在相关报道[5]的基础上,建立了测定比格犬血浆中左旋多巴质量浓度的HPLC法,并对左旋多巴微囊胃漂浮片的药物动力学行为进行了研究。
1 仪器与材料
1.1 仪器 高效液相色谱仪(WAT270944,美国Waters公司),荧光检测器(Waters e 2695,美国Waters公司);分析天平(BS110S型,北京赛多利斯天平有限公司);超低温冰箱(DW-86L205,广州傲雪低温冰箱);实验室专用超纯水机(Exceed-Cd-16A,成都康宁实验专用纯水设备厂);超声波清洗器(KQ5200DE,昆山市超声仪器有限公司);高速离心机(LG10-2.4A,北京医用离心机厂)。
1.2 试药 左旋多巴对照品(中国药品生物制品检定所,批号100170-201003);左旋多巴微囊胃内漂浮片(自制,批号20121120每片98mg);高氯酸(分析纯,上海桃浦化工厂,批号950420);盐酸(分析纯,新疆烧碱厂,批号:02042052);乙二胺四乙酸(EDTA,分析纯,天津福晨化学试剂厂,批号20080902);磷酸二氢钾(优级纯,天津新精细化工开发中心,批号20050215);庚烷磺酸钠(色谱纯,上海展云化工有限公司,批号1104017);甲醇(色谱纯,Fisher Scientific公司);水为超纯水。
1.3 动物 健康Beagle犬6只,雄性,体质量12±1 kg,由新疆医科大学第一附属医院临床医学研究院实验动物科学研究部提供并饲养,实验动物使用许可证号:SYXK(新)2010-0001。伦理委员会审批号:IACUC-20120523004。
2 方法与结果
2.1 色谱条件 色谱柱:Agilent ODS-1C18柱(250 mm×4.6mm,5μm);流动相:水-甲醇(95∶5),其中水相含 EDTA 0.08mmol·L-1、磷酸二氢钾70 mmol·L-1、庚烷磺酸钠2.08mmol·L-1;流速:0.5 mL·min-1;柱温:35℃;进样量:20μL;激发波长:278nm,发射波长:325nm。
2.2 血浆样品预处理 取比格犬全血2mL,4 200 r· min-1低温(8℃)离心10min,取上层血浆,置于离心管中,加入等量60mL·L-1高氯酸溶液,涡旋振摇2min,沉淀蛋白,以10 000r·min-1离心15 min,上清液经0.22μm微孔滤膜过滤后取20μL进样分析。
2.3 方法专属性 在2.1项的色谱条件下,空白血浆、左旋多巴对照品、空白血浆加左旋多巴对照品、实际血浆样品按2.2项下处理后进样,记录色谱图(结果见图1),由图1可知,左旋多巴对照品保留时间约为8min,内源性物质、代谢产物与左旋多巴色谱峰基线分离,对左旋多巴的测定无干扰。
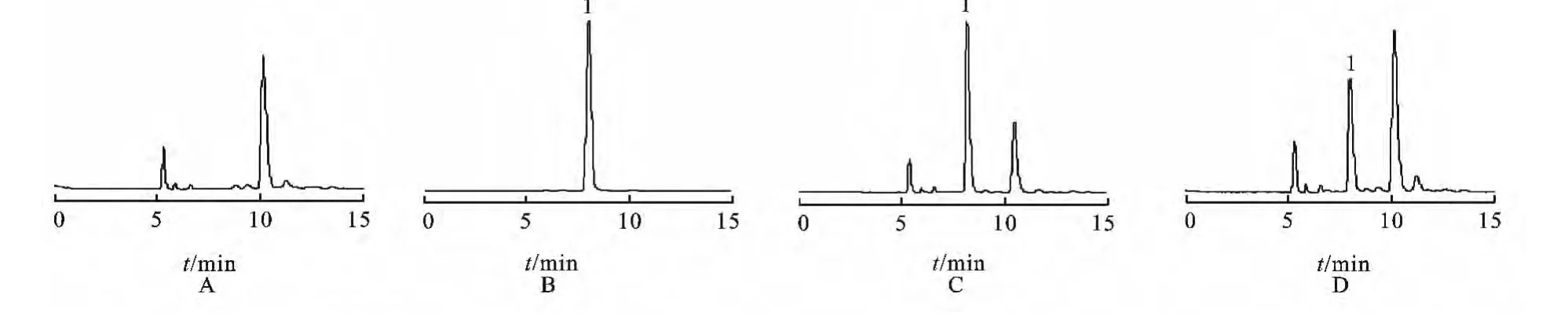
图1 HPLC图A.空白血浆;B.对照品溶液;C.空白血浆加左旋多巴对照品;D.给药后1h血浆样品;1.左旋多巴Fig.1 HPLC chromatogramsA.blank plasma;B.reference solution;C.standard plasma;D.sample-after 1hadministration;1.levodopa
2.4 标准溶液的制备 精密称取左旋多巴对照品0.005g,置于25mL量瓶中,用9mL·L-1的盐酸溶解并稀释至刻度,摇匀,作为左旋多巴储备液(200 μg·mL-1)。取储备液依次倍量稀释成质量浓度分别为200,100,50,25,12.5,6.25,3.12,1.56和0.78 μg·mL-1的系列标准溶液。
2.5 标准曲线与线性范围 分别取空白血浆500 μL 9份,精密加入不同质量浓度左旋多巴标准液50μL,使血浆中左旋多巴的质量浓度分别为20,10,5,2.5,1.25,0.62,0.31,0.16 和 0.078μg·mL-1,按2.2项下依法操作,进样20μL,记录色谱图。以待测物峰面积(Y)对左旋多巴质量浓度(X)进行线性回归,得回归方程:Y=27 006.149 1 X+479.768 7,r=0.999 9(n=8)。左旋多巴线性范围为0.078~20 μg·mL-1,质量浓度与峰面积呈良好的线性关系。采用信噪比法确定标准曲线的定量下线为(LLOQ)0.078μg·mL-1(S/N≥10)。
2.6 精密度与准确度实验 取空白血浆500μL,按2.5项下方法配制成左旋多巴低、中、高3个质量浓度(0.078,2.5和20μg·mL-1)的质量控制(QC)样品,每个质量浓度进行5个样本分析,连续测定3d,用随行的标准曲线计算QC样品的质量浓度,测定日内及日间的精密度,并与制备质量浓度比较,求得方法的准确度,结果见表1。结果表明,测定血浆中左旋多巴质量浓度的分析方法的精密度(RSD)与准确度(RE)均在15%内,符合生物样品分析方法要求。
表1 左旋多巴精密度与准确度实验结果Tab.1 Precision and accuracy of the HPLC method for levodopa(n=5,±s)
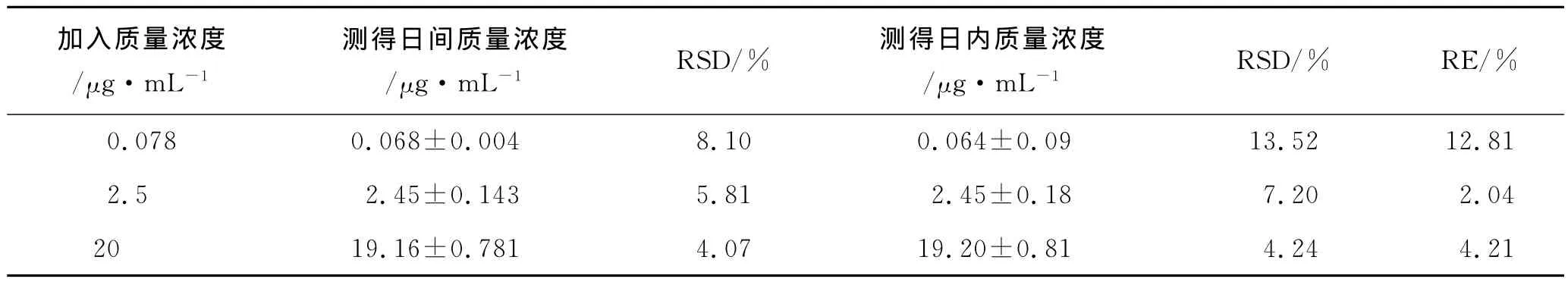
表1 左旋多巴精密度与准确度实验结果Tab.1 Precision and accuracy of the HPLC method for levodopa(n=5,±s)
加入质量浓度/μg·mL-1测得日间质量浓度RSD/% 测得日内质量浓度RSD/% RE/%/μg·mL-1 /μg·mL-1 0.078 0.068±0.004 8.10 0.064±0.09 13.52 12.81 2.5 2.45±0.143 5.81 2.45±0.18 7.20 2.04 20 19.16±0.781 4.07 19.20±0.81 4.24 4.21
2.7 稳定性实验 取空白血浆500μL,按2.5项下方法操作配制左旋多巴低、中、高3个质量浓度(分别为0.078,2.5和20μg·mL-1)的 QC样本,对每一质量浓度进行5样本分析;分别考察处理后的血浆样品于室温放置24h、血浆样品在-80℃冰箱中长期冷冻贮藏(28d)及反复冻融的稳定性,结果见表2。处理后的样品溶液于室温放置24h、血浆样品在-80℃冰箱中长期冷冻贮藏(28d)及反复冻融3次,左旋多巴含量均稳定,符合生物样品测定的要求。
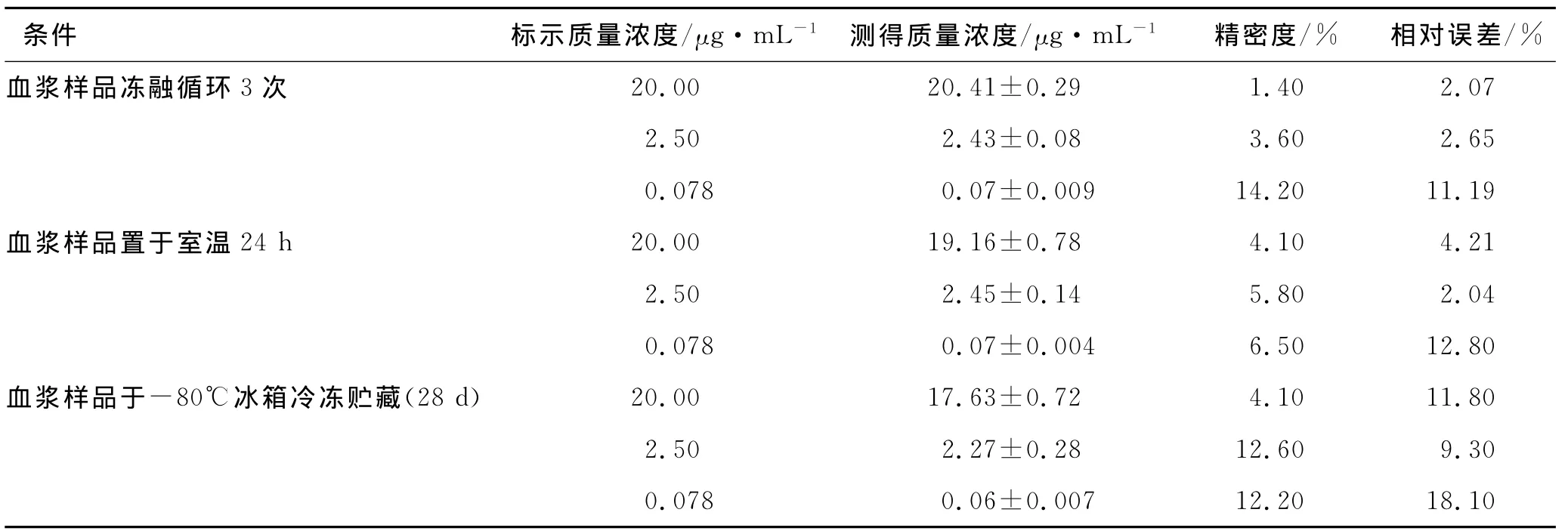
表2 稳定性实验结果Tab.2 The results of sample stability test(n=5)
2.8 提取回收率与基质效应 取空白血浆500μL,照2.5项下方法,制备左旋多巴低、中、高3个质量浓度(分别为0.078,2.5和20μg·mL-1)的质量控制样品(n=5)。另取空白血浆500μL,加等量的60 mL·L-1的高氯酸,涡旋2min,以10 000r·min-1离心10min,取上清液,加入相应的左旋多巴对照品溶液,制成左旋多巴低、中、高3个质量浓度(分别为0.078,2.5和20μg· mL-1)的未经提取的对照样品(n=5)。取不同质量浓度的标准溶液,用60 mL·L-1高氯酸稀释制成低、中、高3个质量浓度(分别为0.078,2.5和20μg·mL-1)的左旋多巴标准对照样品(n=5),进样20μL检测。结果表明,测定血浆中左旋多巴质量浓度分析方法的提取回收率分别为108.62%±12.42%,113.89%±6.51%和105.05%±4.22%,基质效应分别为 118.8% ±18.3%,92.7%±4.78%和90.60%±2.0%,均符合生物样品分析方法的要求。
2.9 Beagle犬体内药物动力学实验
2.9.1 血浆采集 6只健康Beagle犬,雄性,禁食12h(自由饮水)后,分别给予左旋多巴胃内微囊漂浮片1片(每片含左旋多巴约100mg),并在给药后多点前肢静脉采血(给药2h后给水,4h后进食),采血时间点为0.167,0.333,0.5,0.75,1,1.5,2,4,6,9和12h,所采血样肝素抗凝,离心提取血浆于-80℃冰箱保存,待测。
2.9.2 数据处理 血样按2.1项下HPLC色谱条件测定血药质量浓度,所得数据用中国药理学会数学药理专业委员会编制的3P97药代动力学程序处理。根据AIC值判定左旋多巴微囊胃内漂浮片在犬体内的药动学行为,符合单室模型。6只Beagle犬单剂量给予左旋多巴胃内微囊漂浮片的平均血药质量浓度-时间曲线见图2。对血药质量浓度进行处理,计算比格犬口服左旋多巴微囊漂浮片后的主要药物动力学参数,分别为:t1/2(1.09±0.46)h,Cl(32.78±10.24)L·h-1,Ka(1.5±0.44)h-1,tmax(1.32±0.54)h,Cmax(1.33±0.31)μg·mL-1,AUC为(3.31±1.26)μg·h·mL-1。

图2 比格犬口服左旋多巴微囊漂浮片后的平均药-时曲线Fig.2 Mean plasma concentration vs time plots of Levodopa Microcapsules Intragastric Floating Tablets in Beagle dogs after a single oral administration
3 讨论
3.1 左旋多巴的含量测定方法的选择 在文献报道中,高效液相成本比色谱质谱联用法[6-7]低,仪器在国内比较普及,其中荧光检测比紫外[8-9]灵敏度高,同时比电化学法[10-11]简便,而测定结果比毛细管电泳法[12]稳定、重复性好,所以采用 HPLC-荧光检测。
3.2 对照品溶液溶剂的选择 由于左旋多巴在乙醇、氯仿中不溶,在水中微溶,在稀酸中易溶[13],曾用纯水溶解左旋多巴对照品,但实验中发现,对照品的保留时间与经过处理的样品的RT值偏移比较明显,因此,选用体外实验时表现稳定的稀盐酸作溶剂配制左旋多巴对照品溶液。
3.3 样品处理方法的选择 沉淀法处理样品易操作、效率高、成本低,故直接选择考察蛋白沉淀剂,分别考察了等量和1/2量的200mL·L-1高氯酸、乙腈、氯仿与60mL·L-1高氯酸作为蛋白沉淀剂的分离效果,其中以60mL·L-1高氯酸处理后左旋多巴与相邻峰分离效果最优。同时,据报道,以高氯酸沉淀蛋白,当血样与高氯酸体积比为1∶1时蛋白沉淀率可达99%。因此,选择加入等量的60mL·L-1高氯酸进行样品前处理。
3.4 液相条件的选择 分别考察了下列条件对样品测定结果的影响:柱温(30,35和40 ℃);流速(0.5,0.8和1.0mL·min-1);流动相比例(水-甲醇为90∶10,92∶8和95∶5);流动相pH 值(3.2,3.7和4.2)。结果表明,当流动相(pH 约为3.7)为水-甲醇(为95∶5)、流速为0.5mL·min-1、柱温为35℃时,能够获得更为理想的色谱峰。
3.5 动物实验的预考察 在实验过程中发现,直接给予Beagle犬左旋多巴片剂后1h左右,犬会出现不同程度的恶心,呕吐出黄色的胃容物。为避免胃肠道不良反应影响药物吸收,在实验前30min先给予1片多潘立酮片以防止呕吐。文献报道[14],左旋多巴与多潘立酮没有药物动力学相互作用。预实验中发现左旋多巴在犬体内达峰时间约为90~120min左右,而所采的24h的血样中几乎检测不出左旋多巴,因此,调整采血时间点为0.167,0.333,0.5,0.75,1,1.5,2,4,6,9和12h。结果表明,该采血点设计能够满足药动学研究的要求。
3.6 初步的药动学研究结果 该微囊漂浮片中左旋多巴在比格犬体内的药动学行为符合单室模型。与文献报道的美多芭药代动力学参数相比,左旋多巴的的达峰时间延长,半衰期延长,具有比较明显的缓释制剂特征,提示漂浮片中左旋多巴的体内滞留时间有所延长,这可能是因为漂浮片中左旋多巴的表观分布容积发生改变的缘故。以上结果尚需通过生物利用度比较和多剂量给药等予以确证。
4 结论
本文建立了高效液相色谱法测定比格犬体内左旋多巴质量浓度的方法。该法符合方法学的要求,具有准确、灵敏、可重复的特点,可用于开展左旋多巴微囊胃内漂浮片比格犬体内药物动力学研究。
[1]Jankovie J.An update on the treatment of Parkinson′s disease[J].MT Sinai J Med,2006,73:682-689.
[2]王锐利,张淑秋.胃漂浮片的研究进展[J].山西医科大学学报,2005,36(2):260-262.
[3]李文英,马桂芝,滕亮.左旋多巴微囊制备工艺的研究[J].西北药学杂志,2011,26(6):442-445.
[4]Deleu D,Nonhway M G,Harsens Y.Clinical pharmacokinetic and pharmacodymmic properties of drugs used in the treatment of Parkinson′s Disease[J].Clin Pharmacokinet,2002,41:261-309.
[5]袁静,王平全,杨惠娣.高效液相色谱法测定左旋多巴/苄丝肼分散片血药浓度及其药代动力学研究[J].中国新药杂志,2001,10(2):110-112.
[6]张晓燕,周威,杨静,等.多巴丝肼胶囊在Beagle犬体内的生物等效性[J].中国医药工业杂志,2011,42(10):773-776.
[7]Vickers S,Stuart E K,Bhucker H.Further studies on the metabolism of carbidopa L-hydrazine-3,4-dihydroxy-methyl benzenepropanoic acid monohydrate in the human,rhesus monkey,dog and rat[J],Med Chem,1975,18(2):134.
[8]路枚,黄雪梅,蒙大平.反相高效液相色谱法测定人血清中左旋多巴的浓度[J].中国医院药学杂志,2001,21(10):602-604.
[9]Chiara Muzzi,Erica Bertocci,Lucia Terzuoli,et al.Simultaneous determination of serum concentrations of levodopa,dopamine,3-O-methyldopa and a-methyldopa by HPLC[J].Biomed Pharmacother,2008,62:253-258.
[10]柯蒙,林翠鸿,王长连.中国青年男性左旋多巴药动学研究[J].海峡药学,2010,22(4):157-159.
[11]王建,谢林,王大为,等.HPLC法测定人血浆中左旋多巴和卡比多巴浓度及其药代动力学研究[J].中国药科大学学报,2004,35(3):139-243.
[12]孟慧.高效毛细管电泳法测定血清中左旋多巴的含量[J].人民军医,2004,47(6),323-325.
[13]国家药典委员会.中国药典 [S].二部.北京:中国医药科技出版社,2010:108-109.
[14]唐敏.多潘立酮与左旋多巴相互作用[J].药学情报通讯,1989,7(2):132.
