热休克蛋白90α在女性巨乳症中的表达及意义
2014-11-02徐晨,栗勇,王钠,雷鸣
徐 晨, 栗 勇, 王 钠, 雷 鸣
实验研究
热休克蛋白90α在女性巨乳症中的表达及意义
徐 晨, 栗 勇, 王 钠, 雷 鸣
目的探讨巨乳中的热休克蛋白90α的表达及定位,并分析其在巨乳症发病中的作用机制。方法采用免疫组化法测定40例巨乳乳腺组织及40例正常体积乳腺组织中热休克蛋白90α的表达及定位。结果热休克蛋白90α在巨乳乳腺组织中的表达率为87.5%,在正常体积乳房乳腺组织中的表达率为22.5%。两者差异具有统计学意义。结论热休克蛋白90α在巨乳症乳腺组织中呈高表达,提示热休克蛋白90α可能参与了巨乳症的发生及发展。
巨乳症; 热休克蛋白90α; 组织增殖
巨乳症又称乳房肥大症,是指女性乳房过度发育,腺体及脂肪组织过度增生,体积超常,与躯体明显失调[1]。而乳房大小的定义标准因种族、地域、文化以及生活习惯而不同,目前还没有完全统一的认识,巨乳症的机制目前还不完全清楚。有研究表明,巨乳症乳腺组织的病理改变以乳腺小叶上皮组织及小叶间质纤维组织增生为主[2],因此,巨乳症发病过程中最重要的细胞活动之一就是增殖。目前,参与细胞增殖的各种调控因子有很多,针对这些因子的研究,会对巨乳症的治疗提供新的方向。热休克蛋白90α(heat shock protein 90α, Hsp 90α)是细胞受应激原刺激后诱导产生的一组应激蛋白。有研究表明,Hsp 90α可促进细胞迁移,并通过调节细胞周期促进细胞增殖[3]。有大量研究表明,Hsp90表达异常与乳腺恶性肿瘤、消化道癌、肺癌、肾癌、膀胱癌等有关。自2012年2月至2013年7月,笔者采用免疫组化法检测Hsp90在巨乳中的表达,并与正常体积乳房乳腺组织中Hsp90表达做对比,探讨巨乳症发病机制。
1 临床资料
选择第四军医大学西京医院整形外科40例单侧乳房总量在600 ml以上、单侧乳房切除总量在300 g以上的女性患者作为实验组。年龄19~61岁,平均31岁。平均体质量指数为23.25。所有患者均签署知情同意书。为进一步分析研究结果,我们将实验组又以是否哺乳及单侧乳房是否大于1000 ml进行分组。选择我科40例原发性乳房下垂行乳房悬吊的患者作为对照组,术中于切除组织中取少量样本。年龄20~44岁,平均28岁,平均体质量指数22.55;单侧乳房体积在250~350 ml,250~350 ml[4]。其年龄、体质量指数与实验组相比,差异无统计学意义(采用两样本t检验,P>0.05)。乳房体积的测量方法及乳房体积计算公式与王钠等[4]采用的方法相同。计算公式:乳房体积=33.5×PP+37.7×FP-1305(测量时患者取站立位,PP为乳房底部的周长,P为定位乳房下皱壁中点在乳房前表面的投影点,测量P点至乳房下皱壁的直线距离为FP)。所有患者经病理诊断和病史回顾有下列情况之一者被排除在本研究之外:①有乳腺纤维瘤病史;②2个月内有服用雌激素类药物史;③有乳腺癌家族史或病史;④切除组织标本中有囊肿、积液或积乳;⑤月经周期不规律;⑥有妊娠史;⑦乳头溢液;⑧组织病理学检查有非典型增生。所有手术均避开月经期,安排在经期后第2~3 周。
2 方法
2.1 主要试剂 兔抗人Hsp90多克隆抗体,链霉菌抗生物素蛋白-过氧化物酶(Sp)免疫组织化学试剂盒(美国CHEMICON公司)。
2.2 具体操作 取术中切取的组织标本5~10 g,用10%中性缓冲福尔马林固定24 h,石蜡包埋,4 μm连续切片,进行Sp免疫组织化学法检测。用已知Hsp90表达阳性的乳腺癌组织切片(图1)作为阳性对照,用PBS缓冲液代替一抗作为阴性对照。Sp免疫组化法参照说明进行。
2.3 结果判断 显微镜下,细胞核或细胞浆出现棕黄色颗粒状沉淀、背景无明显着色为阳性,阴性无棕黄色颗粒沉淀。40倍下,每张切片随机取5个视野,每个视野以阳性细胞数占总细胞数的百分比作为标准,取平均值。阴性<10%(-),轻度阳性11%~25%(+),中度阳性26%~75%(),强阳性()76%~100%。
2.4 统计学方法 所有数据采用SPSS 19.0统计软件进行处理,两组的Hsp90阳性率比较用χ2检验。实验组中各因素的进一步比较采用费歇尔精确概率检验,以P<0.05为差异具有统计学意义。
3 结果
实验组中,Hsp 90α呈棕黄色颗粒沉淀,均在增生小叶上皮细胞及导管上皮细胞的细胞核、细胞浆中表达,阳性表达率为87.5%(图2)。对照组中,Hsp 90α呈微弱表达,阳性表达率仅为22.5%(图3)。两组中Hsp 90α表达差异具有统计学意义(P<0.05)。实验组按是否哺乳分成的两组,Hsp 90α的表达差异无显著的统计学意义(P>0.01)。按单侧乳房体积是否>1000 ml分成的两组,Hsp 90α表达差异无显著的统计学意义(P>0.01),见表1。
4 讨论
目前巨乳症的发病机制尚不清楚,有学者认为,其与体内雌激素分泌增多等有关,但大多数巨乳症患者外周血清雌激素处于正常水平,也有学者认为,巨乳症与乳腺内雌激素受体增多有关[5]。王钠等[4]发现,雌激素受体γ在巨乳症组织中表达率(83.52%)明显高于正常体积乳房组织(25.94%),认为在巨乳症中,雌激素受体γ蛋白的表达增高。韩文雅等[6]采用免疫组化Sp法分别测定10例原发性小乳症女性和6例青春期巨乳女性以及10例妊娠后巨乳女性乳腺组织中雌激素受体(estrogen receptor, ER)和孕激素受体(progesterone receptor, PR)的表达发现,ER在原发性小乳症女性乳腺组织中与巨乳患者(青春期巨乳和妊娠后巨乳)乳腺组织中的表达差异有统计学意义(P<0.05);PR在原发性小乳症女性乳腺组织中与青春期巨乳患者乳腺组织中的表达差异无统计学意义(P>0.05),但PR在青春期巨乳中与妊娠后巨乳乳腺组织中的表达差异有统计学意义(P<0.05),故认为青春期巨乳的发生可能与乳腺组织中ER的表达水平相关;而妊娠后巨乳的发生可能与乳腺组织中ER、PR的表达水平均相关。但众多学者对巨乳症的发病机制仍有争议。张芾男等[7]报道,在青春期巨乳症乳腺组织和原发性小乳症乳腺组织中,细胞周期蛋白D1的阳性表达率分别为83.33%和16.67%,两者比较差异具有统计学意义(P<0.01),认为细胞周期蛋白D1在青春期巨乳症乳腺组织中的表达水平明显高于原发性小乳症乳腺组织。以上观点都有大量临床实验支持,但并都不是导致巨乳症乳腺组织增殖的唯一因素,巨乳症的具体增殖机制仍在探索。病理学研究表明,巨乳症乳腺组织的病理改变以乳腺小叶上皮组织及小叶间质纤维组织增生为主[2]。由此可以推论,细胞增殖应是巨乳症发病过程中最重要的细胞活动之一,而参与细胞增殖调控的各种因子有可能成为巨乳症形成的主要或干预性治疗的靶点。目前有大量实验表明,Hsp 90α在乳腺癌、胃癌等恶性增殖组织中呈高表达。但Hsp 90α是否参与了巨乳症中良性乳腺组织的增殖,目前还未见报道。
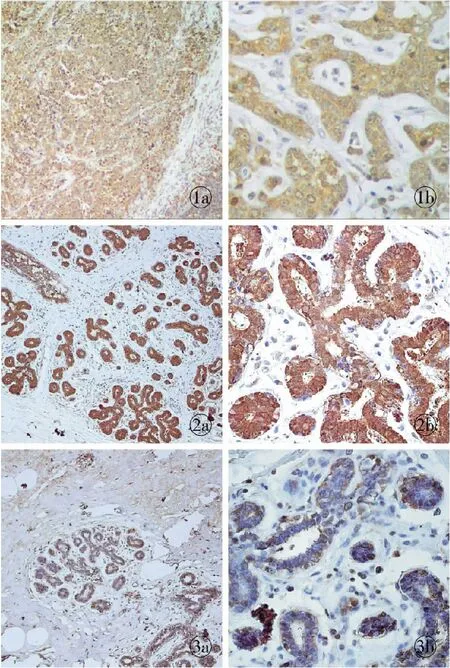
图1 在乳腺癌组织中Hsp 90α高表达 a.×10 b.×40图2 巨乳症乳腺组织中Hsp 90α在乳腺小叶及导管上皮细胞的细胞核、细胞浆呈阳性表达 a.×10 b.×40图3 正常乳腺中Hsp 90α低表达 a.×10 b.×40
Fig1 Strong expression of Hsp 90α in breast cancer tissue. a. ×10. b.×40.Fig2 Positive expression of Hsp 90α in the nucleus and cytoplasm of ducts and lobules in the mammary hypertrophy breast tissues. a. ×10. b. ×40.Fig3 Weak expression of Hsp 90α in normal breast tissue. a. ×10. b. ×40.
表1 Hsp 90α的表达与巨乳症之间的关系
Tab1 Relationship between the mammary hypertrophy and expression of Hsp 90α

项目正常乳房组织肥大乳房组织哺乳因素有无体积大小>1000ml<1000mlN40328319-313131+54142〹482102〺0174144
机体在应激情况下会引起热休克蛋白的诱导表达[8]。按照分子量大小,热休克蛋白分为六大家族,即Hsp100,Hsp90,Hsp70,Hsp60,Hsp40,还有小分子热休克蛋白及泛素[9]。热休克蛋白通常与具有不同功能的多种蛋白质在细胞中形成复合体调节细胞的活性及功能,但又不参与靶蛋白的组成,因此,热休克蛋白又被认为是一种分子伴侣,或伴侣蛋白[10]。Hsp90是热休克蛋白家族中最活跃的分子伴侣之一,根据是否含有谷氨酰胺丰富的片段分为Hsp 90α和Hsp90β,两者同源性高达84%[11]。在病毒的转化和化学诱导的肿瘤细胞以及愈合的创面中,Hsp 90α表达水平均明显升高,而Hsp90β 基本不变[12],Hsp90积极参与了细胞的浸润和增殖、血管的形成,可见Hsp90在细胞的增殖方面起着重要作用。目前,已知Hsp90能与100多种目的分子结合,调节和维持细胞的发育、增殖和分化。有研究表明,Hsp90通过磷脂酰肌醇3激酶/蛋白激酶A信号通路促进血管形成。也有研究表明在低氧等应激条件下,成纤维细胞和血管内皮细胞分泌Hsp 90α至胞外,当这些Hsp 90α迅速聚集达到100 μM的阈值时,会促进细胞的迁移。Cheng等[13]研究表明,低密度脂蛋白相关受体蛋白1(lipoprotein receptor-related protein-1, LRP-1)可以调节Hsp 90α的表达。在正常细胞以及肿瘤细胞中,存在“低氧→Hsp 90α分泌→LRP-1→细胞迁移或浸润”分泌途径,正常细胞在应激条件下,如热休克、低氧等,分泌Hsp 90α,Hsp 90α通过调节因子HIF-1α与LRP-1受体结合后,Hsp 90α可以通过自分泌或旁分泌因子促进细胞迁移,从而促进组织的增殖[14]。Gronthos等[15]证实,Hsp 90α能够促进创面愈合所需的角质形成细胞、成纤维细胞、血管内皮细胞的迁移,且不受转化生长因子-β3(transforming growth factor3-β, TGF-β3)的影响。有实验证明,乳腺癌肿瘤细胞表达HIF-1α→HIF-1α进核与HIF-1β结合形成二聚体→促使细胞分泌Hsp 90α→分泌的Hsp 90α与胞膜上受体CD91结合→增强细胞迁移和侵袭能力,促进肿瘤形成[16]。经Hsp90反义脱氧寡核昔酸处理的肿瘤细胞不仅表现出生长抑制,而且诱导该细胞凋亡。由此推测,Hsp90作为一种重要的基因产物参与了恶性肿瘤细胞增殖的转录调控过程[16],因此,Hsp 90α在乳腺组织的恶性增生中具有一定作用。
本研究结果显示,实验组中Hsp 90α阳性表达率明显高于对照组(P<0.05),巨乳症组阳性表达多见于细胞浆及部分细胞核,说明组织中Hsp 90α的表达增加与巨乳症密切相关。为了进一步探讨Hsp90在已哺乳乳腺组织和乳房肥大的乳腺组织中的表达是否有差异,我们将巨乳症患者再依据哺乳史分为两组,结果发现,Hsp 90α在两组中的表达差异无统计学意义(P>0.05),由此说明,哺乳因素对Hsp 90α在巨乳症乳腺组织中的表达无影响。我们在将巨乳症患者依据单侧乳房体积是否大于1000 ml分为两组,结果发现两组间Hsp 90α表达差异无统计学意义(P>0.05)。可见乳房肥大程度对Hsp 90α表达无影响,此结果的造成原因也可能与小于1000 ml的乳房肥大患者较少有关。
本实验证实,Hsp 90α在巨乳症乳腺组织中存在高表达,说明作为一种伴随现象,Hsp 90α在巨乳中的表达是增高的,那么Hsp 90α是否参与了巨乳症的发生和发展呢?Hsp 90α在癌组织中高表达,而在巨乳症组织中也同样高表达,同样高表达为什么前者癌变而后者却没有?以上问题目前还不能得出结论。但已有体外实验证实,用抑制剂格尔德霉素耗竭Hsp 90α可使表皮生长因子受到抑制,从而抑制肿瘤组织及正常组织的血管形成,抑制组织生长。因此,以Hsp 90α作为靶点做进一步地研究,对巨乳症的治疗及发病机制的探索具有参考意义。
[1] Yang Y, Sun J. Subcutaneous mastectomy for juvenile mammary hypertrophy: a clinical experience[J]. Breast Journal, 2013,19(6):689-690.
[2] Setia N, Crisi G M, Pantanowitz L. Mastocytosis of the female breast[J]. Int J Surg Pathol, 2010,18(5):374-378.
[3] Cortés-González CC, Ramirez-Gonzalez V, Ariza AC, et al. Functional significance of heat shock protein 90[J]. Rev Invest Clin, 2008, 60(4):311-320.
[4] 王 钠, 栗 勇, 苏映军, 等. 巨乳症的临床病理研究[J]. 国际外科学杂志, 2013,40(10):665-668.
[5] Agbenorku P. A long term review of surgically treated enlarged breasts[J]. MPS, 2013,3:113-119.
[6] 韩文雅, 赵天兰, 张永胜, 等. 雌孕激素受体与各类型巨乳发生发展的关系[J]. 苏州大学学报(医学版), 2009,29(2):318-320.
[7] 张芾男, 滕 利, 张卓男, 等. 细胞周期蛋白 D1 在青春期巨乳症和小乳症乳腺组织中的表达[J]. 中华医学美学美容杂志, 2010,16(2):106-108.
[8] Jego G, Hazoumé A, Seigneuric R, et al. Targeting heat shock proteins in cancer[J]. Cancer letters, 2013,332(2):275-285.
[9] Xu Q, Metzler B, Jahangiri M, et al. Molecular chaperones and heat shock proteins in atherosclerosis[J]. Am J Physiol Circ Physiol, 2012,302(3):H506-H514.
[10] Lomiwes D, Farouk MM, Wiklund E, et al. Small heat shock proteins and their role in meat tenderness: a review[J]. Meat Sci, 2014,96(1):26-40.
[11] Garcia-Carbonero R, Carnero A, Paz-Ares L. Inhibition of HSP90 molecular chaperones: moving into the clinic[J]. Lancet Oncol, 2013,14(9):e358-e369.
[12] Carretero-Paulet L, Albert VA, Fares MA. Molecular evolutionary mechanisms driving functional diversification of the HSP90A family of heat shock proteins in eukaryotes[J]. Mol Biol Evol, 2013,30(9):2035-2043.
[13] Cheng CF, Fan J, Fedesco M, et al. Transforming growth factor α(TGFα)-stimulated secretion of HSP90α: using the receptor LRP-1/CD91 to promote human skin cell migration against a TGFβ-rich environment during wound healing[J]. Mol Cellular Biol, 2008,28(10):3344-3358.
[14] Chen JS, Hsu YM, Chen CC, et al. Secreted heat shock protein 90α induces colorectal cancer cell invasion through CD91/LRP-1 and NF-κB-mediated integrin αV expression[J]. J Biol Chem, 2010,285(33):25458-25466.
[15] Gronthos S, McCarty R, Mrozik K, et al. Heat shock protein-90 beta is expressed at the surface of multipotential mesenchymal precursor cells: generation of a novel monoclonal antibody, STRO-4, with specificity for mesenchymal precursor cells from human and ovine tissues[J]. Stem cells Dev, 2009,18(9):1253-1262.
[16] 赵正维. 乳腺癌细胞中HSP90α的分泌及其作用机制[D]. 第四军医大学, 2010:9.
Expressionofheatshockprotein90αinmammaryhypertrophyanditssignificance
XUChen,LIYong,WANGNa,etal.
(DepartmentofPlasticSurgery,XijingHospital,theFirstAffiliatedHospitalofFourthMilitaryMedicalUniversity,Xi′an710032,China)
ObjectiveTo investigate expressions of Hsp90α and its position, analyzing the mechanism of action in formation of mammary hypertrophy.MethodsTissues (80 samples) were collected from 40 patients with mammary hypertrophy and 40 patients with normal breast and the expression of Hsp90α and its position were determined by immunohistochemistry.ResultsThe protein level of Hsp90α was significantly increased in mammary hypertrophy tissues (87.5%) compared with that in normal tissues (22.5%).ConclusionHsp90α may plays an important role in the development of mammary hypertrophy.
Mammary hypertrophy; Heat shock protein 90α; Hyperblastosis
10.3969/j.issn.1673-7040.2014.03.020
R655.8
A
1673-7040(2014)03-0185-04
2013-10-28)
710032 陕西 西安,第四军医大学西京医院 整形外科
徐 晨(1984-),男,辽宁人,住院医师,硕士.
